遺伝子変異を介さない細胞初期化によるがん化メカニズムを解明
2021-08-19 東京大学,日本医療研究開発機構
発表者
山田 泰広(東京大学医科学研究所 附属システム疾患モデル研究センター 先進病態モデル研究分野 教授)
発表のポイント
- マウス生体内で細胞初期化(iPS細胞化)を誘導すると、胚細胞腫瘍(注1)に類似したがんが誘導された。
- 形成されたがん細胞から正常細胞に変化できるiPS細胞が樹立可能であり、がん細胞を経由するiPS細胞の新しい樹立経路を明らかにした。
- 胚細胞腫瘍の発生には、遺伝子変異を介さない細胞の初期化が関与している可能性が示された。
発表概要
がんは、遺伝子配列の傷(遺伝子変異)の蓄積により発生すると考えられています。東京大学医科学研究所 先進病態モデル研究分野の田口純平特任研究員、同分野の山田泰広教授、AMED-CRESTらの研究グループは、生体内で細胞初期化(iPS細胞化)を誘導できる遺伝子改変マウスを使用することで、全能性(注2)の特徴を持つがんである胚細胞腫瘍の発生過程には、遺伝子変異とは独立した、エピゲノム制御(注3)(遺伝子配列の使い方)の変化にもとづいた細胞の初期化が重要であることを明らかにしました。また、網羅的なエピゲノム解析を行うことにより、Dmrt1遺伝子が胚細胞腫瘍の発生や、細胞の全能性状態への初期化(リプログラミング(注4))に関与すること、さらに、この特徴がヒト胚細胞腫瘍の治療標的となることを見出しました。本研究は、がん細胞を経由するiPS細胞の新しい樹立経路を提示するとともに、特定の遺伝子変異が見つからないがんの発生メカニズムの解明や、その特徴に着目した新規がん治療法の開発につながる可能性を示しました。
この研究成果は2021年8月19日午後6時(日本時間)に「Nature Communications」で公開されました。
研究の背景
胚細胞腫瘍は主に精巣や卵巣に好発するがんで、生殖細胞(精子や卵)のもとになる始原生殖細胞ががん化することにより発生すると考えられています。一般的にがんは遺伝子変異の蓄積が原因であることが知られていますが、特に胚細胞腫瘍では遺伝子変異の頻度が少なく、胚細胞腫瘍発生の原因は不明でした。
私たちの体は多種多様な細胞から構成されますが、もともとはたった1つの受精卵に由来します。受精卵は個体を形成するためのすべての細胞をつくりだす能力をもっており、これは全能性と呼ばれます。受精卵は分裂を繰り返し、発生過程のごく初期に胚体成分(将来体になる細胞)と胚体外成分(胎盤や卵黄嚢になる細胞)に分かれます。運命が分かれた後はこれら細胞種の間で相互の運命転換は起こらないとされています(私たちの体の細胞は胎盤の細胞には変化しない)。しかしながら、胚細胞腫瘍は、もともとは胚体成分に由来するにもかかわらず、しばしば腫瘍の中に胚体外成分(胎盤細胞や卵黄嚢細胞)が認められ、全能性の特徴(胚体成分と胚体外成分の両方に変化できる)を持つことが知られていました。しかし、胚細胞腫瘍がどのようにして全能性の特徴を獲得するのかについては分かっていませんでした。
山田教授らのグループは胚細胞腫瘍の発生過程には「全能性状態への細胞初期化」が関与するのではないかと仮説を立てました。細胞に初期化因子(山中4因子)を働かせることで、体の中の様々な細胞に変化できるiPS細胞が樹立できます。iPS細胞技術は細胞運命を初期化する技術であり、その特徴を使った再生医療への応用が注目されています。細胞運命の変化は細胞特異的なエピゲノム制御(遺伝子配列の使い方)によって規定されており、細胞初期化や細胞分化は、遺伝子配列情報の変化ではなく、遺伝子配列の使い方、すなわちエピゲノム制御の変化によって誘導されます。以前、山田教授らの研究グループは、生体内で不完全な細胞初期化を誘導することで、小児がんに類似したがんが形成されることを見出し、エピゲノム制御異常に起因した発がんメカニズムを提唱していました(Ohnishi et al., Cell 2014)。
この技術にもとづいて山田教授らの研究グループは、生体マウスの細胞に初期化を誘導することで、胚細胞腫瘍の発生メカニズムの解明を試みました。
研究結果
- (1)生体内で細胞初期化を起こすと胚細胞腫瘍に類似したがんが形成された(図1)。
- 研究グループは、マウス生体内の細胞に様々な条件で初期化を誘導し、その影響を調べました。通常の初期化誘導では奇形腫(注5)が形成される一方で、初期化因子を強く働かせた場合、初期化因子の働きを止めた後でも活発に増殖を続ける異型細胞が発生することが分かりました(図1上)。これらの異型細胞は、浸潤や転移を示し、がん細胞と同様に振る舞いました(図1下右)。また、発生した異型細胞では生殖細胞に関連した遺伝子が発現し、生殖細胞の発生過程にのみ認められるゲノムインプリンティング(注6)の消失を認めました(図1下左)。さらに腫瘍内には胚体外成分(胎盤細胞)も観察され(図1下中)、全能性の特徴を持っていました。これらはいずれも胚細胞腫瘍に認められるもので、胚細胞腫瘍の発生には細胞の初期化が関与していることが示唆されました。
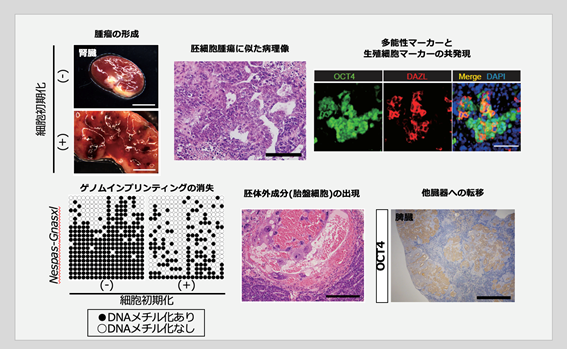
図1.マウス生体内での細胞初期化によって形成された胚細胞腫瘍に類似したがん- (2)胚細胞腫瘍に類似したがん細胞に由来するiPS細胞は正常な組織に変化した(図2)。
- 誘導された胚細胞腫瘍に類似したがん細胞を試験管内で培養したところ、iPS細胞を樹立することができました。このがん細胞に由来するiPS細胞を用いてキメラマウス(注7)を作製したところ(図2左)、iPS細胞は胚体成分だけでなく、胚体外成分(胎盤)にも変化することができ、全能性の特徴をもっていることが確認されました(図2右上)。また、このがん細胞に由来するiPS細胞から作製したキメラマウスにがんは認められませんでした(図2右下)。つまり、がん細胞をiPS細胞へと変化させることでがん細胞の性質を打ち消すことに成功しました。この結果は、このがん細胞の発生は遺伝子配列異常(遺伝子変異)のような不可逆的なプロセスを経るのではなく、可逆的なエピゲノム制御の変化を介して起こることを示唆しています。
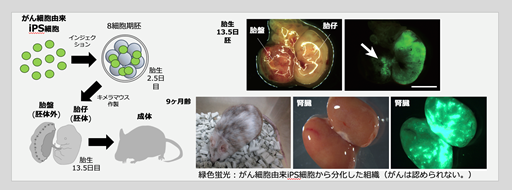
図2.胚細胞腫瘍に類似したがん細胞に由来するiPS細胞は正常組織の細胞へと変化する- (3)胚細胞腫瘍に類似したがん細胞の発生にはDMRT1が重要である(図3)。
- 胚細胞腫瘍に類似したがん発生のキーとなる因子を同定するため、網羅的なエピゲノム解析(ATACシークエンス(注8))を行ったところ、候補遺伝子としてDmrt1が同定されました。Dmrt1は生殖細胞で特徴的に発現している転写因子をコードする遺伝子です。Dmrt1遺伝子を破壊して細胞初期化を誘導したところ、胚細胞腫瘍に類似したがんの発生が強く抑制されたことに加えて、胚体外成分(胎盤細胞)の出現頻度も低下することが分かりました(図3左下)。反対に、通常は胚体外成分に変化しないES細胞にDmrt1を強制発現させると、胎盤細胞へ変化することが分かりました(図3右)。さらにヒト胚細胞腫瘍細胞株にDmrt1遺伝子を働かせると、がん細胞は胎盤細胞へと変化し、増殖を停止することを示しました。これらの結果から、Dmrt1は胚細胞腫瘍の発生や様々な胚細胞腫瘍の性質の獲得に重要であり、胚細胞腫瘍の治療標的となりうることが明らかとなりました。
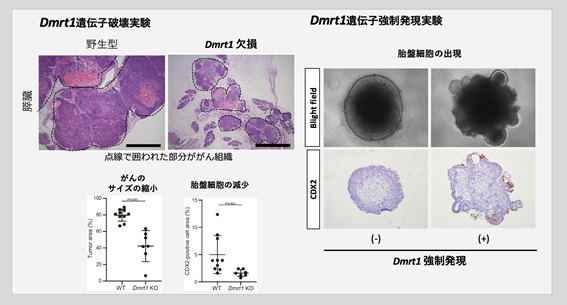
図3.DMRT1による胚細胞腫瘍の発生促進と全能性の特徴獲得
まとめ
がんの原因は遺伝子変異の蓄積であると考えられており、がん治療標的を同定するためにがん組織の遺伝子配列解析を行い遺伝子変異を同定する取り組みが盛んに行われています。今回、遺伝子配列情報を変化させずに細胞運命を変化させるiPS細胞技術を使用することで、胚細胞腫瘍の発生には遺伝子配列の異常ではなく、遺伝子配列の使い方、すなわちエピゲノム制御の変化が重要である可能性を示しました。また胚細胞腫瘍に類似したがん細胞から生体内の様々な細胞へと変化可能なiPS細胞を樹立することに成功しました。この結果は、体細胞からiPS細胞への細胞初期化の過程には、がん細胞を経由する新規のルートが存在することを示唆します。さらに、がん細胞をiPS細胞へと変化させ、エピゲノム状態をリセットすることによってがんの性質を打ち消すことに成功しました(図4)。本研究成果は、未だ完全に理解されていないiPS細胞樹立メカニズムに新たな知見をもたらすとともに、特徴的な遺伝子変異が見つからないがんの発生メカニズムの理解や、エピゲノム制御に介入した新規のがん治療法の開発に貢献すると考えられます。また、哺乳類ライフサイクルの根幹を担う細胞の全能性獲得メカニズムの全容解明にも貢献する可能性があります。
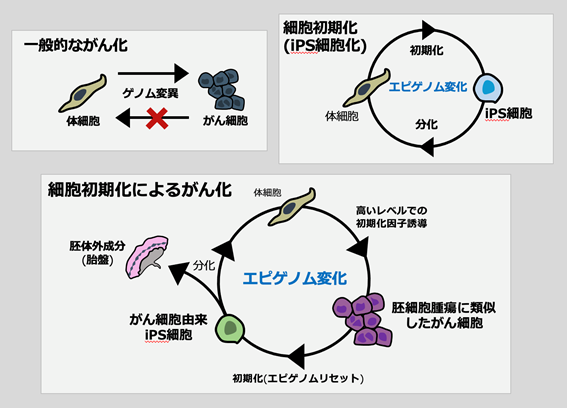
図4.本研究のまとめ 細胞初期化によるエピゲノム発がん
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の次世代がん医療創生研究事業(P-CREATE)、革新的先端研究開発支援事業(AMED-CREST)「全ライフコースを対象とした個体の機能低下機構の解明」、戦略的国際共同研究プログラム(SICORP)、および日本学術振興会(JSPS)科学研究費助成事業の研究助成により実施しました。
発表雑誌
- 雑誌名
- Nature Communications(2021年8月19日オンライン版)
- 論文タイトル
- DMRT1-mediated reprogramming drives development of cancer resembling human germ cell tumors with features of totipotency
- 著者(和名)
- 田口純平1#, 柴田博史2、蒲田未央2、加藤雅紀3、福田渓3、田中彰人2、太田翔1、鵜飼智代1、光永佳奈枝2、山田洋介2、長岡創4、山澤翔5、大西紘太郎2、Woltjen Knut2、牛久哲男5、小沢学6、斎藤通紀2,4,7、眞貝洋一3、山本拓也2,7,8,9、山田泰広1,9*
(#:筆頭著者、*:責任著者)- 東京大学医科学研究所 先進病態モデル研究分野
- 京都大学iPS細胞研究所(CiRA)
- 理化学研究所 眞貝細胞記憶研究室
- 京都大学大学院医学研究科 生体構造医学講座 機能微細形態学
- 東京大学 医学部・大学院医学研究科 病因・病理学専攻 人体病理学・病理診断学分野
- 東京大学医科学研究所 生殖システム研究分野
- 京都大学高等研究院ヒト生物学高等研究拠点(ASHBi)
- 理化学研究所 革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム
- 日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)
(所属は研究当時)
- DOI
- 10.1038/s41467-021-25249-4
用語解説
- (注1):胚細胞腫瘍
- 一般的に生殖細胞が起源となって発生するがんを指す。発症年齢や部位、組織型によっていくつかのタイプに分類されるが、本研究では精巣や卵巣にできるtypeⅡを対象としている。胚細胞腫瘍に含まれる胎児性がんは、しばしば胚体外成分を含むがん(絨毛がん・卵黄嚢腫瘍)と混在して発生する例があり、全能性(以下に記載)の特徴をもつことが知られている。
- (注2):全能性
- 1つの細胞から個体を構成するすべての細胞(胚体成分:将来体になる細胞、胚体外成分:胎盤や卵黄嚢になる細胞)をつくりだせる能力のこと。マウスでは、受精卵や2細胞期胚からおおよそ8細胞期胚までの発生初期の限られた細胞がこの能力をもっている。
- (注3):エピゲノム制御
- DNAの塩基配列情報の変化に依存せず、表現型や遺伝子発現量を変化させる仕組みに関する学問領域のことをエピジェネティクスと呼ぶ。主にDNAメチル化やヒストン修飾、クロマチンの3次元構造などが対象となり、これらの状態が変化することをエピジェネティックな変化と呼ぶ。また、細胞におけるエピジェネティックな状態の総体をエピゲノムと呼ぶ。
- (注4):リプログラミング
- 細胞のもともとの性質を他の性質に変化させること。iPS細胞を用いた再生医療では、線維芽細胞などをiPS細胞に初期化(リセット)した後、心筋細胞や血球細胞に再分化させるといったように、細胞のリプログラミング技術が応用されている。なおリプログラミングは遺伝子の配列情報の変化ではなく、エピジェネティックな変化によって誘導される。
- (注5):奇形腫
- 体を構成する3種の成分(三胚葉)である内胚葉・中胚葉・外胚葉を含んだ良性腫瘍を指す。iPS細胞は多分化能をもつため、本研究における奇形腫形成の結果は、体細胞の初期化により生体内でiPS細胞が誘導できたことを示している。
- (注6):ゲノムインプリンティング
- 一般的に哺乳類は父親と母親から遺伝情報を一対ずつ引き継ぐため、一遺伝子につき2つのコピーをもっている。しかし一部の遺伝子については片方の親から引き継いだ遺伝子のみが発現する。このように父親由来か母親由来かを遺伝子レベルで記憶している現象をゲノムインプリンティングと呼び、主にエピジェネティック修飾であるDNAメチル化が制御を担っている。(最近ではヒストン修飾もこの機構を制御していることが報告されている。)哺乳類のライフサイクルにおいて、ゲノムインプリンティングは体細胞において厳格に維持されるが、唯一生殖細胞がつくられる過程で消失する。本研究で観察されたゲノムインプリンティングの消失は、体細胞に高いレベルでの初期化を誘導したことによって生殖細胞(胚細胞腫瘍)の性質が付与されたことを示している。
- (注7):キメラマウス
- 2種以上の遺伝形質の異なる細胞を使用して作られたマウスのこと。ここでは、胚細胞腫瘍由来iPS細胞を野生型マウスの初期胚の中に移植して得られたマウスを指す。iPS細胞は緑色蛍光タンパク(GFP)により寄与が確認できるようにしている。
- (注8):ATACシークエンス
- ゲノム上のオープンなクロマチン領域の分布を網羅的に検出・解析する手法のこと。一般的にクロマチン状態は遺伝子の転写状態と相関しており、転写の活性化した領域はオープンなクロマチン状態をとっている。本研究では、胚細胞腫瘍由来iPS細胞のオープンクロマチン領域を解析したところ、DMRT1の結合領域が濃縮していた。
お問い合わせ先
本研究に関すること
東京大学 医科学研究所 附属システム疾患モデル研究センター 先進病態モデル研究分野
教授 山田 泰広(やまだ やすひろ)
報道に関するお問い合わせ
東京大学医科学研究所 国際学術連携室(広報)
AMEDの事業に関すること
次世代がん医療創生研究事業(P-CREATE)
日本医療研究開発機構
創薬事業部 医薬品研究開発課
革新的先端研究開発支援事業(AMED-CREST)
シーズ開発・研究基盤事業部 革新的先端研究開発課
戦略的国際共同研究プログラム(SICORP)
国際戦略推進部 国際戦略推進課