2021-09-14 東京都医学総合研究所,日本医療研究開発機構
(公財)東京都医学総合研究所・感染制御プロジェクトの山根大典主席研究員、小原道法特別客員研究員らの研究チームは、お茶の水女子大学の市育代准教授、林優里大学院生(研究当時博士課程)らの研究チームとともに、肝細胞の脂質代謝プロファイルを詳細に解析し、フェロト―シス*1と呼ばれる、鉄依存的な脂質過酸化*2を促進することで細胞死を誘導する経路を介して、脂肪酸代謝がC型肝炎ウイルス複製を抑制するという新たな仕組みを明らかにしました。本研究成果は、フェロトーシス誘導因子が抗ウイルス作用をもつことをはじめて示しただけでなく、細胞のフェロトーシス誘導機構の新たな一面を明らかにしました。この発見は、フェロトーシス経路を標的とした新たな抗ウイルス療法の開発に繋がるものと期待されます。
本研究成果は、2021年9月13日に米国科学誌「Cell Chemical Biology」にオンライン掲載されました。
研究成果のポイント
- 脂肪酸不飽和化酵素FADS2は多価不飽和脂肪酸*3の産生を促進することで過酸化脂質を増加させ、C型肝炎ウイルスの複製を抑制する
- 多価不飽和脂肪酸の脂質過酸化反応は鉄を必要とし、鉄を除去するとC型肝炎ウイルスの複製が増強する
- フェロトーシス誘導剤*4は脂質過酸化を促進することでウイルス複製を抑制し、ウイルスプロテアーゼ阻害剤によるウイルス抑制効果を高める
研究の背景
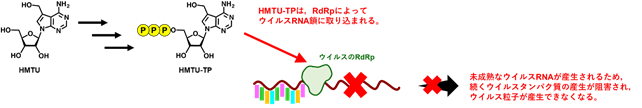
C型肝炎ウイルス(HCV)は、肝細胞に持続感染することで慢性肝炎を引き起こし、肝硬変や肝癌を引き起こす病原体です。本研究グループはこれまでにHCVの複製が脂質過酸化によって強力に抑制されること(Yamane et al.,Nature Medicine,2014, 20:927-35.)、さらにビタミンE等の脂質過酸化を抑制する脂溶性抗酸化物によってウイルス複製が増強されることを明らかにしてきました。しかしながら、HCVを抑制する脂質過酸化がどのようにして生じるのかについては解明されていませんでした。
研究の内容
本研究グループは、HCV複製の抑制に関与する脂質過酸化が起こるメカニズムを詳しく調べたところ、(1)脂肪酸の不飽和化酵素であるFADS2(Fatty acid desaturase 2)が細胞内の多価不飽和脂肪酸を増大させることにより、過酸化脂質を増加させる要因となっていること、(2)細胞内に存在する鉄が活性酸素の生成を介して脂質過酸化反応を促進すること、さらに(3)脂質過酸化反応を促進する薬剤がウイルスの複製を抑制する効果があることを見出しました。
今回注目した多価不飽和脂肪酸は、動脈硬化を防いだり、血圧の低下やLDLコレステロールを低下させたり等良い面が知られています。一方で、熱や空気に触れると酸化され過酸化脂質になりやすい性質をもちます。通常ヒトは多価不飽和脂肪酸を体内で合成できないとされており、食物から摂取することで必要量を得ています。研究で用いる培養細胞の場合も同様に、培地に含まれるウシ胎仔血清から多価不飽和脂肪酸を取り込むことで供給されています。しかしながら、ウイルス感染実験に用いられる培養細胞内にどのような多価不飽和脂肪酸が存在しているかについては、これまで詳しくわかっていませんでした。詳細な解析の結果、健康な細胞内に豊富に含まれているω-6脂肪酸であるアラキドン酸の他に、多価不飽和脂肪酸の欠乏時に細胞内でオレイン酸から合成されるω-9脂肪酸であるミード酸と呼ばれる多価不飽和脂肪酸が豊富に含まれることが判明しました(図1)。このように、研究に広く用いられている培養細胞においては、生体内においては脂肪酸欠乏状態にのみ合成されることが知られているミード酸の合成経路が活発に働いていることがわかり、通常のヒトの生体内とは異なる脂質代謝が行われていることがわかりました。培養細胞において、多価不飽和脂肪酸の不飽和化を担う酵素であるFADS2の発現を低下させると、ミード酸やアラキドン酸の合成が抑制され、その結果過酸化脂質の量が減少することを見出しました。
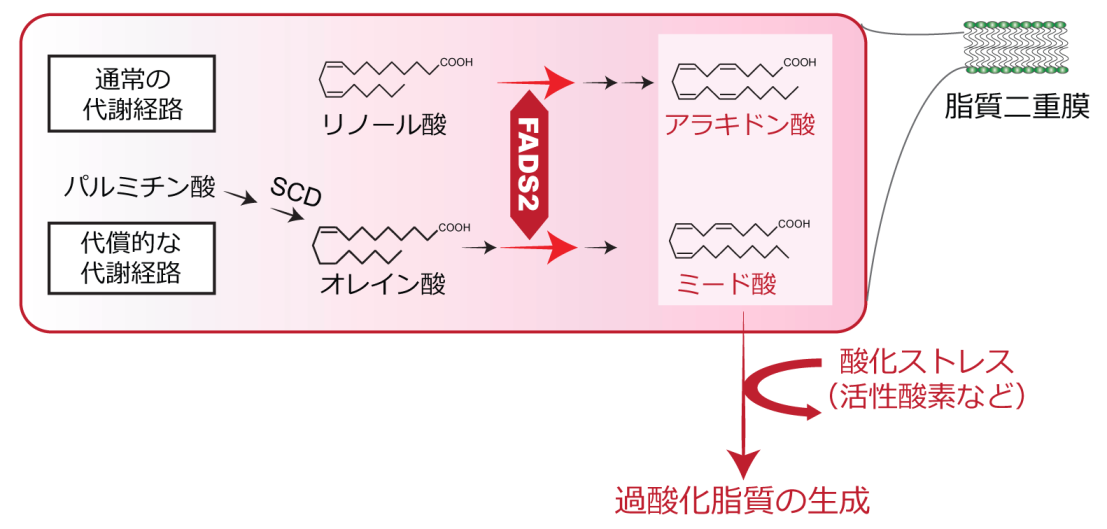 図1生体内においては、通常リノール酸をFADS2が不飽和化することで、アラキドン酸を合成する経路が開始されます。一方、リノール酸が欠乏した環境では、オレイン酸からミード酸を合成する代償的な代謝経路が活性化します。本研究では、培養細胞内においてこの代償的なミード酸を合成する経路が活発に機能していることを明らかにしました。細胞内のFADS2によりアラキドン酸やミード酸が蓄積すると、酸化反応が進行し過酸化脂質が生じやすくなると考えられます。
図1生体内においては、通常リノール酸をFADS2が不飽和化することで、アラキドン酸を合成する経路が開始されます。一方、リノール酸が欠乏した環境では、オレイン酸からミード酸を合成する代償的な代謝経路が活性化します。本研究では、培養細胞内においてこの代償的なミード酸を合成する経路が活発に機能していることを明らかにしました。細胞内のFADS2によりアラキドン酸やミード酸が蓄積すると、酸化反応が進行し過酸化脂質が生じやすくなると考えられます。
多価不飽和脂肪酸が酸化される仕組みについて調べたところ、鉄キレート剤を用いて細胞内の鉄を除去すると細胞内の過酸化脂質が顕著に減少したことから、鉄が脂質過酸化反応に中心的な役割を担っていることがわかりました。このように鉄によって促進される脂質過酸化が関与する現象として「フェロトーシス」と呼ばれる細胞死が近年報告されています。この細胞死は、細胞内に最も豊富に含まれる抗酸化物質の一つであるグルタチオンの合成を妨げる薬剤によって引き起こされ、鉄依存的な脂質過酸化の蓄積が亢進されることで細胞死が誘導されることから、鉄依存的な細胞死という意味でフェロトーシスと命名されました(図2)。このような作用をもつものはフェロトーシス誘導剤と呼ばれ、エラスチン(erastin)やRSL-3をはじめとする複数の化合物がこれまでに報告されています。フェロトーシス誘導剤は癌細胞のみを選択的に殺傷することが報告されたことから、近年、癌治療の分野で脚光を浴びています。
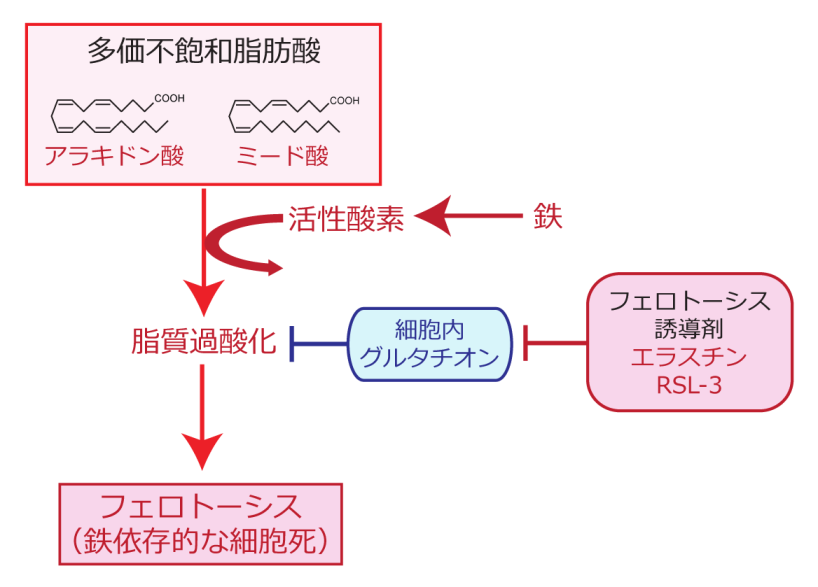 図2細胞内にFADS2が合成するアラキドン酸やミード酸をはじめとする多価不飽和脂肪酸が豊富にある状況において、エラスチンなどのフェロトーシス誘導剤を細胞に添加すると、細胞内のグルタチオン量が減少し酸化ストレスが蓄積します。その結果、鉄を介して生じた過酸化脂質が消去されず、フェロトーシスと呼ばれる細胞死が誘導されます。
図2細胞内にFADS2が合成するアラキドン酸やミード酸をはじめとする多価不飽和脂肪酸が豊富にある状況において、エラスチンなどのフェロトーシス誘導剤を細胞に添加すると、細胞内のグルタチオン量が減少し酸化ストレスが蓄積します。その結果、鉄を介して生じた過酸化脂質が消去されず、フェロトーシスと呼ばれる細胞死が誘導されます。
HCVの複製における鉄依存的な脂質過酸化の影響を調べるため、鉄キレート剤によって感染細胞内の鉄を除去したところ、HCVの複製量が顕著に増加しました。鉄を介した脂質過酸化がHCV複製を抑制していることが示唆されたことから、フェロトーシス誘導剤を用いて鉄依存的な脂質過酸化を促進すれば、フェロトーシスを誘導しない濃度の薬剤でもHCVの複製を抑制できるのではないかと考えました。そこで、フェロトーシス誘導剤であるエラスチンを細胞に加えたところ、フェロトーシスを誘導しない低濃度においてもウイルス複製複合体(レプリカーゼ)*5の活性を抑制する効果が認められました。さらにHCVレプリカーゼの機能を抑制するメカニズムを追究するため、レプリカーゼの構成要素であるRNAポリメラーゼ(NS5Bタンパク質)やプロテアーゼ(NS3/4Aタンパク質、RNAヘリカーゼ活性も有する)の構造変化を調べました。その結果、低濃度のエラスチンは、フェロトーシスを引き起こさない程度の脂質過酸化の誘導を介して小胞体膜上に発現しているウイルスのプロテアーゼの立体構造の変化をもたらし、その変化によりレプリカーゼ機能が阻害されることを突き止めました。さらに、この構造変化は、臨床で抗ウイルス治療に使用されているウイルスプロテアーゼ阻害剤の標的親和性を高め、ウイルス抑制効果を顕著に向上させることがわかりました(図3)。
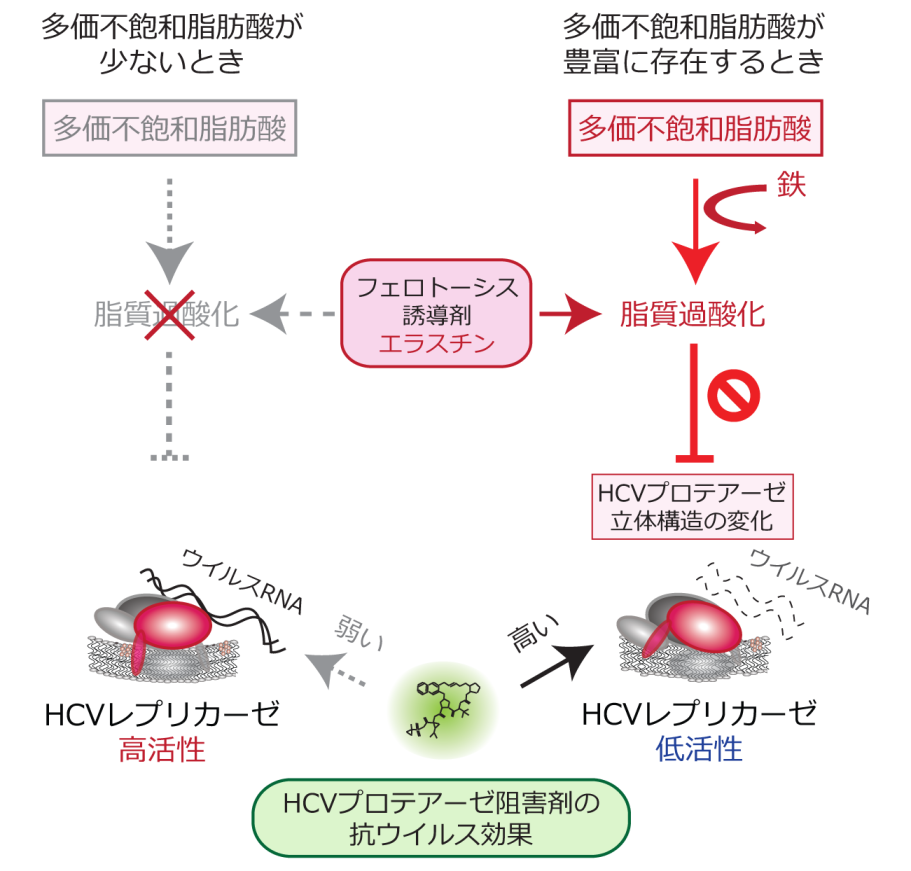 図3細胞内に多価不飽和脂肪酸が豊富に存在する環境では、フェロトーシス誘導剤を加えると脂質過酸化が促進され、レプリカーゼを構成するHCVプロテアーゼ(赤色で示したタンパク質)の立体構造が変化することでウイルス複製量が低下します。また、この構造変化によりHCVプロテアーゼ阻害剤の標的HCVタンパク質に対する親和性が上昇し、ウイルス抑制作用が増強されます。一方、多価不飽和脂肪酸の量が少ない環境においては、フェロトーシス誘導剤による脂質過酸化は生じず、HCVレプリカーゼの複製能は高く保たれます。また、HCVプロテアーゼ阻害剤による抑制作用が減弱します。
図3細胞内に多価不飽和脂肪酸が豊富に存在する環境では、フェロトーシス誘導剤を加えると脂質過酸化が促進され、レプリカーゼを構成するHCVプロテアーゼ(赤色で示したタンパク質)の立体構造が変化することでウイルス複製量が低下します。また、この構造変化によりHCVプロテアーゼ阻害剤の標的HCVタンパク質に対する親和性が上昇し、ウイルス抑制作用が増強されます。一方、多価不飽和脂肪酸の量が少ない環境においては、フェロトーシス誘導剤による脂質過酸化は生じず、HCVレプリカーゼの複製能は高く保たれます。また、HCVプロテアーゼ阻害剤による抑制作用が減弱します。
社会的意義・今後の展望
近年、経口抗ウイルス薬が開発されたことによりC型肝炎の治癒率は劇的に向上しました。しかしながら、現在も世界中で不顕性感染を含め約5,800万人の感染者が存在していると見積もられており、HCV感染に起因する様々な肝疾患、薬剤耐性、HCV排除後の発癌など解決すべき問題が多く残されています。
本研究において、フェロトーシス誘導剤が脂質過酸化を促進することでウイルス抑制作用を発揮することを見出したことから、フェロトーシス標的化合物が癌治療のみならず、抗ウイルス薬としても応用できる可能性が示唆されました。フェロトーシス誘導剤は肝細胞癌にも著効を示す例が報告されており、フェロトーシス経路を標的とすることで抗ウイルスと抗癌作用を併せもつ治療法の開発へと繋がることが期待されます。
用語説明
- *1:フェロトーシス
- 鉄依存的な脂質過酸化の蓄積によって誘導される、アポトーシスとは異なる様式の細胞死です。2012年に米国コロンビア大学のStockwellらのグループにより、はじめて報告されました。癌細胞を特異的に殺傷するメカニズムとして、癌治療の分野で注目を浴びています。
- *2:脂質過酸化
- 不飽和脂肪酸に存在する炭素間の2重結合を標的とする酸化反応を指し、その結果生じるマロンジアルデヒド、アクロレイン、4-ヒドロキシノネナールなどの有害産物がDNAやタンパク質と反応することで、様々な細胞の機能障害を引き起こすと考えられています。酸化反応の仕組みとして、リポキシゲナーゼやシクロオキシゲナーゼ等の酸化酵素を介した酵素的経路と、酵素を介さずラジカル連鎖反応により誘導される非酵素的経路が存在します。
- *3:多価不飽和脂肪酸
- 脂肪酸の骨格となる炭素間の2重結合が2つ以上存在する脂肪酸を指します。通常、ヒトの生体内では合成できないため、食物から必須脂肪酸(リノール酸、αリノレン酸)として摂取することで補っています。生体内の多価不飽和脂肪酸としては、リノール酸やアラキドン酸、ドコサヘキサエン酸が豊富であり、2重結合の数が多いほど酸化を受けやすい性質をもちます。
- *4:フェロトーシス誘導剤
- エラスチンやRSL-3、システイナーゼ等が主に研究に使用されています。エラスチンは、グルタチオンの原材料となるシステインの取り込み阻害により細胞内グルタチオンを枯渇させ、細胞の酸化ストレスを増大させます。RSL-3はグルタチオン還元酵素であるグルタチオンペルオキシダーゼ4(GPX4)の阻害を介して酸化ストレスを誘導し、フェロトーシスを引き起こします。
- *5:ウイルス複製複合体(レプリカーゼ)
- HCV RNAゲノムの複製を担う機能的な複合体を指し、NS3、NS4A、NS4B、NS5A、NS5Bの5つのHCVタンパク質により構成されます。これらの中で、NS5BがRNAポリメラーゼ活性、NS3/NS4A複合体がプロテアーゼ活性に加えてRNAヘリカーゼ活性を有します。これら5つ全てのHCVタンパク質がレプリカーゼ機能に必須です。
本研究の主な助成事業
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「肝炎等克服実用化研究事業 肝炎等克服緊急対策研究事業」における研究開発課題「肝細胞に内在する抗ウイルスシグナルの解明を基軸とした新規抗ウイルス戦略の開発」(研究開発代表者:山根大典)(21fk0210062h0003)、日本学術振興会(JSPS)科学研究費補助金の支援を受けておこなわれました。
論文情報
- タイトル
- FADS2-dependent fatty acid desaturation dictates cellular sensitivity to ferroptosis and permissiveness for hepatitis C virus replication
「FADS2による脂肪酸不飽和化が細胞のフェロトーシス感受性とC型肝炎ウイルス複製許容性を規定する」 - 著者
- Daisuke Yamane, Yuri Hayashi, Moe Matsumoto, Hiroki Nakanishi, Haruka Imagawa, Michinori Kohara, Stanley M. Lemon, and Ikuyo Ichi
- 発表雑誌
- 米国科学誌「Cell Chemical Biology」(2021年9月13日オンライン掲載)
お問合せ先
研究に関すること
公益財団法人東京都医学総合研究所
山根 大典(ヤマネ ダイスケ)
東京都医学総合研究所に関すること
公益財団法人東京都医学総合研究所
事務局研究推進課:武仲・大井
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課