2021-10-25 早稲田大学,日本医療研究開発機構
発表のポイント
- 非免疫細胞である上皮細胞が、がんの元となる前がん細胞を認識し、攻撃・排除するという免疫細胞様の監視システムがあることを明らかにした。
- 前がん細胞で発現が促進したMHC-Iを認識する、上皮細胞の受容体AltRを新規に同定し、その排除能惹起メカニズムを解明した。
- MHC-Iのリコンビナントタンパク質をマウスに投与することで、前がん細胞に対する上皮細胞の排除能が促進されたことから、本研究結果は、がんを予防的に治療するための革新的な医療の確立へとつながることが期待される。
概要
早稲田大学高等研究所の丸山剛(まるやま たけし)准教授を中心とする研究グループは、このたび、非免疫細胞である上皮細胞が前がん細胞のMHC-I*1を認識し、さらにその上皮細胞が前がん細胞を生体から排除していることを解明しました。
肺や腸などの表層を構成する上皮細胞は「細胞競合」という、がんの元となる前がん細胞を排除する攻撃機能を持っています。しかしこれまで、上皮細胞が前がん細胞の何を認識し、攻撃機能を上昇させているかについては不明でした。今回解明された上皮細胞による前がん細胞に対する認識機構を応用することで、前がん細胞の効率的な排除が可能であり、将来的にはがんを予防的に治療するための革新的な医療の確立へとつながると期待されます。
本研究成果は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(PRIME)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「時空間的異常センシングによるがん変異細胞除去修復」(研究開発代表者:丸山剛)等の支援のもと行われたもので、『Nature Immunology』のオンライン版に2021年10月22日(金)(現地時間)に掲載されました。
これまでの研究で分かっていたこと(科学史的・歴史的な背景など)
哺乳類の上皮細胞は、がん変異を生じた細胞(前がん細胞)を攻撃し、体外へ排除する機能を持っています(細胞競合)。正常な上皮細胞は前がん細胞に接触することでプライミング(活性化)され、前がん細胞に向かって細胞骨格形成因子を集積させることで、上皮細胞層から前がん細胞を押し出すことがわかっていました。しかしながら、プライミングされた上皮細胞がどのようなリガンド・受容体相互作用*2を介して、前がん細胞を認識しているかについては不明でした。
今回の研究で新たに実現しようとしたこと、明らかになったこと
本研究グループは、前がん細胞を認識するプライミングされた上皮細胞の受容体として、機能が解明されていない免疫グロブリン(Ig)様ドメイン-タンパク質を同定し、これをCanis suboptimal alteration recognizing protein(Canis AltR)と名付けました。このタンパク質は、前がん細胞に接することでプライミングされた正常細胞で発現が増加します(図1左下)。
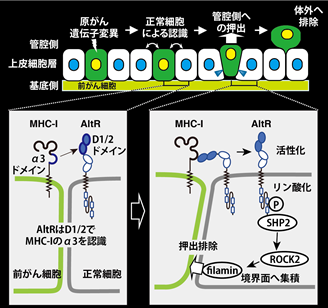
図1.正常細胞は前がん細胞のMHC-Iを認識し、攻撃排除する。
一方で、前がん細胞ではRasV12タンパク質*3の発現によって、MHC-Iの発現が促進することが報告されています。Ig様ドメインはMHC-Iと結合する可能性のあるドメインとされていることから、本研究グループは、正常細胞のIg様ドメインを持つ受容体AltRは前がん細胞のMHC-Iに結合する、すなわち上皮細胞はAltRによって、前がん細胞のMHC-Iを認識しているのではないかと仮説を立てました。
in vitroの細胞競合モデル*4を用いた解析により、正常上皮細胞上のAltRが、前がん細胞で発現するMHC-Iと相互作用することによって、細胞内ドメインがリン酸化されることが分かりました。また、リン酸化により活性化したAltRは下流のSHP2-ROCK2シグナル経路を介して細胞骨格形成因子filaminを前がん細胞との境界面に集積させることで、前がん細胞を押し出す力を誘発することが示されました(図1右下)。
さらにMHC-IとAltRの結合領域の絞り込みによって、MHC-Iの細胞外ドメインであるα3ドメインとAltRの細胞外ドメインであるD1/2ドメインが相互作用することが明らかとなりました。非常に興味深いことに、in vitro細胞競合モデルにおいて、MHC-I α3ドメインのリコンビナントタンパク質*5(rec.MHC-I α3)を投与したところ、正常な上皮細胞による前がん細胞の排除が促進されることが見出されました(図2左、イラスト)。一方で、AltRのD1/2ドメインのリコンビナントタンパク質*5(rec.AltR D1/2)の投与では、前がん細胞の排除が抑制されました(図2中央、イラスト)。
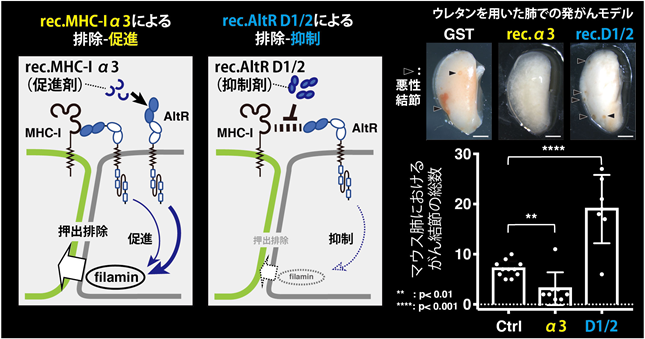
図2.α3処理は上皮細胞の攻撃能を促進することで、発がんを抑制する。
またさらに、in vivoマウスモデル*6における腫瘍形成と発がんにおいては、rec.MHC-I α3の投与は悪性結節*7の形成を抑制しました(図2右、ウレタン発がんモデル、悪性結節:写真中▶)。この結果は、rec.MHC-I α3の投与によって、上皮細胞の排除機能が促進され、前がん細胞が排除されたことで、悪性結節の形成が抑制されたこと示唆しています。加えて、rec.AltR D1/2の投与では前がん細胞の排除が抑制された結果、悪性結節(図2右、写真中▶)の形成が促進されました。これらのことから、前がん細胞のMHC-Iを上皮細胞が認識することで、上皮細胞が前がん細胞を排除し、発がんが抑制されていることが示唆されました。
このように、非免疫細胞である上皮細胞が、前がん細胞のMHC-Iを、AltRを介して認識するという免疫細胞様の監視システムがあることが示されました。また、この監視システムをもとにした上皮細胞による前がん細胞の排除が、発がんを抑制するメカニズムであることが明らかとなってきました。
研究の波及効果や社会的影響
今回解明された機構をもとにして得られたrec. MHC-I α3は、マウスにおいて発がんを抑制することを見出しています。将来的には、がんを予防的に治療するための革新的な医療へとつながる可能性が高く、研究の更なる発展が期待されます。
今後の課題
本研究をもとにしたがんの予防的な治療法が確立されることが期待されますが、前がん細胞は検出することが非常に難しいため、前がん細胞を検出する技術の開発が今後の課題です。この検出技術の発展により、rec.MHC-I α3などをもとにした治療薬が活躍すると考えられます。
用語解説
- *1 MHC-I
- MHC-I(Major Histocompatibility Complex class I)は細胞内のタンパク質を抗原として細胞外に提示する細胞膜タンパク質で、さまざまな細胞の表面に発現することで、一般的に免疫細胞にシグナルを発信するリガンドとして働く。異常を持つ細胞ではMHC-Iを積極的に発現させることで、自身が異常細胞であることを免疫細胞に伝える役割を果たしている。
- *2 リガンド(MHC-I)・受容体(AltR)相互作用
- リガンド・受容体相互作用は、タンパク質同士の相互作用の一つで、多くの場合リガンドがそれを受容するタンパク質(受容体)に結合することで、その受容体を発現する細胞の特定の機能や細胞内シグナルなどを有効化する。AltR(suboptimal alteration recognizing protein)はMHC-Iと相互作用しうるIg様ドメインを持つタンパク質(細胞膜タンパク質受容体)であるが、その機能は解明されていなかった。今回、上皮細胞は前がん細胞と接触することで、この受容体(AltR)の発現量を上昇させ、膜タンパク質リガンドであるMHC-Iのシグナルを受容することが明らかとなった。
- *3 RasV12タンパク質
- 原がん遺伝子Rasの12番目のグリシン(G)がバリン(V)に変異することで、がん遺伝子RASV12となる。このがん遺伝子RASV12にコードされるタンパク質がRasV12である。RasV12はタンパク質Rasの恒常活性型で、上皮細胞においては細胞極性崩壊や細胞増殖促進させるなどにより、細胞のがん化促進の原因となる。
- *4 in vitroの細胞競合モデル
- 正常な培養細胞(イヌ腎臓上皮細胞MDCK細胞やヒト皮膚上皮細胞HaCaT細胞)とRasV12を発現する前がん細胞を共培養することで、細胞競合現象をin vitro(培養ディッシュ上)で再構築したシステムのこと。正常細胞と前がん細胞を混合し単層を形成させたあとに前がん細胞のRasV12の発現を誘導することで、上皮細胞層中に前がん細胞が生じた段階を模倣している。細胞層中の前がん細胞は、正常細胞に押し出されて最終的に上皮細胞層の頂端側に排除される。
- *5 リコンビナント(rec.MHC-I α3もしくはrec.AltR D1/2)
- 正常細胞のAltRとの相互作用部位であるMHC-Iの細胞外ドメインであるα3ドメイン、またα3ドメインの結合するAltRのD1/2ドメインをそれぞれリコンビナントタンパク質rec.MHC-I α3とrec.AltR D1/2として人工的に精製した。Rec.MHC-I α3は、正常細胞のAltRと相互作用することで、正常細胞の攻撃機能を促進する。一方で、rec.AltR D1/2はMHC-IとAltRの相互作用を競合的に阻害することで、正常細胞の攻撃機能の惹起を阻害する。
- *6 in vivoマウスモデル
- マウスに腫瘍形成や発がんさせる実験系であり、瘍形成過程の観察や発がんへの関与を解析できる。腫瘍形成に関しては、マウスに正常HaCaT細胞と前がん細胞を混合し皮下移植することで、マウスの皮下における腫瘍形成過程を観察できる。発がんに関しては、マウスにウレタンを投与すると肺において原がん遺伝子Rasにがん変異が生じ、発がんが誘導される。発がんの初期段階では肺に悪性結節*7が形成される。
- *7 悪性結節
- 肺において細胞が異常に増殖した結果、細胞濃度が高くなっている病変部位が結節である。がんの前病変である悪性結節では、発がんの初期段階に観察される。ウレタンを用いたin vivoマウスモデルでは、悪性結節中の細胞において原がん遺伝子Rasにがん変異が生じている。
論文情報
- 雑誌名
Nature Immunology - 論文名
Epithelial cells remove precancerous cells by cell competition via class I MHC-LILRB3 interaction - 執筆者名(所属機関名)
鮎川志優1、鴨下渚2†、中山淳1†、寺本龍平1、Novalia Pishesha3、大庭賢二a4、佐藤奈波5、小澤慶5、安部光1、仙波憲太郎1、合田亘人1、藤田恭之5,6、丸山剛2,*
(1 早稲田大学大学院先進理工学研究科生命医科学専攻、2 早稲田大学高等研究所、3 ハーバード大学、4 自治医科大学分子病態治療研究センター遺伝子治療研究部、5 北海道大学遺伝子病制御研究所分子腫瘍分野、6 京都大学医学部分子腫瘍学、† These authors are equally contributed、* 責任著者) - 掲載日時(現地時間)
2021年10月22日(金) - 掲載URL
 Epithelial cells remove precancerous cells by cell competition via MHC class I–LILRB3 interaction - Nature ImmunologyEpithelial cells can use an immune-like mechanism to extrude neighboring precancerous cells; however, the recognition an...
Epithelial cells remove precancerous cells by cell competition via MHC class I–LILRB3 interaction - Nature ImmunologyEpithelial cells can use an immune-like mechanism to extrude neighboring precancerous cells; however, the recognition an... - DOI
10.1038/s41590-021-01045-6
研究助成
- 研究費名
AMED革新的先端研究開発支援事業(PRIME) - 研究課題名
時空間的異常センシングによるがん変異細胞除去修復 - 研究代表者名(所属機関名)
丸山 剛(早稲田大学)
- 研究費名
JSTさきがけ - 研究課題名
光操作型-生体内不均一変異細胞誘導と変異細胞の挙動解明 - 研究代表者名(所属機関名)
丸山 剛(早稲田大学)
お問い合わせ先
研究内容に関するお問い合わせ先
早稲田大学高等研究所 准教授 丸山 剛
発信元
早稲田大学広報室広報課 担当:猪俣
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課