2021-11-10 神戸大学,大阪大学,日本医療研究開発機構
神戸大学大学院医学研究科の仁田亮教授、西條由見子学術研究員らの研究グループは、大阪大学微生物病研究所のDaron M Standley教授・山本雅裕教授の研究グループ(Standley教授・山本教授ともに同大学免疫学フロンティア研究センター・感染症総合教育研究拠点兼任)、理化学研究所放射光科学研究センターの坂井直樹研究員らとの共同研究により、病原性寄生虫トキソプラズマ原虫注1の殺傷に関わるタンパク質であるIrgb6の結晶構造解析に成功しました。さらに、その分子構造をもとに行ったシミュレーションや細胞を使った検証実験によって、Irgb6がトキソプラズマの寄生胞膜を認識するメカニズムを分子レベルで解明しました。
本研究成果は、生体の寄生虫感染防御反応のなかでも重要な「感染した寄生虫の居場所を見つける仕組み」を分子レベルで明らかにしたもので、今後、生体の防御反応をうまく利用した新しい治療薬の開発につながるものと期待されます。
この研究成果は、2021年11月9日に国際学術誌Life Science Allianceにオンライン公開されました。
ポイント
- 病原性寄生虫トキソプラズマの殺傷に重要なIrgb6の詳細な分子構造を解明することに成功しました。
- 詳細な分子構造とシミュレーション実験から、Irgb6の構造そのものにトキソプラズマ寄生胞膜の成分PI5Pを認識し結合する機能が備わっていることがわかりました。
- この研究成果はトキソプラズマ症のワクチンや新薬の開発につながるものと期待されます。
研究の背景
トキソプラズマ原虫(Toxoplasma gondii)はトキソプラズマ症の原因となる寄生虫です(図1)。生体に感染したトキソプラズマは、細胞内に寄生胞と呼ばれる小胞を作って寄生し潜伏しますが、健康な生体内では免疫のはたらきによってトキソプラズマの増殖が阻害され、発病には至りません。ヒトの場合、エイズを発症したり、臓器移植を受けたりして免疫不全状態になると、体内でトキソプラズマが増殖し、脳炎や肺炎・肝炎などを発症して死に至ることがあります。また、妊婦が初めてトキソプラズマに感染した場合、胎盤を通じて胎児に感染が及ぶことがあり、胎児の流産・死産だけでなく、新生児に水頭症や精神・運動機能障害、視力障害といった先天性異常が生じたりします。
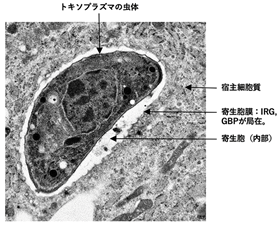
図1 トキソプラズマ原虫の透過型電子顕微鏡像
宿主細胞内で寄生胞を作り、その内部で増殖する。
生体内でトキソプラズマが急激に増殖しようとすると、免疫細胞が分泌するインターフェロンと呼ばれる物質のはたらきによってIRG(IFN-γ–inducible immunity-related GTPase)と呼ばれるタンパク質とGBP(Guanylate-binding proteins)と呼ばれるタンパク質が合成されます。それらがトキソプラズマの寄生胞の膜に集積すると、膜が変形し、破壊され、結果、トキソプラズマは殺傷されます。これらのタンパク質群の中でもIrgb6とよばれるタンパク質が重要で、Irgb6が最初に寄生胞膜に動員され、寄生胞膜の変形・破壊の反応が進むことがわかっていますが、Irgb6が寄生胞膜を認識して蓄積するメカニズムは不明でした。このメカニズムを解明するためにはIrgb6の立体構造の情報が必要でしたが、これまでにIrgb6の構造解析の報告はありませんでした。
研究の内容
共同研究チームはIrgb6の構造情報を得るために、Irgb6のX線結晶構造解析注2を行い、その立体構造を原子レベルで解明することに成功しました(図2)。解明された分子構造とすでに報告されている研究結果から、Irgb6のGドメインの反対側の部分が寄生胞膜との結合部位ではないかと推測されました。そこでIrgb6とリン脂質とのドッキングシミュレーション注3を行ったところ、予測された結合部位に寄生胞膜特有の構成成分であるPI5P(リン脂質の一種)がぴったりはまって結合することがわかりました(図3)。結合部位の立体構造を決めているアミノ酸を別のアミノ酸に変えて結合部位の構造を少し変えてみると、PI5Pとの結合力が著しく弱まることから、この結合部位の立体構造そのものがPI5Pを認識して結合するのにとても適していることがわかりました。細胞を使った検証実験でも、アミノ酸を変えたIrgb6は寄生胞膜へ動員されず、同時に他のIRGも蓄積されず、トキソプラズマの殺傷に至らないことが確認されました。以上の研究結果から、Irgb6の立体構造そのものに寄生胞膜のPI5Pを適切に認識する機能があり、Irgb6がPI5Pと結合して寄生胞膜に蓄積し、他の寄生胞膜破壊に関わるタンパク質を効率よく寄生胞膜に導くことで、トキソプラズマの殺傷に大きく貢献していることが明らかになりました。
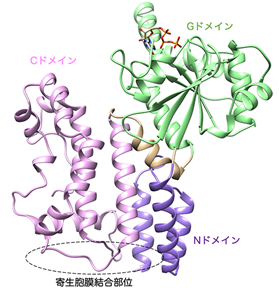
図2 Irgb6(GTP結合型)の結晶構造
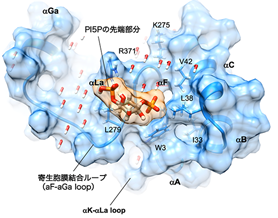
図3 Irgb6とPI5P(先端部分)の結合の様子
図2を下から見る。PI5Pはその中央部に結合する。
今後の展開
トキソプラズマ症に有効なワクチンはありません。薬剤についても、副作用の問題や薬剤耐性出現の懸念があります。本研究成果の「Irgb6が寄生胞膜を認識するメカニズム」の発見は、生体に本来備わる防御機構をうまく利用した新たな治療法の開発につながるものと期待されます。
用語解説
- 注1 トキソプラズマ原虫
- トキソプラズマ原虫は長径数μmの半円~三日月型をした原虫であり、細胞内に寄生する。ネコを終宿主とするが、中間宿主はヒトを含むほぼすべての恒温動物であり、ヒトにかぎっていえば,全世界の人口のうちの約1/3、数十億人に感染し、わが国だけでも数千万人に感染していると試算されている。
- 注2 X線結晶構造解析
- 生体分子の立体構造を明らかにする手法の一つ。精製したタンパク質をさまざまな環境条件下においてタンパク質の結晶を作る。そのタンパク質結晶にX線を照射し、得られた回折点の強度情報から立体構造をコンピューター上で計算し、原子モデルを決定する。
- 注3 ドッキングシミュレーション
- 薬物、ホルモン、栄養素といった低分子化合物を酵素などのタンパク質に結合させたときの結合力をコンピューター上で計算的に推定する技術。
謝辞
本研究は、日本医療研究開発機構(AMED)新興・再興感染症研究基盤創生事業(多分野融合研究領域)「原子レベルで解明するトキソプラズマ寄生胞膜破壊と病原性因子によるその破綻」(課題番号JP21wm0325010)、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業創薬等先端技術支援基盤プラットフォーム(BINDS)の課題番号JP20am0101070(支援番号2057)および日本学術振興会(JSPS)の科研費「トキソプラズマ寄生胞膜の破壊を先導するIRGB6とGBPの分子構造と機能の解析」(課題番号JP21K06988)、などの研究支援を受けて実施されました。
論文情報
- タイトル
- “Structural basis of membrane recognition of Toxoplasma gondii vacuole by Irgb6”
- DOI
- 10.26508/lsa.202101149
- 著者
- Yumiko Saijo-Hamano, Aalaa Sherif, Ariel Pradipta, Miwa Sasai, Naoki Sakai, Yoshiaki Sakihama, Masahiro Yamamoto, Daron Standley, and Ryo Nitta
- 掲載誌
- Life Science Alliance
お問い合わせ先
研究について
国立大学法人神戸大学 大学院医学研究科 生体構造解剖学分野
教授 仁田亮(ニッタ リョウ)
報道担当
国立大学法人神戸大学 総務部 広報課
AMED事業について
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課