若年層に多く、治りにくく予後が悪い、滑膜肉腫の新たな治療法として期待
2021-12-22 量子科学技術研究開発機構
発表のポイント
- 滑膜肉腫1)細胞に結合してα線2)を放出する標的アイソトープ治療3)薬候補アクチニウム225(225Ac)標識OTSA1014)を、滑膜肉腫モデルマウスに投与して、6割のマウスで腫瘍消失(完全奏効)が観察されました。
- 特に悪性度が高く、従来の治療法では十分な治療効果が得られなかった滑膜肉腫に対する新たな治療薬候補となることが期待されます。
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)量子生命・医学部門量子医科学研究所分子イメージング診断治療研究部の須藤仁美主任研究員、辻厚至グループリーダー、東達也部長は、宇治徳洲会病院、国立大学法人徳島大学、公益財団法人がん研究会の協力を得て、滑膜肉腫(がん)に対するα線放出核種アクチニウム225(225Ac)を用いた治療薬候補の作製に成功し、動物実験で、そのがん消失効果を明らかにしました。
滑膜肉腫は、皮下組織や筋肉などの軟部組織から発生する悪性軟部肉腫の一つです。発症頻度は低く「希少がん」に分類されますが、患者は若年層に多く、四肢を中心に全身に発症するがんです。がんが限局している場合は手術による切除が第一選択で、外照射放射線治療や化学療法も行われます。しかし、切除ができない場合や転移がある場合、完治が困難で治療成績は悪く、現時点では効果的な治療が確立していないため、新たな治療法が望まれています。
量研では、放射線の飛ぶ距離が細胞数個分で、当たった細胞を殺傷する能力が高いα線を放出する核種225Acを加速器で効率よく製造することに成功しています。225Acは、近年、前立腺がん特異的膜抗原を標的とした前立腺がんで注目されている標的アイソトープ治療用の放射性同位体です。
この225Acを滑膜肉腫細胞だけに届けることができれば、周囲の正常細胞を傷つけることなく、がん細胞を殺傷することが可能です。そこで、本研究チームは、滑膜肉腫がん細胞の細胞表面に多く存在しているFZD10というタンパク質5)に結合する抗体OTSA101(以下、「OTSA101」という。」)に、225Acを結合したα線標的アイソトープ治療薬候補として225Ac標識OTSA101を開発しました。
225Ac標識OTSA101を、滑膜肉腫のモデルマウスに1回投与したところ、6割のマウスモデルで腫瘍が完全に消失(完全奏効)することを確認しました。また、観察期間中に再増殖することはありませんでした。一方で、副作用の指標となる体重減少や病理所見における異常は認められませんでした。このことから、225Ac標識OTSA101は新たな治療薬候補として期待されます。
この成果は、がん研究の分野でインパクトの大きい論文が数多く発表されている日本癌学会誌「Cancer Science(Impact Factor:6.716)」2021年12月22日(水)14:00(日本時間)にオンライン掲載されました。
研究の背景と目的
滑膜肉腫は皮下組織や筋肉などの軟部組織から発生する悪性軟部肉腫の一つです。発症頻度は低い「希少がん」ですが、10~40代の若年層に、四肢を中心に全身に発生するがんです。限局している場合は、手術や化学療法、外照射放射線治療により治癒も期待出来ますが、しばしば肺転移やリンパ節転移をきたす、治療困難で予後が不良な悪性疾患(がん)のひとつです。希少がんであることから、あまり研究が進んでいないこともあり、アンメットメディカルニーズが高く、効果的な治療薬や治療法の開発が強く望まれている状況です。
量研は、放射線の飛ぶ距離が細胞数個分で、当たった細胞を殺傷する能力が高いα線を出す核種225Acを加速器で製造することに成功しています。この225Acを滑膜肉腫細胞に効率よく届けることが出来れば、周囲の正常組織に障害を与えることなく滑膜肉腫を治療することが可能ではないかと研究チームは考えました。
225Acを滑膜肉腫がん細胞に届ける手法として、正常細胞と比べて滑膜肉腫がん細胞の表面に非常に高密度に存在しているFZD10タンパク質に着目しました。そこで、オンコセラピー・サイエンス株式会社が製造した、FZD10タンパク質に強く結合する抗体医薬抗FZD10抗体OTSA101に225Acを付加した225Ac標識OTSA101を作製し、滑膜肉腫に対するそのがん増殖抑制効果をモデル動物において実証することを目的としました。
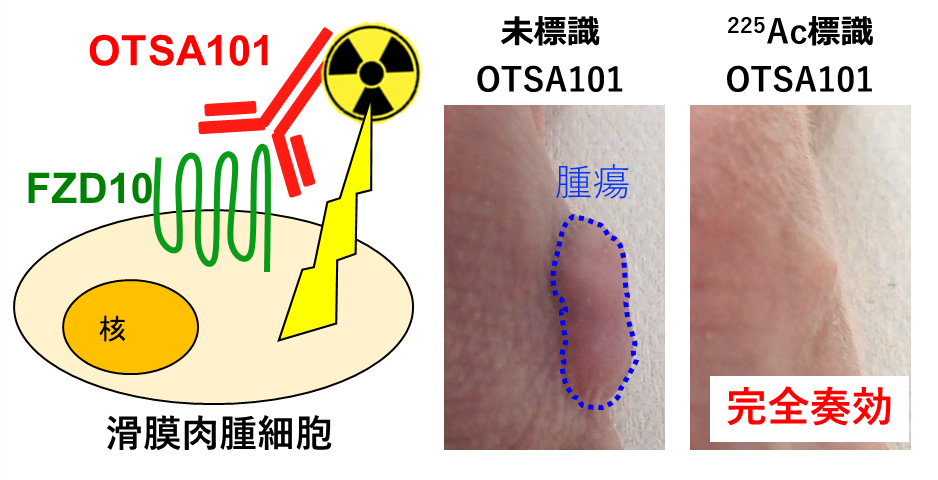
図1. FZD10及び放射性標識抗体
FZD10は、細胞膜表面に存在するタンパク質です。滑膜肉腫で高発現しています。本研究では抗FZD10抗体OTSA101を、α線放出核種アクチニウム225(225Ac)で放射性標識し、滑膜肉腫モデルマウスで治療効果を評価しました。
研究の手法と成果
α線標的アイソトープ治療薬候補として、225AcをOTSA101に結合させた225Ac標識OTSA101を作製しました。
滑膜肉腫細胞を皮下に移植した滑膜肉腫モデルマウスに未標識OTSA101および225Ac標識OTSA101 18.5kBq (キロベクレル6))をそれぞれ1回静脈投与して、腫瘍の大きさとモデルマウスの生存期間について28日間観察しました。
その結果、225Ac標識OTSA101では、60%のマウスで腫瘍の消失(完全奏効)が確認されました(図1、図2)。225Ac標識OTSA101の効果は観察期間中持続し、完全奏効したマウスでの、がんの再増殖は観察されませんでした(図2)。病理解析の結果、225Ac標識OTSA101では、細胞死(アポトーシス)が多く誘導されていることがわかりました(図3)。また、今回のような放射性標識抗体の場合の主な副作用である骨髄障害は観察されませんでした。225Acの放射線が届く範囲は0.1mmと非常に短く、正常組織への影響が抑えられたためと考えられます。このことは、225Ac標識OTSA101の投与量を増やして、さらに高い効果を得られる可能性を示すものです。
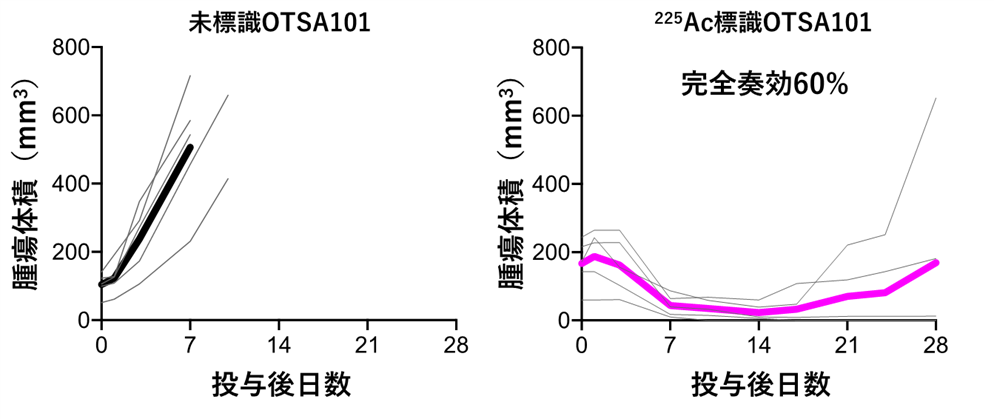
図2 治療効果
抗体投与後の腫瘍サイズの変化を示しています。左図は未標識OTSA101、右図は225Ac標識OTSA101 (18.5kBq)投与群(各群N=5)で、図中の太線は各群の平均値で、細線は各個体の結果です。
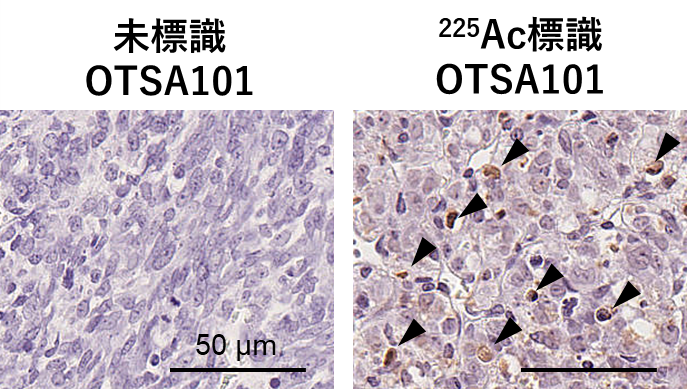
図3.病理解析
腫瘍内の細胞死(アポトーシス)の様子を示しています。左図は未標識OTSA101、右図は225Ac標識OTSA101 (18.5kBq)投与群の結果です。
今後の展開
本成果により、225Ac標識OTSA101によるα線標的アイソトープ治療は、滑膜肉腫に対する副作用の少ない、効果的な治療法となることが期待されます。
用語解説
- 滑膜肉腫
滑膜肉腫は皮下組織や筋肉などの軟部組織から発生する悪性軟部肉腫の一つです。発症頻度は低い希少がんですが、若年層を中心に発症し、しばしば肺転移やリンパ節転移を伴う治療困難、予後の悪い疾患です。発症場所としては四肢が多いですが、全身に腫瘤として発症します。
2)α線
α線はヘリウム(He)原子核が非常に速いスピードで飛んでいるものです。物質中を通過する際、物質と相互作用し、例えば物質中の分子が持っている電子を弾き飛ばします(電離といいます)。α線(He原子核)は質量が大きく、物質中の分子などと衝突しやすいため、透過性が非常に低く、紙一枚で遮断することができる代わりに、物質中では短い通過距離で高いエネルギーを付与することから、分子などを密に電離することができます。α線を細胞に照射した場合、DNAに修復することが難しいキズ(DNA二重鎖切断)ができます。この現象はα線が、がん細胞を効果的に殺滅できる理由のひとつです。
3) 標的アイソトープ治療
細胞傷害能力を有する粒子放射線(α線やβ線)を放出する放射性同位体を用いた治療法。RI内用療法、核医学治療とも呼ばれます。放射性同位体を体内に注射し、がん細胞を標的として、がん細胞に粒子放射線を体内から照射し殺傷します。
4) 225Ac標識OTSA101
α線を放出する核種であるアクチニウム225(225Ac)を抗FZD10抗体OTSA101に標識した放射性抗体医薬品候補です。OTSA101は、滑膜肉腫で高発現しているFZD10タンパク質に結合する抗体で、オンコセラピー・サイエンス株式会社で製造されました。FZD10タンパク質は、細胞の表面に存在するタンパク質で滑膜肉腫に対する新規治療薬開発の標的分子です。
5)FZD10タンパク質
FZD10はFrizzled homologue 10の略称です。細胞表面に存在しているタンパク質で、細胞の増殖や分化などに関与しているタンパク質と言われています。滑膜肉腫で高い発現をしており、滑膜肉腫がん細胞の増殖に関与していることがわかっています。
6)Bq(ベクレル)
Becquerelの略で、1秒間に崩壊する原子の個数を表す放射能の単位です。
論文について
FZD10-targeted a-radioimmunotherapy with 225Ac-labeled OTSA101 achieves complete remission in a synovial sarcoma model
Hitomi Sudo1, Atsushi B. Tsuji1, Aya Sugyo1, Yosuke Harada2, Satoshi Nagayama3, Toyomasa Katagiri4, Yusuke Nakamura5, and Tatsuya Higashi1
1Department of Molecular Imaging and Theranostics, National Institutes for Quantum Science and Technology (QST), Chiba 263-8555, Japan
2OncoTherapy Science Inc., Kanagawa, Japan
3Department of Surgery, Uji Tokushukai Medical Center, Kyoto, Japan
4Division of Genome Medicine, Institute of Advanced Medical Sciences, Tokushima University, Tokushima, Japan
5Cancer Precision Medicine Center, Japanese Foundation for Cancer Research, Tokyo, Japan