がん微小環境ネットワークシグナルを標的とした新規治療法の開発に期待
2019-07-03 東京医科歯科大学,日本医療研究開発機構
ポイント
- がんの進展を促進するがん関連線維芽細胞(CAF)*1の形成を制御するメカニズムを明らかにしました。
- トランスフォーミング増殖因子β(TGF-β)*2により腫瘍血管内皮細胞(TEC)*3からCAFが形成されるのを線維芽細胞増殖因子2(FGF2)*4が阻害することで、腫瘍形成が抑制されました。
- がん微小環境構成因子である腫瘍血管内皮細胞由来のCAFを標的とした新規治療法開発への応用が期待できます。
東京医科歯科大学 大学院医歯学総合研究科 硬組織病態生化学分野の渡部 徹郎教授と吉松 康裕講師(現 新潟大学)の研究グループは、東京大学大学院医学系研究科 分子病理学分野の宮園 浩平教授と赤津 裕一氏(現 日本化薬株式会社)、北海道大学 大学院歯学研究院 口腔病態学分野の樋田 京子教授、東京医科歯科大学 難治疾患研究所 分子細胞遺伝分野の稲澤 譲治教授と村松 智輝助教の共同研究で、TGF-βにより腫瘍血管内皮細胞から形成されるがん関連線維芽細胞(CAF)が腫瘍形成を促進する作用を、FGF2が抑制することをつきとめました。この研究は国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)「口腔がんの悪性化機構の解明とそのメカニズムに基づく新規治療標的探索研究」(研究開発代表者:渡部徹郎)、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業(さきがけ)「生体における動的恒常性維持・変容機構の解明と制御」(研究代表者:渡部徹郎)、文部科学省科学研究費補助金、上原記念生命科学財団等の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Molecular Oncologyに、2019年6月19日(米国東部時間)にオンライン版で発表されました。
研究の背景
腫瘍組織には、がん細胞のみならず腫瘍血管やがん関連線維芽細胞(CAF)*1など様々な種類の細胞が存在し、がん微小環境が構成されています。CAFにはがんを悪性化させる筋線維芽細胞*5(悪玉CAF)と非筋線維芽細胞に分類され、後者はがん進展を抑制する活性化線維芽細胞(善玉CAF)が存在することがわかっています(概念図)。
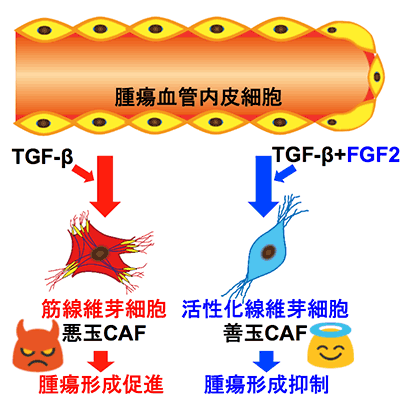
概念図:TGF-βにより腫瘍血管内皮細胞から形成される筋線維芽細胞は悪玉CAF(がん関連線維芽細胞)としてがん細胞に働きかけ腫瘍形成を促進する。一方TGF-βとFGF2により形成される善玉CAFには腫瘍形成を抑制する作用があることを見出した。
研究者グループはこれまで、トランスフォーミング増殖因子β(TGF-β)が血管内皮細胞からCAFの形成を誘導することを報告してきましたが、どのようなCAF(悪玉か善玉)が形成されるかについてはよくわかっていませんでした。また近年の報告から、線維芽細胞増殖因子2 (FGF2)がTGF-βによって誘導される内皮細胞からCAFへの分化転換を調節することがわかっていましたが、これら2つの因子によるシグナルがどのように相互作用しているかについては未解明な部分が多く残されていました。
研究成果の概要
研究者グループはTECを用いてTGF-βによりCAFへと分化転換する過程におけるFGF2の役割について解析を行いました。その結果、TECはTGF-β存在下で培養すると内皮細胞の性質を失い、その一部は筋線維芽細胞へと分化転換しますが、FGF2を添加するとTGF-βによる筋線維芽細胞の形成は抑制されました(図1)。
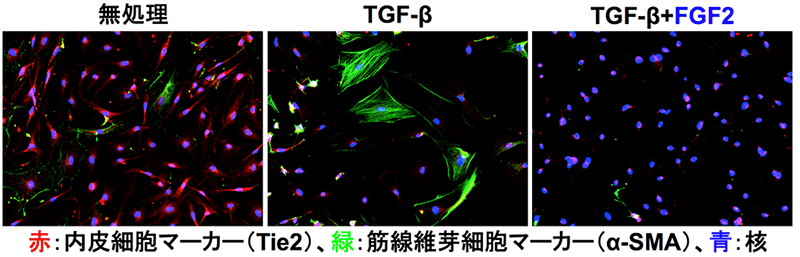
図1:腫瘍血管内皮細胞におけるTie2(赤色)の発現(左)はTGF-βにより消失し、一部の細胞は筋線維芽細胞(α-SMA:緑色)へと分化転換する(中)。FGF2を添加することでα-SMA陽性の細胞の形成は完全に抑制された(右)。
FGF2の作用により、TECからTGF-βにより形成されるCAFは悪玉CAFの特徴である収縮性の性質を持つ細胞から、善玉CAFの特徴である運動性と増殖性が高いものに変化することが明らかになりました。さらに、こうした培養細胞を用いた結果を個体レベルで検証するために、TGF-β存在下で培養したTECまたはTGF-βとFGF2存在下で培養したTECを悪性黒色腫(メラノーマ)細胞と混合して免疫不全マウスの皮下に移植して腫瘍形成に与える効果を検討しました。その結果、TGF-βによりTECから形成された悪玉CAFの腫瘍形成作用は、FGF2の添加により抑制されることが示されました(図2)。
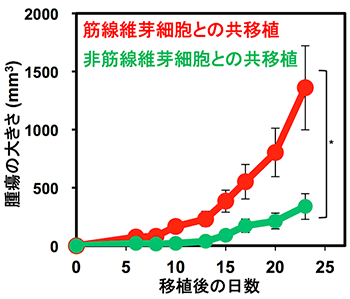
図2:悪性黒色腫細胞をTEC由来の筋線維芽細胞または非筋線維芽細胞と共移植した結果、筋線維芽細胞の方が腫瘍形成能が高いことが示された。
こうしたFGF2の作用のメカニズムをさらに検討するために、研究者グループはTGF-βとFGF2存在下で培養したTECの遺伝子発現を解析し、悪玉CAFに特徴的な様々なマーカーのTGF-βによる発現上昇がFGF2により低下し、善玉CAFに発現している様々な成長因子の発現がFGF2により上昇することが示されました。TGF-βはMRTF-A転写因子*6の発現を上昇させることで悪玉CAFのマーカー(α-SMA)の発現を誘導しますが、FGF2により活性化されるElk1転写因子*7はMRTF-Aの作用を阻害することによってα-SMAの発現を低下させ、TGF-βによるTECからの悪玉CAFの形成を抑制することが明らかとなりました(図3)。
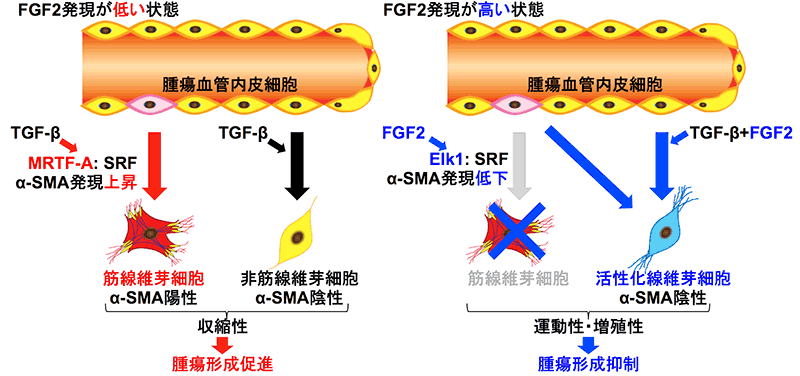
図3:本研究のまとめ
TGF-βにより発現が上昇するMRTF-A転写因子はSRFと結合してα-SMA発現を誘導することで筋線維芽細胞の形成を促進する。FGF2により活性化されたElk1転写因子はMRTF-Aと競合することでα-SMA発現を抑制し、活性化線維芽細胞の形成を誘導する。
研究成果の意義
近年、がん治療の標的として、がん悪性化を制御するCAFに注目が集まっています。CAFの起源としては腫瘍組織に存在する線維芽細胞が知られていますが、血管内皮細胞から形成されるCAFが、CAFにおける3割程度を占めるという報告もあり、TGF-βによるTECからCAFへの分化転換はがん治療の標的として注目を集めています。
本研究の成果により、TGF-βとFGF2がお互いに拮抗または協調することで、TECからの筋線維芽細胞(悪玉CAF)ならびに活性化線維芽細胞(善玉CAF)の形成を制御し、がん微小環境におけるCAFの形質を決定していることが示されました(概念図)。今後、腫瘍組織においてTGF-βシグナルを抑制し、FGF2シグナルを活性化することで、がん微小環境の性質を腫瘍形成を抑制する方向に制御し、がん細胞を標的とした抗がん剤との併用により、新たながん治療法の開発へ応用されることが期待されます。
用語の説明
- *1がん関連線維芽細胞(cancer-associated fibroblast:CAF):
- がん間質(がん細胞を支える組織)を構成する線維芽細胞(間質を構成する線維を産生する細胞)であり、がん細胞の増殖促進に働くさまざまな増殖因子を産生することが報告されている。
- *2トランスフォーミング増殖因子β(TGF-β):
- 線維芽細胞の分化を促進する因子として同定されたが、現在では多くの種類の細胞に対して増殖抑制作用を有することが明らかになっている。さらに、細胞の分化・運動などにも関与し、個体発生やがんの浸潤・転移など様々な病態生理学的現象において重要な役割を果たすことがわかっている。
- *3腫瘍血管内皮細胞(tumor endothelial cell:TEC):
- 腫瘍組織における血管は、がん細胞に酸素や栄養分を供給することでがん形成に必須の役割を果たす。腫瘍血管は正常血管と比較して未熟な構造を取っているが、その原因の一つが腫瘍血管内皮細胞の異常性にあることが明らかとなっている。
- *4線維芽細胞増殖因子2 (fibroblast growth factor 2:FGF2/basic FGF):
- 線維芽細胞を増殖させる作用を持つ構造が類似した25種類の因子の一つであり、胎生期の中胚葉形成や器管形成に重要な役割を果し、成体の創傷治癒・組織再生をはじめとした様々な過程に関与する。
- *5筋線維芽細胞(myofibroblast):
- 損傷組織の修復などのために組織の線維芽細胞が分化した細胞。細胞質内にアクチンフィラメントが増加しているα-smooth muscle actin(α-SMA)などを発現している。収縮性を有することから、創傷治癒の過程において肉芽組織を収縮させ、傷口を小さくする働きをする。がん微小環境に存在するα-SMAを発現している筋線維芽細胞は血管内皮増殖因子(VEGF)などを産生し、がんを悪性化させていることが報告されている。
- *6MRTF-A転写因子:
- MRTF-A(myocardin-related transcription factor A)はserum response factor(SRF)転写因子の共役転写因子としてα-SMA遺伝子のプロモーターに結合し、その発現を誘導する。TGF-βは血管内皮細胞においてMRTF-Aの発現ならびに核移行を誘導することで、線維芽細胞への分化転換を引き起こすことが報告されている。
- *7Elk1転写因子:
- Ets-like transcription factor (Elk1)はETSファミリーに属する転写因子である。α-SMA遺伝子のプロモーターに結合するが、その際にSRFのα-SMAプロモーターとの結合を拮抗阻害することでα-SMAの発現を抑制することが報告されている。
論文情報
- 掲載誌:
- Molecular Oncology
- 論文タイトル:
- Fibroblast growth factor signals regulate transforming growth factor-β-induced endothelial-to-myofibroblast transition of tumor endothelial cells via Elk1
研究者プロフィール
渡部 徹郎(ワタベ テツロウ)Watabe Tetsuro
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野 教授
- 研究領域
- がん生物学、血管生物学、生化学
お問い合わせ先
研究に関すること
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野
教授 渡部 徹郎(ワタベ テツロウ)
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
戦略推進部 がん研究課