体の器官の形づくりや傷の修復メカニズムの理解に貢献
2019-07-26 東北大学 大学院生命科学研究科,科学技術振興機構(JST)
ポイント
- オプティカルバイオロジーとライブイメージングの手法を用いて、ショウジョウバエにおいて、体の器官を形成する上皮細胞が集団移動するのに重要な、細胞のつなぎ替えを可視化することに成功した。
- 「ジッパー」のように機能して、上皮細胞の接着を破ることなく、細胞接着面の伸長を促進する膜たんぱく質(Sdk)を発見した。
- 上皮細胞の集団移動をスムーズに継続させる仕組みが明らかになり、組織形成や、創傷治癒などの上皮修復メカニズムの理解に貢献することが期待される。
東北大学 大学院生命科学研究科の上地 浩之 助教と倉永 英里奈 教授は、上皮細胞をスムーズに集団移動させる仕組みについて、ショウジョウバエを用いた研究により明らかにし、上皮細胞が集団移動するために重要な、細胞のつなぎ替え(細胞接着面のリモデリング)過程を可視化することに成功しました。リモデリング後にできた新しい細胞接着面の伸長を促進するためには、古い細胞接着面を収縮するために使われたアクトミオシン注1)が集積して再利用されることを発見しました。その集積には膜たんぱく質であるSdk(Sidekick)が必要であり、このSdkが「ジッパー」のように機能することで上皮に穴を空けることなく、新しい細胞間接着の伸長を促進していることが明らかになりました。
本研究の成果は、上皮組織の形態形成の原動力となる細胞機能の解明であり、創傷治癒などの上皮修復メカニズムの理解にも貢献することが期待されます。
本研究結果は、米科学誌「Developmental Cell」の電子版(2019年7月25日付)で発表された後、8月5日発行の同誌に掲載されます。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業(CREST)「光の特性を活用した生命機能の時空間制御技術の開発と応用」のほか、文部科学省 科学研究費補助金、公益財団法人などの研究助成金の支援を受けて行われました。
<研究内容>
私たちの体は、外界から身体の内部を隔てる上皮組織によって、身体の器官を保護したり、情報や物質を受け入れたりして、生命維持に必要な機能や反応を起こしています。上皮組織は上皮細胞と呼ばれる細胞が密接に接着した状態で構成されており、例えば胃粘膜の上皮組織では、胃の中に入ってきた食べ物などの物質のろ過や吸収、異物から保護するバリア機能を担っています。また、受精卵から体が形成される過程では、上皮組織内の上皮細胞が同一方向に集団移動することで、シート状の上皮組織を折りたたみ、伸長・陥入・移動などの変形を行い、複雑な器官を作り上げます。しかし細胞同士の接着を保ったまま、どのように上皮細胞が移動できるのか、どのように同一方向に協調的に動くのか、その仕組みの多くは謎のままでした。
本研究グループは、ショウジョウバエの雄の生殖器が、生殖器官を取り巻く上皮細胞の集団移動によって360度回転しながら形作られることを明らかにしていました。この過程では、上皮細胞をつなぐ接着部分でアクトミオシンが偏って集積することで、細胞同士のつなぎ替えが連続して起こり、上皮細胞が集団移動する原動力となっています(図1)。つなぎ替えの仕組みとして分かっていたことは、①隣り合う細胞の細胞接着面にアクトミオシンが集積すると、その細胞接着面は短縮し、②やがて消失して4つの細胞が1点で接する点を形成し、③さらに、この接合点から新たな細胞接着面が、元の接着面とは垂直方向に伸張する、ということでした(図2)。
今回、この細胞同士のつなぎ替えの過程をライブイメージング注2)により詳細に可視化したところ、①②の過程で細胞間接着を縮めて消失したはずのアクトミオシンは、消失することなく、③の新しい細胞接着面を作る際の接合点で再利用されていることを発見しました(図3)。また、③の細胞接着面が新たに伸長しているタイミングで、オプティカルバイオロジー注3)の1つの手法としてCALI法注3)を用い、細胞接合点にあるアクトミオシンだけを不活性化したところ、新しい細胞接着面の伸長が遅延することが明らかになりました。このことは、再利用されたアクトミオシンが新たな細胞接着面の形成に必要であることを示しています。
さらに本研究グループは、3細胞接合点にアクトミオシンが集積するためには、Sdk(Sidekick)と呼ばれる膜たんぱく質が必要であることを世界に先駆けて見いだしました。このSdkは、細胞接着に働くたんぱく質(カドヘリン注4))と比較して接着は弱いものの、細胞接着面のつなぎ替え後に形成される細胞接合点にカドヘリンよりも早く集積してアクトミオシンをつなぎ止め、まるで「ジッパー」のように細胞接合点をスムーズに移動することで、新しい細胞接着面の伸長を誘導していることが明らかになりました(図4)。
このように、細胞のつなぎ替えを維持するためには、細胞接着面がつなぎ替わった後に新しい細胞接着面の伸長が連続して起こることが分かりました。その結果、上皮細胞が集団移動することが可能となり、上皮組織が複雑な形の器官を作り上げる原動力となっていると考えられます。
<今後の展開>
今回発見した細胞のつなぎ替えを連続してスムーズに起こす仕組みは、上皮組織の形態形成や、創傷治癒などの上皮修復メカニズムの理解に貢献することが期待されます。また、本研究では光を用いて人工的にアクトミオシンの操作を行うことによって、瞬間的に方向性をもった細胞の力発生メカニズムを解明することが可能になりました。本研究が1つのきっかけとなって、オプティカルメカノバイオロジーの利点を生かした次世代の生物学研究が増えることが期待されます。
<参考図>
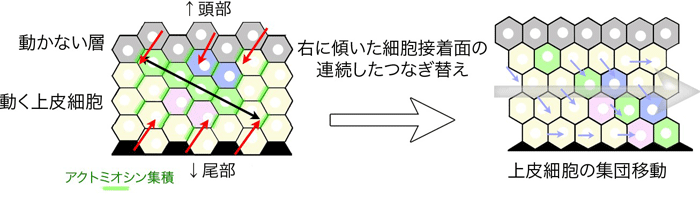
図1 右に傾いた細胞接着面のつなぎ替えが連続して起こることで、細胞を同一方向に
集団移動させるメカニズムの模式図(Sato et al., Nat Comm 2015より図を改変)
-
- (左)アクトミオシンが集積した細胞接着面が赤矢印方向につなぎ替わることで、黒矢印方向に組織が伸長しようとすると圧力が加わる。
- (右)頭部に動かない細胞層を配置することで、水色矢印のような細胞のつなぎ替えが起こり、片側への細胞移動が誘導される(灰色矢印)。
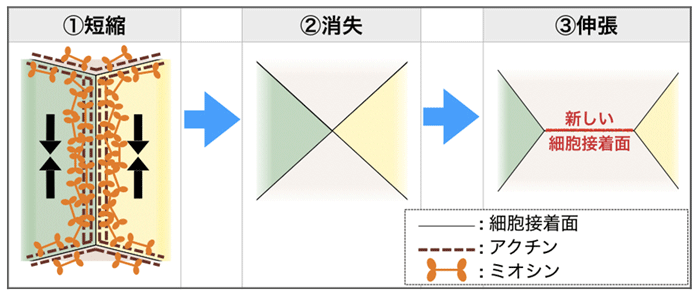
図2 細胞接着面のつなぎ替え(模式図)
① 隣り合う細胞の細胞接着面にアクトミオシンが集積すると、その細胞接着面は短縮し、② やがて消失して4つの細胞が1点で接する点を形成し、③ さらに、この接合点から新たな細胞接着面が、元の接着面とは垂直方向に伸張する。
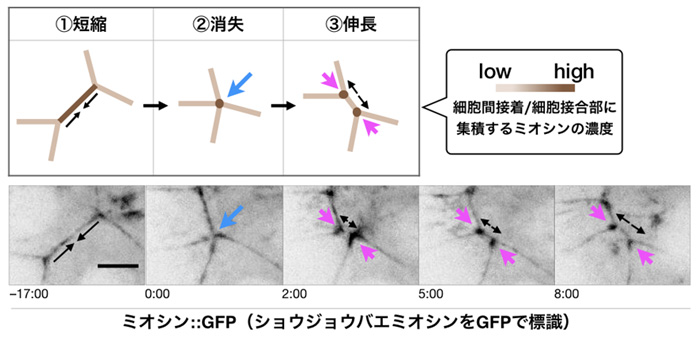
図3 実際に得られたライブイメージング動画(下)に基づいた、細胞接着面のつなぎ替えの模式図(上)
-
- ① ミオシン(茶色)の濃度が高い細胞間接着が短縮する。
- ② 細胞間接着が消失し、4細胞接合点にミオシンが集積している(青色矢印)。
- ③ 新しい細胞間接着が伸長する。伸長する両端3細胞接合点にミオシンが集積している(紫色矢印)。
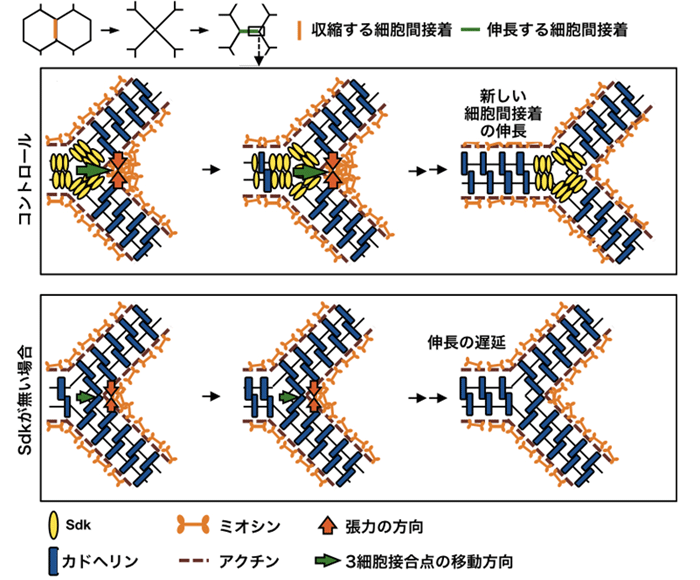
図4 Sdkによって新しい細胞間接着がスムーズに伸長する仕組み
収縮に使われたアクトミオシンは、3細胞接合点に入り込んだSdkによってつなぎ止められる。Sdkは弱い結合力を利用して「ジッパー」のように3細胞接合点を移動させて、新しい細胞間接着を伸長させていく(上:コントロール)。Sdkが無い場合(下:Sdkの変異体およびSdkノックダウン)、3細胞接合点にカドヘリンが入り込んで強く接着するため、3細胞結合点の移動が遅れてアクトミオシンが分離してしまい、新しい細胞間接着の伸長が阻害される。
<用語解説>
- 注1)アクトミオシン
- アクチン繊維にミオシンたんぱく質が結合した複合体。筋肉や細胞骨格の収縮に必須。
- 注2)ライブイメージング
- 生きた細胞のさまざまな活動を継時観察すること。特にGFPなどの蛍光マーカーを用いて特定の細胞や組織を標識し、蛍光顕微鏡でその動きや変化を詳細に観察することができる。今回は生きた個体において生きた細胞を観察した。
- 注3)オプティカルバイオロジー
- 特定の波長の光を当てることで特定のたんぱく質の活性を変化させ、狙った細胞の機能を光で制御する方法。本研究では、その手法の1つであるCALI法(Chromophore-assisted laser inactivation)を用いた。CALI法では、光刺激によりReactive oxygen species(ROS)を産生する蛍光たんぱく質を、不活性化させたいたんぱく質Xに融合させて発現させることで、光特異的にたんぱく質Xを不活性化させる。
- 注4)カドヘリン
- 動物の細胞同士の接着に必要な細胞膜たんぱく質。細胞境界面で、カルシウム依存的に同じ分子同士が結合して細胞を接着させる。
<論文タイトル>
- “The tricellular junction protein Sidekick regulates vertex dynamics to promote bicellular junction extension”
- 著者名:Hiroyuki Uechi, Erina Kuranaga
- DOI:10.1016/j.devcel.2019.06.017
<お問い合わせ先>
<研究に関すること>
倉永 英里奈(クラナガ エリナ)
東北大学 大学院生命科学研究科 教授
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
<報道担当>
高橋 さやか(タカハシ サヤカ)
東北大学 大学院生命科学研究科 広報室
科学技術振興機構 広報課