2019-07-26 富士通エフ・アイ・ピー株式会社
製薬業界トップシェアを誇る「パーシヴ」シリーズのノウハウを生かした新サービス、 医療機関からの安全性情報収集の大幅な効率化
富士通エフ・アイ・ピー株式会社(注1)(以下 富士通エフ・アイ・ピー)は製薬企業に向けて、医薬品の副作用や感染症などの情報(安全性情報)を収集するSaaS型の新たなソリューション「FUJITSU ライフサイエンスソリューション tsClinical Colle-Spo(ティーエスクリニカル コレスポ)」(以下 「Colle-Spo」)を2019年7月から提供開始します。
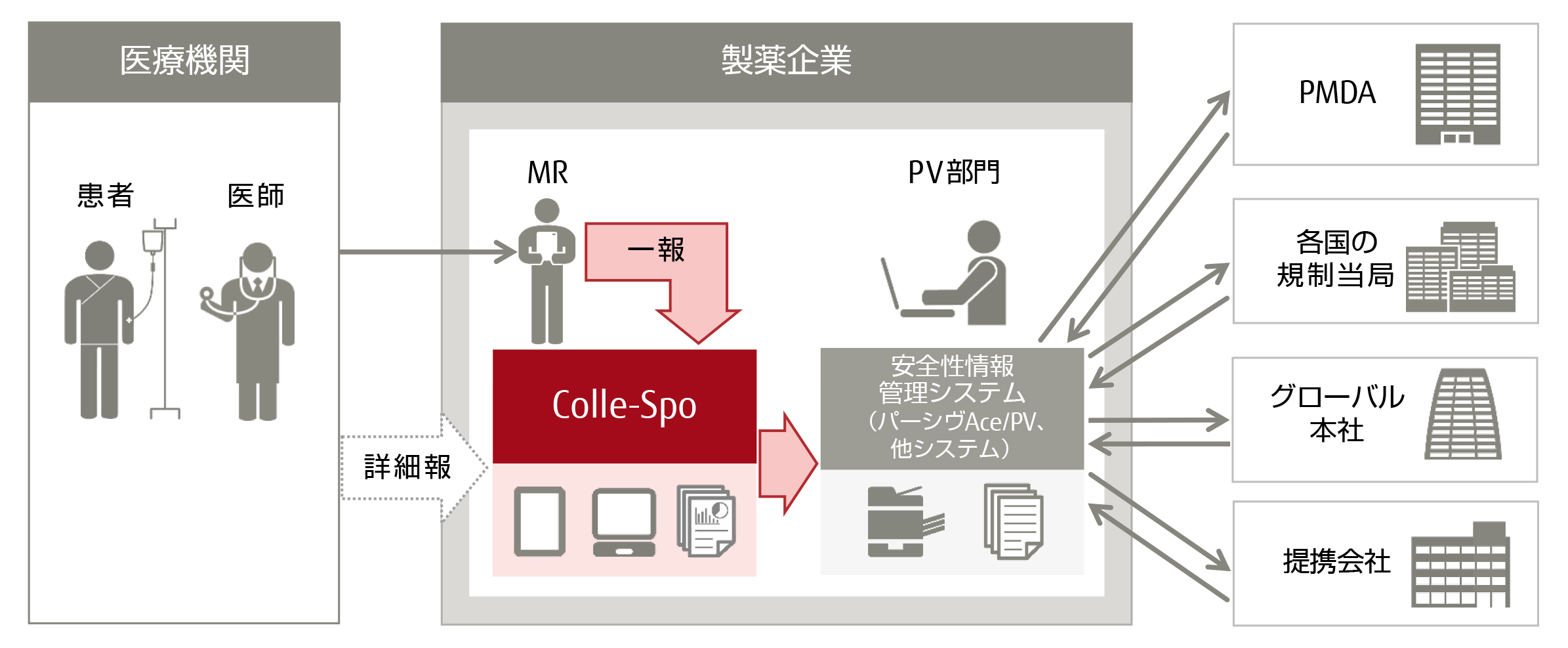
「Colle-Spo」は、安全性情報に関わる医師へのヒアリング、紙の連絡票の記入・収集など、製薬企業が行う一連の安全性情報収集業務を電子化するサービスです。パソコンやタブレット端末からインターネット経由で直接データを入力できるため、記入や送付作業の効率化が図れます。また、データはクラウド上で一元管理されるため、進捗状況の確認や期限の管理も可能です。さらに、当社の「FUJITSU ライフサイエンスソリューション tsClinical パーシヴAce/PV(ティーエスクリニカル パーシヴエース/ピーヴイ)」(以下 「パーシヴAce/PV」)をはじめとする安全性情報管理システムと、業界標準の連携フォーマットであるICSR(注2)(E2B(R3) (注3)形式)での連携が可能なため、紙の連絡票を基にしたシステム入力作業が不要となり、大幅な業務効率化につながります。
当社は今後も、医薬品や医療機器の安全性情報管理業務を支援するソリューションの提供を通じ、安心・安全な医療の実現に貢献してまいります。
背景
昨今の医薬品の技術革新は目覚ましく、バイオ医薬品が台頭し、患者の体質や病気の特徴にあった治療を行う個別化医療が伸長しています。さらに、国民の医薬品の安全性への意識の高まりも相まって、安全性情報の報告件数は年々増加しています。安心・安全な医療の実現のために安全性情報の重要性はますます高まっており、同時に安全性情報収集の確実性と効率化が求められています。
製薬企業は、医師などの医療関係者から安全性情報を入手した際、その情報を収集・評価し、独立行政法人医薬品医療機器総合機構(PMDA)へ報告することが薬機法(注4)によって義務づけられています。この情報収集には、医療機関から連絡を受け、製薬企業の医薬情報担当者(MR)が医師にヒアリングを行い、連絡票を記入する”一報”と、一報収集後、詳細な調査が必要だと判断された場合に、MRが持参した詳細調査票を医師に直接記入してもらう”詳細報”があります。
従来、一報の収集は、MRが紙の連絡票を記入し、製薬企業の安全性情報を管理するファーマコビジランス部門(PV部門)にFAXで送付しており、記入やFAXの手間に加え、FAX送付時の連絡票の置き忘れなどのリスクがありました。また、PV部門では、連絡票を安全性情報管理システムに手入力で取り込む作業負荷や、再調査収集などの対応の遅れや漏れが課題となっていました。
当社は、1995年に製薬企業に対して医薬品の安全性情報管理システム「パーシヴ」シリーズを発売し、累計80社以上の製薬企業に利用されています。また、2002年には製造販売後調査を支援するEDC(注5)サービス「FUJITSU ライフサイエンスソリューション tsClinical PostMaNet(ポストマネット)」(以下 「PostMaNet」)を、2006年には製造販売後調査の進捗管理システム「FUJITSU ライフサイエンスソリューション tsClinical PostMaWatch(ポストマウォッチ)」を発売し、製薬協会員70社のうち60%以上の企業、約360調査に利用されています。業界トップシェアのサービスの提供を通じ、製薬企業の製造販売後調査や安全性情報管理の各業務を支援してきました。
今回発表する「Colle-Spo」は、これまで当社が「パーシヴ」シリーズで培ってきた安全性情報管理業務の知見と、「PostMaNet」で培ったEDCのノウハウを生かして提供を開始する、安全性情報収集業務を支援するための新たなサービスです。まず、一報の収集業務に必要な機能の提供を開始し、今後詳細報の収集業務に必要な機能も順次リリースしていく予定です。
特長
- Webでの情報入力
MRによる一報の収集業務を電子化します。Web経由の入力が可能で、タブレット端末(iPad、Windowsタブレット)にも対応しているため、時間や場所を問わず情報の送信が可能となります。このため、従来紙で安全性情報の収集・提供を行っていたMRの作業負荷が軽減されます。さらに、臨床検査値データや画像ファイルなどを電子ファイルのまま添付することが可能です。 - 情報の一元管理
入力したデータを原本として、クラウド上に一元管理しますので、紙運用により発生する可能性がある紛失などのリスクを軽減します。また、情報収集の進捗を管理する各種機能により進捗状況の確認や期限の管理が可能となり、対応漏れや対応遅れを防止します。さらに、操作履歴や更新履歴などを正確に記録しますので、各種の監査への対応にも有効です。 - 安全性情報管理システムとの連携
入力した症例情報はE2B(R3)形式のICSRファイルでダウンロードすることが可能なため、ダウンロードデータをパーシヴAce/PVの他、各社の安全性情報管理システムに取り込んでデータ連携を行うことが可能です。このため、従来紙の連絡票を基に一報を手入力でシステムに取り込んでいたPV部門の大幅な業務効率化につながります。 - 機密性を保持した安心・安全な環境
機密性の保持が不可欠な安全性情報を取り扱うサービスであるため、ISO/IEC27001(注6)やISO22301(注7)などの各種国際認証を満たした富士通のデータセンターで運用されています。高度なセキュリティ対策と事業継続対策により、安心・安全なデータ保管と業務継続性を実現します。
「Colle-Spo」サービスイメージ
商標について
記載されている製品名などの固有名詞は、各社の商標または登録商標です。
注釈
- 注1 富士通エフ・アイ・ピー株式会社:
- 本社:東京都港区、代表取締役社長:島津 めぐみ
- 注2 ICSR:
- Individual Case Safety Report(個別症例安全性報告)の略。ICH(日米欧での標準化団体)で規定された、医療現場で生じた薬物によると疑われる有害事象の標準的報告仕様。
- 注3 E2B(R3):
- 個別症例安全性報告を電子的に伝送するためのデータ項目。
- 注4 薬機法:
- 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和35年法律第145号)。
- 注5 EDC:
- Electronic Data Captureの略。臨床検査値などの臨床データを、インターネットを介して医療機関から電子的に収集し管理すること。
- 注6 ISO/IEC27001:
- ISO(国際標準化機構)が定めた、組織における情報セキュリティマネジメントシステムに関する国際規格。情報の機密性(C:Confidentiality)・完全性(I:Integrity)・可用性(A:Availability)の3つをバランスよくマネジメントし、情報の有効活用を実現するためのツールです。ISMSの後継認証制度として、2005年に発行されました。
- 注7 ISO22301:
- 2012年5月15日に発行された事業継続マネジメントシステム(BCMS)の国際規格で、マネジメントシステムの要求事項を規定したもの。
本件に関するお客さまのお問い合わせ先
富士通エフ・アイ・ピー株式会社 パブリックサービス推進部