2022-03-25 理化学研究所
理化学研究所(理研)生命医科学研究センターヒト免疫遺伝研究チームの石垣和慶チームリーダーらの国際共同研究チームは、自己免疫疾患[1]の最大のリスク因子であるヒト白血球型抗原(HLA)[2]の遺伝子の多型[3]が自己反応性T細胞[4]を増やし、疾患発症に関与することを発見しました。
本研究成果は、自己免疫疾患の病態解明やバイオマーカーの開発に役立つだけでなく、新しい治療方法の開発に貢献すると期待できます。
近年、T細胞受容体のアミノ酸配列データは蓄積しつつありますが、その解析手法はまだ確立していません。
今回、国際共同研究チームは、健常人約800人から収集したT細胞受容体[5]配列のビックデータを解析し、HLA遺伝子の多型とT細胞受容体の配列の関連を詳しく評価しました。独自の解析アルゴリズムを考案し、自己免疫疾患の最大のリスク因子であるHLA遺伝子の多型が特定のT細胞受容体の配列パターンに影響することを発見しました。さらに、その配列パターンは自己免疫反応を促進する可能性があることを確認しました。
本研究は、科学雑誌『Nature Genetics』オンライン版(3月24日付:日本時間3月25日)に掲載されました。
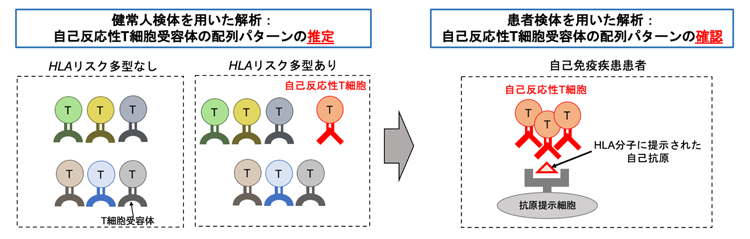
HLA遺伝子のリスク多型はT細胞受容体に影響して、自己免疫反応を促進する
背景
「自己免疫疾患」は、免疫システムが自己の組織を障害する疾患群です。その詳細な原因は不明ですが、免疫システムによる自己・非自己の識別異常が発症に関わると考えられています。この識別で重要な役割を担うのが、免疫細胞の一つであるT細胞[4]の表面に存在するT細胞受容体です。T細胞はヒト白血球型抗原(HLA)に提示された抗原[6]をT細胞受容体によって認識します。それぞれのT細胞は固有のT細胞受容体を持ち、異なる抗原を認識します。特に、T細胞受容体の中央にある相補性決定領域3(CDR3)[7]は抗原に直接結合するため、その配列は抗原の認識に重要です。実際に、特定の抗原に反応するT細胞受容体のCDR3には固有のアミノ酸の配列パターンがあることが知られています。
近年の大規模ゲノム解析によって、自己免疫疾患の発症リスクに最も強い影響を与える多型はHLA遺伝子領域に存在することが明らかになっています。特に、HLA-DRB1遺伝子の13番目のアミノ酸多型が関節リウマチ[1]などの複数の自己免疫疾患のリスクに強く影響することが報告されています。しかし、HLA遺伝子のリスク多型(HLAリスク多型)がどのように免疫システムに影響を与え、自己・非自己の識別異常に関与しているかは解明されていません。
T細胞は胸腺[8]で分化します。その際、未分化なT細胞はそのT細胞受容体がHLAに提示された自己抗原に微弱な親和性を示すときだけ生き残って成熟します(正の選択)。逆に、強い親和性を示すときは死滅します(負の選択)。このような胸腺でのT細胞の選択の過程で、生き残るT細胞の受容体におけるアミノ酸配列パターンにHLA遺伝子の多型が影響すると考えられます。
研究手法と成果
国際共同研究チームは、「HLAリスク多型は胸腺のT細胞選択に影響して自己反応性T細胞(自己組織を認識するT細胞受容体を持つT細胞集団)を増やし、自己免疫疾患の発症リスクを高める」という仮説を立てました。この仮説を証明するには、(1)健常人において、HLAリスク多型が特定の配列パターンを持つT細胞受容体の発現頻度に影響すること、(2)自己免疫疾患患者において、そのT細胞受容体の配列パターンが特定の自己抗原に対する免疫反応を促進していること、の二つを確認する必要があります。
まず、健常人約800人から収集したT細胞受容体配列のビックデータを用いて、HLA遺伝子の多型とT細胞受容体の配列の関連解析を試みました。近年、T細胞受容体の配列データは蓄積しつつありますが、その解析手法はまだ確立していません。そこで、T細胞受容体の配列データを量的なデータとして扱い、HLA遺伝子の多型との関連を網羅的に評価する新しい解析アルゴリズムを考案しました。この解析で、全てのHLA遺伝子の多型の中で最も強い「効果サイズ[9]」が観測されたのは、HLA-DRB1遺伝子の13番目のアミノ酸多型でした(図1)。これは、HLA遺伝子の同一部位のアミノ酸多型が、自己免疫疾患の発症リスクとT細胞受容体の配列パターンの両方に強い影響を与えることを示す重要な知見です。
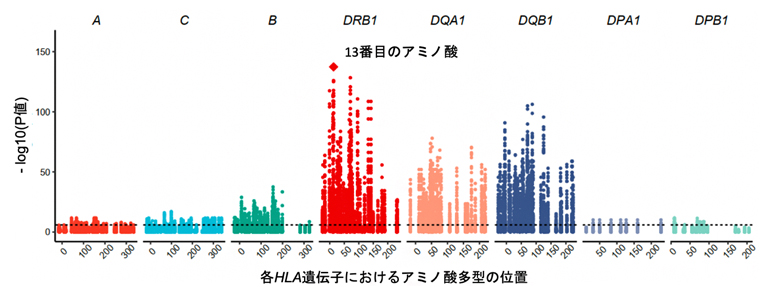
図1 HLA遺伝子の多型とT細胞受容体の配列パターンの関連解析
HLA-A、HLA-C、HLA-B、HLA-DRB1、HLA-DQA1、HLA-DQB1、HLA-DPA1、HLA-DPB1のアミノ酸多型の位置と、それぞれのアミノ酸多型のT細胞受容体配列パターンに対する関連の強さ(-log10(P値))を図示した。HLA-DRB1遺伝子の13番目のアミノ酸多型(赤菱形)がT細胞受容体の配列パターンに最も強い影響を与える。
次に、HLA-DRB1遺伝子の13番目のアミノ酸多型のT細胞受容体の配列パターンに対する影響を、詳細に評価しました。このアミノ酸多型には6個のアミノ酸が存在します。これらのアミノ酸の関節リウマチの発症リスクに対する効果サイズと、T細胞受容体のCDR3中央のアスパラギン酸(酸性アミノ酸[10])の割合に対する効果サイズには、強い正の相関がありました(図2左)。一方、CDR3中央のリジン(塩基性アミノ酸[10])の割合に対しては、強い負の相関がありました(図2右)。アスパラギン酸は陰性に、リジンは陽性に荷電しているため、関節リウマチのHLAリスク多型は、T細胞受容体のCDR3の中央のアミノ酸の陰性荷電を促進することが分かりました。
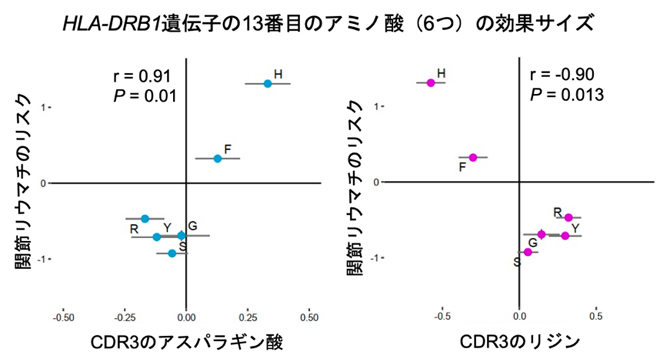
図2 HLA-DRB1遺伝子の13番目のアミノ酸多型の効果サイズ
HLA-DRB1遺伝子の13番目のアミノ酸多型には6個のアミノ酸が存在する。これらのアミノ酸が関節リウマチの発症リスクに与える効果サイズ(Y軸)と、T細胞受容体のCDR3中央のアスパラギン酸(陰性荷電)およびリジン(陽性荷電)の割合に与える効果サイズ(X軸)を示した。rは両者の相関の強さを示す相関係数。この結果から、関節リウマチのHLAリスク多型はCDR3のアミノ酸の陰性荷電を促進することが分かった。
通常、HLA遺伝子領域の複数の多型が自己免疫疾患のリスクに影響します。そこで、HLAリスク多型を個別に評価するのではなく、複数のリスク多型のT細胞受容体の配列パターンに対する影響を網羅的に評価する解析を試みました。この解析によって、HLAリスク多型の影響の総和には、疾患ごとに異なるパターンがあることが分かりました(図3)。例えば、関節リウマチと1型糖尿病[1]のHLAリスク多型はCDR3のグルタミン酸(E)やアスパラギン酸(D)などの酸性アミノ酸(陰性荷電)を増やし、セリアック病[1]のHLAリスク多型はトリプトファン(W)やプロリン(P)などの疎水性アミノ酸[10]を増やします。ここまでの解析によって、健常人において、HLAリスク多型は特定の配列パターンを持つT細胞受容体の発現頻度に影響を与えること(仮説(1))が確認されました。
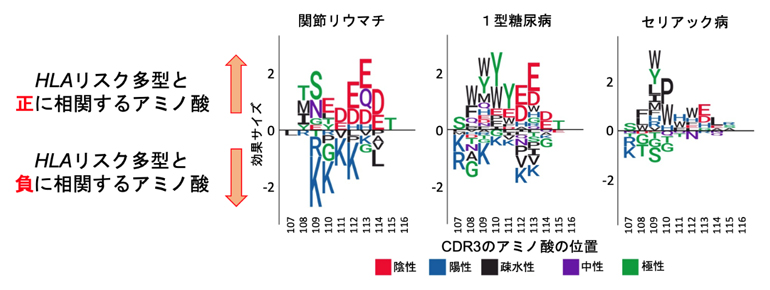
図3 自己免疫疾患のHLA遺伝子リスク多型がCDR3のアミノ酸組成に及ぼす影響
T細胞受容体のCDR3の各位置のアミノ酸に対するHLAリスク多型の効果サイズの総和を示した。図内のアルファベットはアミノ酸の略号(E:グルタミン酸、K:リジン、など)で、赤は陰性荷電のアミノ酸(酸性アミノ酸)、青は陽性荷電のアミノ酸(塩基性アミノ酸)を示す。アルファベットの大きさは効果サイズの大きさを示す。
最後に、このようなT細胞受容体の配列パターンが自己抗原[6]に対する免疫反応に関与するかを確認しました。まず、これらのT細胞受容体配列パターンがそれぞれのT細胞受容体配列にどの程度集積しているか示す指標として「CDR3リスクスコア」を作成しました(図4上)。
関節リウマチの特徴的な病態の一つが、シトルリン化[11]された自己抗原に対する自己免疫反応です。そこで、関節リウマチ患者の滑膜に浸潤する細胞を収集し、さまざまなシトルリン化自己抗原に反応するT細胞を抽出し、CDR3リスクスコアを計算しました。すると、シトルリン化自己抗原に反応するT細胞受容体は、その他のT細胞受容体に比べて、CDR3リスクスコアが高いことが確認されました(図4下)。つまり、HLAリスク多型によって増えたT細胞受容体の配列パターンが、自己抗原に対する免疫反応を促進していること(仮説(2))が確認されました。
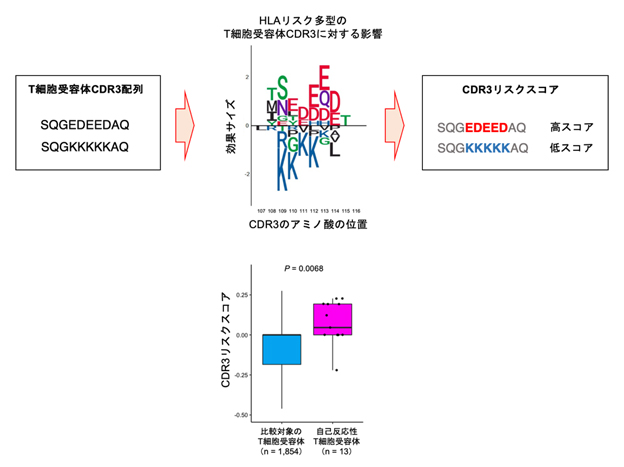
図4 CDR3リスクスコアの計算手順と自己反応性T細胞の結果
上:T細胞受容体のCDR3配列を基にCDR3リスクスコアを計算する手順。HLAリスク多型によって影響を受けるアミノ酸がCDR3配列に含まれる場合、その効果サイズの和がCDR3リスクスコアである。
下:シトルリン化自己抗原に反応するT細胞受容体は、その他のT細胞受容体に比べてCDR3リスクスコアが高い。
※本研究で開発されたCDR3リスクスコアの計算アルゴリズムは、国際共同研究チームのウェブサイト(GitHub – immunogenomics/cdr3-QTL: Trans-association between HLA and TCR-CDR3)で公開されています。
今後の期待
免疫システムによる自己・非自己抗原の識別異常が、自己免疫疾患の本質的な病態です。しかし、自己免疫疾患の既存の治療薬のほとんどは、抗原非特異的に免疫を調整・抑制する薬剤です。本研究で得られた知見によって、抗原特異的な治療方法の開発が進むことが期待できます。
補足説明
1.自己免疫疾患、関節リウマチ、1型糖尿病、セリアック病
自己免疫疾患は免疫システムに異常が生じ、自己の正常な組織に障害を与える疾患の総称。関節リウマチは代表的な自己免疫疾患の一つで、免疫システムが関節組織を障害する。1型糖尿病とセリアック病も自己免疫疾患であり、1型糖尿病では免疫システムが膵臓のインスリン分泌細胞を障害するのに対し、セリアック病では小麦などに含まれるグルテンにより惹起された免疫反応が小腸などを障害する。
2.ヒト白血球型抗原(HLA)
白血球の表面に発現する分子で、白血球の血液型を規定する。HLAの表面に提示された抗原はT細胞受容体によって認識される。
3.多型
ヒトゲノムを構成している塩基配列の個体差のこと。
4.自己反応性T細胞、T細胞
T細胞は白血球の中に含まれるリンパ球の一種で、胸腺で分化する。細胞表面にCD4タンパク質を発現するヘルパーT細胞と、CD8タンパク質を発現する細胞傷害性T細胞がある。ヘルパーT細胞は抗原刺激に応答して、他の免疫細胞の働きを調節する免疫システムの司令塔の役割を担う。自己反応性T細胞は自己組織を認識するT細胞受容体を持つT細胞集団であり、自己免疫疾患の発症に関与すると考えられている。
5.T細胞受容体
T細胞の表面に存在する、抗原を認識する分子。T細胞が胸腺で分化する際、V遺伝子、D遺伝子、J遺伝子がランダムに組み換えを起こすことで、各T細胞に固有のT細胞受容体が生成される。
6.抗原、自己抗原
抗原とは生体に免疫応答を引き起こす物質の総称。病原性のウイルスや細菌などの外来性抗原と、体内の組織に由来する自己抗原がある。
7.相補性決定領域3(CDR3)
T細胞受容体の中で、抗原認識に重要な部位が相補性決定領域(CDR)である。特にCDR3は抗原を直接認識する部位であるため、抗原認識に最も重要である。CDR3は、T細胞受容体のV遺伝子、D遺伝子、J遺伝子のランダムな組み換えの接合部にあるため、その配列パターンは多様性に富む。CDR3はComplementarity-Determining Region 3の略。
8.胸腺
胸部の中央の前側に位置する臓器。T細胞の分化・成熟などの免疫系に関与する一次リンパ器官。
9.効果サイズ
ある現象に対する効果の大きさを表す統計学の指標。
10.酸性アミノ酸、塩基性アミノ酸、疎水性アミノ酸
アミノ酸はタンパク質の構成要素であり、側鎖の性質によって酸性・塩基性・疎水性などに分類される。酸性アミノ酸は陰性、塩基性アミノ酸は陽性にそれぞれ荷電している。疎水性アミノ酸は荷電していない。
11.シトルリン化
翻訳後修飾の一種。タンパク質中のアルギニンが、シトルリンというアミノ酸に変換されることを指す。
国際共同研究チーム
理化学研究所 生命医科学研究センター ヒト免疫遺伝研究チーム
チームリーダー 石垣 和慶(いしがき かずよし)
ハーバード大学 ブリガム アンド ウィメンズ病院 データ科学センター
教授 ショウモウ・レイチャウドリ(Soumya Raychaudhuri)
博士課程大学院生 ケイトリン・ラグツッタ(Kaitlyn A. Lagattuta)
原論文情報
Kazuyoshi Ishigaki, Kaitlyn Lagattuta, Yang Luo, Eddie James, Jane H. Buckner and Soumya Raychaudhuri, “HLA autoimmune risk alleles restrict the hypervariable region of T cell receptors”, Nature Genetics, 10.1038/s41588-022-01032-z
発表者
理化学研究所
生命医科学研究センター ヒト免疫遺伝研究チーム
チームリーダー 石垣 和慶(いしがき かずよし)
報道担当
理化学研究所 広報室 報道担当