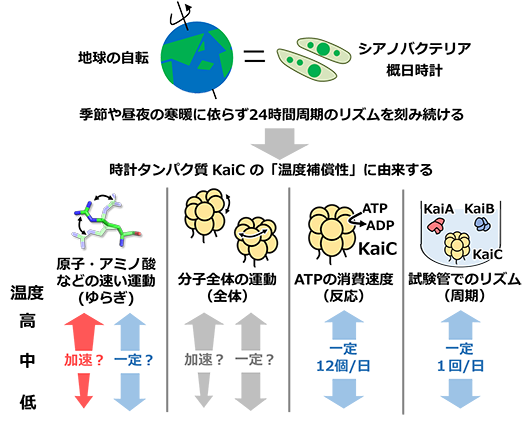
難治がんの新規治療法への応用を期待
2022-04-13 名古屋大学,日本医療研究開発機構
名古屋大学医学部附属病院消化器内科・病院助教 飯田忠、同・病院助教 水谷泰之、名古屋大学大学院医学系研究科消化器内科学・教授 川嶋啓揮、同腫瘍病理学・教授 榎本篤、藤田医科大学国際再生医療センターの高橋雅英センター長、藤田医科大学消化器内科学教授 廣岡芳樹、および東京大学消化器内科学教授 藤城光弘の共同研究グループは、名古屋大学医学部附属病院先端医療開発部の支援のもと、膵がんの間質(かんしつ)で増える線維芽細胞(せんいがさいぼう)の性質を遺伝子操作あるいは化合物によって変化させると、抗がん剤の効果が増強することを、膵がんマウスモデルを用いて明らかにしました。線維芽細胞の性質を人為的に改変する技術がヒトのがんにも応用できる可能性を示しています。
本研究成果は、2022年4月13日(英国時間)に国際科学雑誌「Oncogene」のオンライン版で掲載されました。
なお、この研究は日本医療研究開発機構(AMED)革新的先端研究開発支援事業ユニットタイプ『メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出』研究開発領域における研究開発課題「がん―間質におけるメカノバイオロジー機構の解明」(研究開発代表者:芳賀永)、次世代がん医療創生研究事業(P-CREATE)における研究開発課題「がん関連線維芽細胞の多様性の機序解明とその改変にもとづく腫瘍免疫制御法の開発」(研究開発代表者:榎本篤)および「膵がんのがん関連線維芽細胞多様性の理解に基づく間質標的治療法の開発」(研究開発代表者:水谷泰之)の支援のもと行われたものです。
ポイント
- 膵がん等の難治がんでは、その間質(がん細胞を取り囲むがん細胞以外の領域)にがん関連線維芽細胞(CAF:cancer-associated fibroblast)(※1)が増えることがわかっています。CAFにはがん促進性の細胞(がんの味方)とがん抑制性の細胞(がんの敵)の両者が存在する可能性が報告されています。
- 本研究チームは以前にがん抑制性CAFの特異的機能マーカーとしてMeflin(メフリン)(※2)分子を同定しました。
- 今回、Meflin遺伝子の発現を増強し、がん促進性CAFをがん抑制性CAFに変換させる化合物として合成レチノイドAM80(※3)を同定しました。
- 膵がんマウスモデルにAM80を投与すると、腫瘍が物理的にやわらかくなり、腫瘍血管の拡張と抗がん剤の薬物送達(ドラッグデリバリー)の改善が見られること、これに伴い抗がん剤の治療効果が増強することを見出しました。組み換えセンダイウイルスを用いてMeflin遺伝子をCAFに導入する方法を用いた場合にも同様の効果がみられました。
- AM80と抗がん剤の併用の効果を膵がん患者で検証する医師主導治験(治験責任医師:川嶋啓揮)がAMED臨床研究・治験推進研究事業の支援のもと開始されています(研究開発代表者:藤城光弘、Investigator-initiated Clinical Trial of MIKE-1 (MIKE-1) 、jRCT臨床試験ID:jRCT2041210056)。
背景
ヒトの膵がん等の難治がんの特徴として、間質に高度な線維化を伴うことが指摘されています。がん間質の線維化において中心的な役割を果たすのは、CAFの増生です(参考文献[1])。活性化したCAFは、コラーゲン等の細胞外基質およびそれらを架橋するリシルオキシダーゼ(LOX)(※4)ファミリー分子群を産生することによって、重合されたコラーゲン線維を形成します。その結果、がん組織の硬化と内圧上昇、血管の虚脱を誘導し、抗がん剤の浸透を阻害することが知られています。(図1)。
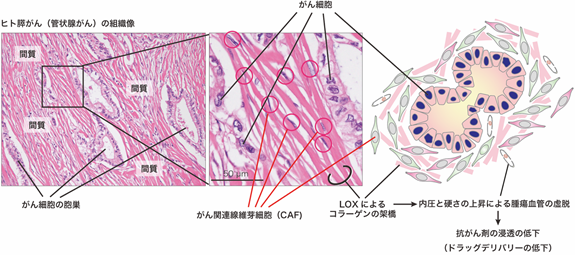
図1 ヒト膵がん(管状腺がん)の典型的な組織像(左図)とシェーマ(右図)膵がんにおいてがん細胞の周囲にはCAFが増生している。さらにCAFはコラーゲン等の細胞外基質を産生しそれらを架橋することで組織硬化を引き起こす。組織硬化による腫瘍組織の内圧上昇は腫瘍血管を虚脱させ、抗がん剤の浸透を阻害するといわれている。
一方、海外の先行研究では、CAFを標的とする治療法の開発が失敗しており、本分野の研究者は、CAFは多様な機能をもつ細胞の集団であり、がん促進性CAFとがん抑制性CAFが存在する可能性があると考えていました。本研究者チームは2019年に、がん抑制性CAFの初の機能マーカーとしてGPI(グリコシルホスファチジルイノシトール)によって細胞膜にアンカーされている膜型分子であるMeflinを同定しました(図2)(参考文献[2]-[5])。また、マウスモデルを用いた検証から、がんの進行中に、Meflin陽性がん抑制性CAFが、α-SMA(平滑筋アクチン、※5)陽性のがん促進性CAF(Meflinは陰性~弱陽性)に形質転換することも報告しました(CAFががん細胞の敵から味方へ寝返りする現象)。また、非小細胞肺がんにおいては、Meflin陽性CAFの数が多い患者では免疫チェックポイント阻害剤の奏効率が高いことも報告しています(参考文献[6])。このように、Meflin陽性・陰性CAFの存在やその量比ががんの進展に大きく影響することを、今までの研究で明らかにしてきました。しかしながら、人為的にがん抑制性CAFを増やす技術、あるいはCAFの性質を変化させる有効な技術についてはわかっていませんでした。
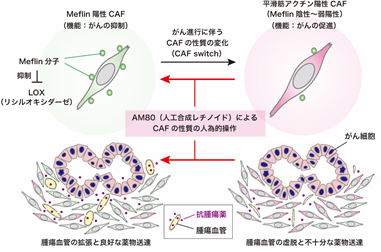
図2 AM80は平滑筋アクチン陽性CAFからMeflin陽性CAFへの形質転換を誘導するがんの進行に伴い、CAFの性質はMeflin陽性から平滑筋アクチン陽性へと形質転換することが報告されている。AM80はこの変化を戻し、CAFにおけるMeflinの発現を上昇させることが判明した。Meflin分子の機能として、コラーゲンの架橋(組織硬化を引き起こす)に重要な酵素といわれるLOXと結合し、その働きを抑制することがわかり、Meflinの発現上昇は組織の軟化に寄与する可能性が示唆された。
研究成果
本研究チームは、がん促進性CAFをがん抑制性CAFに戻す、すなわちMeflinの発現を上昇させる物質の探索を目的として、化合物ライブラリーのスクリーニングを実施しました。その結果、自然界に存在しない合成レチノイドの一つであるAM80がMeflinの発現を有意に上昇させ、CAFの性質をがん促進性からがん抑制性に変化させることを見出しました(図2)。担がんマウスモデルで検証したところ、AM80自体は抗腫瘍効果を示しませんでしたが、AM80と抗がん剤を併用したところ、Meflin陽性がん抑制性CAFと腫瘍血管面積の増加、コラーゲン線維の配向の変化、組織の軟化、腫瘍血管の拡張とともに腫瘍内抗がん剤濃度の上昇が確認されました(図3A-D)。また、AM80と抗がん剤の併用は、抗がん剤単独と比較して有意な抗腫瘍効果を示しました(図3E)。本効果はMeflin遺伝子欠損マウスでは確認されませんでした。また、組み換えセンダイウイルスベクターを用いてMeflin遺伝子をCAFに人工的に導入した検証でも、同様の抗がん剤の効果の増強が確認されました。
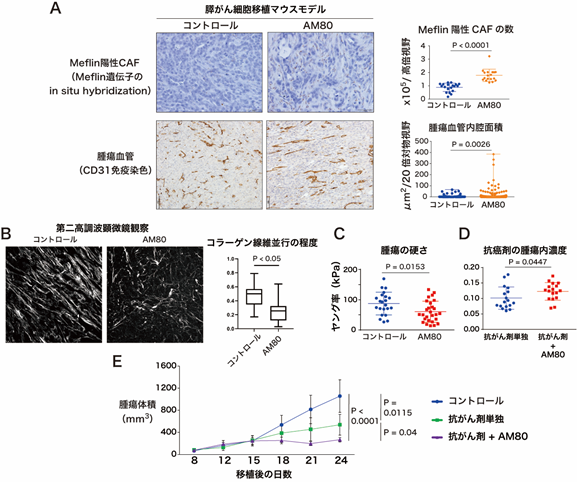
図3 AM80は腫瘍内CAFの性質を変化させ、抗がん剤の薬物送達(ドラッグデリバリー)を改善する担がんマウスにAM80を投与すると、腫瘍内でMeflin陽性CAFの増加と腫瘍血管の拡張(A)、コラーゲンの架橋抑制(B)、腫瘍の軟化(C)が認められた。AM80と抗がん剤を併用すると、抗がん剤単独に比べて抗がん剤の腫瘍内濃度が上昇し(D)、有意な腫瘍増大抑制効果が認められた(E)。
次に、Meflin分子の発現の上昇ががん間質の性質を変化させる機序を解明するため、Meflinの結合分子を探索したところ、LOXを同定しました。組換えタンパク質を用いた実験により、本Meflin-LOX間結合は直接的な結合であり、またMeflinはLOXのコラーゲン架橋活性を阻害することが判明しました。LOXはコラーゲン等の細胞外基質の架橋と組織硬化を引き起こす重要な酵素と知られていることから、その活性を抑制するMeflinの機能の本質は、組織硬化の抑制(=組織を柔らかくすること)である可能性が示唆されました。これらの検証結果から、AM80はCAFにおけるMeflinの発現を上昇させる、あるいはMeflin陽性がん抑制性CAFを増加させることにより、組織軟化と内圧の低下を介して、腫瘍血管の拡張と抗がん剤の薬物送達の増強を誘導する可能性が示唆されました(図2)。
今後の展開
本研究の成果は、薬物によりがん抑制性CAFの数を増加させることが新しい難治がんの治療法になることを示しています。本成果を受けて現在、名古屋大学消化器内科学および東京大学消化器内科学において、切除不能膵がんに対するAM80(タミバロテン)と従来の抗がん剤(ゲムシタビン・ナブパクリタキセル)の併用効果を検証する第Ⅰ/Ⅱ相医師主導治験(治験責任医師:川嶋啓揮)が承認され、治験を開始しています(Investigator-initiated Clinical Trial of MIKE-1 (MIKE-1) 、AMED臨床研究・治験推進研究事業における研究開発課題「国産既存薬の新効能による膵がんの間質初期化治療法の開発と第Ⅰ/Ⅱ相医師主導治験の実施」、研究開発代表者:藤城光弘)(参考文献[7])。なお、本医師主導治験は名古屋大学医学部附属病院先端医療開発部、ラクオリア創薬株式会社およびテムリック株式会社の協力のもとに実施されています。今後は本研究成果を受けて、CAFの性質を制御する技術の開発がますます進んでいくことが期待されます。
用語説明
- ※1 がん関連線維芽細胞(cancer-associated fibroblast:CAF)
- がん間質(がん細胞を支える組織)を構成する線維芽細胞(間質を構成するコラーゲン等の線維を産生する細胞)であり、がん細胞の悪性化(増殖、浸潤、転移)を促進するさまざまな増殖因子やサイトカイン・ケモカインを大量に産生することが報告されている。近年はCAFにも機能多様性があり、がん促進性CAFとがん抑制性CAFの両者が存在することを示唆する実験データが報告されている(参考文献[1])。
- ※2 Meflin(メフリン)
- GPI(グリコシルホスファチジルイノシトール)アンカー型の膜型分子であり、本研究チームが以前に未分化な間葉系幹細胞および線維芽細胞の特異的マーカーとして報告した(参考文献[2]-[6]、[8]-[10])。サイトカインの一種であるBMP7(Bone Morphogenetic Protein 7)の機能を増強し、組織の線維化の抑制に関与することが報告されているが(参考文献[5]、[8]、[10])、その詳細な分子機能については未だ不明な点が多い。
- ※3 AM80(一般名:タミバロテン)
- 首藤紘一博士(東京大学名誉教授)および影近弘之博士(東京医科歯科大学)により開発された合成レチノイドであり、現在、急性前骨髄性白血病に治療に用いられている(日本新薬・アムノレイク錠)。
- ※4 LOX(リシルオキシダーゼ)
- 細胞外マトリックスタンパク質であるコラーゲンやエラスチンの架橋を司る酵素であり、組織の線維化や硬化に関与する酵素として知られている。
- ※5 α-SMA(平滑筋アクチン)
- 平滑筋細胞やがん促進性CAFのマーカーとして広く使用されている。
発表雑誌
- 掲雑誌名
- Oncogene
- 論文名
- Pharmacologic conversion of cancer-associated fibroblasts from a protumor phenotype to an antitumor phenotype improves the sensitivity of pancreatic cancer to chemotherapeutics
- 著者
- Tadashi Iida1,2,11, Yasuyuki Mizutani1,2,11, Nobutoshi Esaki1, Suzanne M. Ponik3, Brian M Burkel3, Liang Weng4, Keiko Kuwata5, Atsushi Masamune6, Seiichiro Ishihara7, Hisashi Haga7, Kunio Kataoka1,2, Shinji Mii1, Yukihiro Shiraki1, Takuya Ishikawa2, Eizaburo Ohno2, Hiroki Kawashima8, Yoshiki Hirooka9, Mitsuhiro Fujishiro2,10, Masahide Takahashi11, Atsushi Enomoto1
- 所属
- 1Department of Pathology
- 2Gastroenterology and Hepatology, Nagoya University Graduate School of Medicine, Nagoya 466-8550, Japan
- 3Department of Cell and Regenerative Biology, University of Wisconsin-Madison, Madison, WI 53705, USA
- 4Department of Oncology, Xiangya Cancer Center, Xiangya Hospital, Central South University, Changsha 410008, China
- 5Institute of Transformative Bio-Molecules, Nagoya University, Furo-cho, Chikusa-ku, Nagoya 464-8602, Japan
- 6Division of Gastroenterology, Tohoku University Graduate School of Medicine, Sendai 980-8574, Japan
- 7Faculty of Advanced Life Science, Hokkaido University, Sapporo 060-0810, Japan
- 8Department of Endoscopy, Nagoya University Hospital, Nagoya 466-8550, Japan
- 9Department of Gastroenterology and Hepatology, Fujita Health University, Toyoake, Aichi 470-1192, Japan
- 10Department of Gastroenterology, Graduate School of Medicine, The University of Tokyo, Tokyo 113-8655, Japan
- 11International Center for Cell and Gene Therapy, Fujita Health University, Toyoake, Aichi 470-1192, Japan
- DOI
- 10.1038/s41388-022-02288-9
参考文献
[1] Kobayashi H, Enomoto A, Woods SL, Burt AD, Takahashi M, Worthley DL. Cancer-associated fibroblasts in gastrointestinal cancer. Nat Rev Gastroenterol Hepatol. 16:282-295, 2019. doi: 10.1038/s41575-019-0115-0.
[2]Maeda K, Enomoto A, Hara A, Asai N, Kobayashi T, Horinouchi A, Maruyama S, Ishikawa Y, Nishiyama T, Kiyoi H, Kato T, Ando K, Weng L, Mii S, Asai M, Mizutani Y, Watanabe O, Hirooka Y, Goto H, Takahashi M. Identification of Meflin as a Potential Marker for Mesenchymal Stromal Cells. Sci Rep. 6:22288, 2016. doi: 10.1038/srep22288.
[3]Mizutani Y, Kobayashi H, Iida T, Asai N, Masamune A, Hara A, Esaki N, Ushida K, Mii S, Shiraki Y, Ando K, Weng L, Ishihara S, Ponik SM, Conklin MW, Haga H, Nagasaka A, Miyata T, Matsuyama M, Kobayashi T, Fujii T, Yamada S, Yamaguchi J, Wang T, Woods SL, Worthley D, Shimamura T, Fujishiro M, Hirooka Y, Enomoto A, Takahashi M. Meflin-positive cancer-associated fibroblasts inhibit pancreatic carcinogenesis. Cancer Res. 79:5367-5381, 2019. doi: 10.1158/0008-5472.CAN-19-0454.
[4]Miyai Y, Esaki N, Takahashi M, Enomoto A. Cancer-associated fibroblasts that restrain cancer progression: Hypotheses and perspectives. Cancer Sci. 111:1047-1057, 2020. doi: 10.1111/cas.14346.
[5]Kobayashi H, Gieniec KA, Wright JA, Wang T, Asai N, Mizutani Y, Lida T, Ando R, Suzuki N, Lannagan TRM, Ng JQ, Hara A, Shiraki Y, Mii S, Ichinose M, Vrbanac L, Lawrence MJ, Sammour T, Uehara K, Davies G, Lisowski L, Alexander IE, Hayakawa Y, Butler LM, Zannettino ACW, Din MO, Hasty J, Burt AD, Leedham SJ, Rustgi AK, Mukherjee S, Wang TC, Enomoto A, Takahashi M, Worthley DL, Woods SL. The Balance of Stromal BMP Signaling Mediated by GREM1 and ISLR Drives Colorectal Carcinogenesis. Gastroenterology. 160:1224-1239, 2021. doi: 10.1053/j.gastro.2020.11.011.
[6]Miyai Y, Sugiyama D, Hase T, Asai N, Taki T, Nishida K, Fukui T, Chen-Yoshikawa TF, Kobayashi H, Mii S, Shiraki Y, Hasegawa Y, Nishikawa H, Ando Y, Takahashi M, Enomoto A. Meflin-positive cancer-associated fibroblasts enhance tumor response to immune checkpoint blockade. Life Sci Alliance. 5(6):e202101230, 2022. doi: 10.26508/lsa.202101230.
[7]Mizutani Y, Iida T, Ohno E, Ishikawa T, Kinoshita F, Kuwatsuka Y, Imai M, Shimizu S, Tsuruta T, Enomoto A, Kawashima H, Fujishiro M. Safety and efficacy of MIKE-1 in patients with advanced pancreatic cancer: a study protocol for an open-label phase I/II investigator-initiated clinical trial based on a drug repositioning approach that reprograms the tumour stroma. BMC Cancer. 22(1):205, 2022. doi: 10.1186/s12885-022-09272-2.
[8]Hara A, Kobayashi H, Asai N, Saito S, Higuchi T, Kato K, Okumura T, Bando YK, Takefuji M, Mizutani Y, Miyai Y, Saito S, Maruyama S, Maeda K, Ouchi N, Nagasaka A, Miyata T, Mii S, Kioka N, Worthley DL, Murohara T, Takahashi M, Enomoto A. Roles of the Mesenchymal Stromal/Stem Cell Marker Meflin in Cardiac Tissue Repair and the Development of Diastolic Dysfunction. Circ Res. 125:414-430, 2019. doi: 10.1161/CIRCRESAHA.119.314806.
[9]Hara A, Kato K, Ishihara T, Kobayashi H, Asai N, Mii S, Shiraki Y, Miyai Y, Ando R, Mizutani Y, Iida T, Takefuji M, Murohara T, Takahashi M, Enomoto A. Meflin defines mesenchymal stem cells and/or their early progenitors with multilineage differentiation capacity. Genes Cells. 26:495-512, 2021. doi: 10.1111/gtc.12855.
[10]Nakahara Y, Hashimoto N, Sakamoto K, Enomoto A, Adams TS, Yokoi T, Omote N, Poli S, Ando A, Wakahara K, Suzuki A, Inoue M, Hara A, Mizutani Y, Imaizumi K, Kawabe T, Rosas IO, Takahashi M, Kaminski N, Hasegawa Y. Fibroblasts positive for meflin have anti-fibrotic properties in pulmonary fibrosis. Eur Respir J. 58:2003397, 2021. doi: 10.1183/13993003.03397-2020.
お問い合わせ先
研究内容
名古屋大学医学部・医学系研究科 腫瘍病理学
教授 榎本 篤
名古屋大学医学部附属病院 消化器内科
病院助教 飯田 忠
広報担当
名古屋大学医学部・医学系研究科 総務課総務係
AMED事業
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
次世代がん医療創生研究事業
シーズ開発・研究基盤事業部 革新的先端研究開発課
革新的先端研究開発支援事業