2018-07-17 理化学研究所
理化学研究所(理研)生命機能科学研究センター先端バイオイメージング研究チームの渡邉朋信チームリーダー、アルノ・ジェルモン研究員、市村垂生上級研究員(研究当時)らの研究チーム※は、大腸菌にレーザー光を照射したときに散乱する光(ラマン散乱光[1])が、大腸菌が持つ薬剤耐性の違いによって異なる特徴を示すことを明らかにしました。また、この現象を応用し、薬剤耐性大腸菌の種類を非染色・非侵襲・短時間で、しかもほぼ100%の確率で判別する方法を開発しました。
本研究成果は、病理診断や環境衛生管理における、正確・迅速な菌種の同定につながると期待できます。
今回、研究チームはそれぞれの薬剤耐性大腸菌の遺伝子発現パターンとラマン散乱光の関係を調べ、特定の遺伝子の発現量と、ラマン散乱光の特徴との強い相関を見いだしました。この結果は、未知の菌に光を照射してそのラマン散乱光を見るだけで菌の種類を判別し、さらにはその菌の遺伝子の発現パターンまで推定できる可能性を示しています。
本研究は、英国のオンライン科学雑誌『Communications Biology』(7月2日号)に掲載されました。

図 レーザー光のラマン散乱光による薬剤耐性大腸菌の判別
※研究チーム
理化学研究所 生命機能科学研究センター
先端バイオイメージング研究チーム
チームリーダー 渡邉 朋信(わたなべ とものぶ)
研究員 アルノ・ジェルモン(Arno Germond)
上級研究員(研究当時) 市村 垂生(いちむら たろう)
(現 客員研究員、大阪大学 先導的学際研究機構 超次元ライフイメージング研究部門 特任准教授)
客員研究員 藤田 英明(ふじた ひであき)
多階層生命動態研究チーム
チームリーダー 古澤 力(ふるさわ ちから)
(東京大学大学院 理学研究科 教授)
研究員 堀之内 貴明(ほりのうち たかあき)
背景
人類と病気との闘いの歴史において、感染症の克服は最も大きな課題の一つです。細菌の増殖を抑制する抗生物質は、人類がその闘いから得た強力な武器であり、抗生物質の利用によって健康や平均寿命は飛躍的に向上しました。
しかし近年、抗生物質が効かない薬剤耐性を獲得した細菌(薬剤耐性菌)の増加が世界中で問題となっています。薬剤耐性菌は、抗生物質にさらされる過酷な環境で進化し、抗生物質を分解する能力などを獲得しました。そして、ある細菌種に対して有効な抗生物質が複数開発されている場合でも、抗生物質ごとに耐性を獲得した細菌も多く存在します。そのため、細菌種を同定しても、どの抗生物質に対して耐性を持つかが分からなければ、治療方針や新しい抗生物質の開発方針を立てることができません。
現在、細菌の一般的な薬剤耐性検査では、増殖阻害効果の測定や遺伝子解析を抗生物質ごとに行っており、検査に要する時間やコストが課題となっています。したがって、細菌がどの抗生物質に耐性を持っているのかを、簡素かつ迅速に行う方法が、感染予防や衛生管理の観点から今後重要な技術になると考えられます。
研究手法と成果
研究チームは、ラマン散乱と呼ばれる光散乱現象に着目しました。細胞に光を当てると、光は散乱します。このとき、散乱光の一部は照射光と異なる波長(色)となります(ラマン散乱)。ラマン散乱とは、物質に光を照射した際に、物質を構成する分子の振動がエネルギーを光に与えたり、逆に光から奪ったりすることで、光の波長が少し変化してから散乱する現象です。
この波長の変化(色の違い)は、光を照射した細胞内の分子が持つ固有振動数に対応します。細胞はタンパク質、核酸(DNAやRNA)、代謝物といったさまざまな分子で構成されているため、単一色の光を当てても、細胞から得られるラマン散乱光はさまざまな色となります。
すなわち、ラマン散乱光を分光[2]すると、さまざまなピークを持つスペクトル[2]として計測されます。スペクトルの形状は細胞内部の分子組成を反映しており、分子組成は細胞の状態や種類によって異なります。このことを利用して、逆にスペクトルの形状から細胞種を判別することも可能です。そして、さまざまな抗生物質に対する菌の耐性の違いも、菌の分子組成の違いとして現れると考えられます。したがって、スペクトルの形状から薬剤耐性菌の種類を判別できると予想しました。
そこで、多種類の試料のラマン散乱スペクトルを自動取得するための「ハイスループットラマン散乱分光装置」を開発しました(図1)。この装置は96の試料を培養できる96ウェルプレートを備えており、複数の試料を連続して計測することが可能です。
ハイスループットラマン散乱分光装置を使った実験では、実験室内での長期培養によって薬剤耐性を持つように進化した10種類の大腸菌株を用いました。これらは、理研生命機能科学研究センター多階層生命動態研究チームの古澤力チームリーダーと堀之内貴明研究員らが作製したものです注1)。10種類の薬剤耐性大腸菌とその親株(薬剤耐性獲得前の大腸菌)をウェルプレートでそれぞれ独立に培養し、合わせて11種類、計約200試料を用意しました。そして、試料のラマン散乱スペクトルを自動取得しました(図2)。
注1) Prediction of antibiotic resistance by gene expression profiles. Shingo Suzuki, Takaaki Horinouchi & Chikara Furusawa, Nature Communications volume 5, Article number: 5792 (2014)
図2に示した11種類のスペクトルは互いに似ているものの、統計的に有意に異なっていました。この複雑なスペクトル形状の相違を、より明確に可視化するために、主成分分析法[3]と判別分析法[3]を組み合わせた解析法を用いました。形状の相違を表す二つの特徴量の軸で構成される二次元平面上に、各試料のスペクトルをプロットした結果(平面投影)、同種の薬剤耐性大腸菌のスペクトルは近接して分布し、異なる種類の薬剤耐性大腸菌のスペクトルは互いに離れていることが示されました(図3)。
次に、これらのスペクトルのデータ群を用いて、機械学習[4]と呼ばれる方法により未知の薬剤耐性大腸菌のスペクトルの判別を試みました。まず、図3に示した試料の分布の位置と広がりをコンピュータに記憶させます。続いて、別の日に計測したスペクトルのデータを入力したときにも正しい判別ができるように、コンピュータに学習させます。こうして、種類が未知の試料のスペクトルのデータを入力したときに、その形状が図3の平面上のどこに位置するかを計算させます。これにより、未知の試料のスペクトルがどの薬剤耐性大腸菌のグループに属するかを判別できます。
実際に、図2・3とは異なる日に異なる試料で測ったスペクトルの種類をコンピュータが正しく判別できるかを調べたところ、11種類全てほぼ100%の確率で、しかも1試料あたり約10秒という短時間で、判別できました。同じ実験を4セット行うことにより、この結果には再現性があることも確認しました。
さらに、それぞれの薬剤耐性大腸菌の遺伝子の発現パターンと、ラマン散乱スペクトルとの関係を調べました。その結果、各薬剤耐性大腸菌の幾つかの遺伝子の発現量と、スペクトルのいくつかのピーク強度との間に強い相関があることが分かりました。
ラマン散乱スペクトルを構成する約1,000個の振動数点(cm-1)について、各点での光強度と、遺伝子の発現量の間の相関係数を全て調べた結果、その中に強い相関を持つ組み合わせを発見しました(図4)。例えば、elaBと呼ばれるストレス耐性機能に重要な膜タンパク質の遺伝子の発現量と、1209cm-1に検出されるタンパク質量を表すピーク強度の相関係数は、0.92と非常に高い(0は無相関、1は完全相関)ことが分かりました。また、チトクロムの合成に関係するcyoA遺伝子の発現量と、730cm-1のピーク強度にも強い相関がみられました。これらの結果は、細胞の中の変化の情報が、ラマン散乱という光の強度によって観察可能であることを示しています。
今後の期待
今回の研究では、複数の菌種のラマン散乱スペクトルをハイスループットで解析し、薬剤耐性大腸菌の種類を1試料あたり約10秒という短時間で判別できることを実証しました。スペクトルは、菌の生育状況によって揺らぐことが知られているため、本研究を行った制御された実験室環境だけではなく屋外や生活環境、医療現場など、他のさまざまな環境下でもスペクトルを計測・収集し、巨大なデータベースを作ることで、より高度な薬剤耐性菌種の判別が可能になります。
また、本手法は遺伝子発現を測定するツールとしても有効です。今回解析した20種以外のさまざまな遺伝子の発現量とスペクトルの関係をデータベース化することで、光を当ててラマン散乱光を計測するだけで、遺伝子の発現量を簡易的に推定できるようになると期待できます。
センサー技術の向上や、人工知能を含む機械学習技術の飛躍的な進歩によって、ひと昔前までは実現困難だったこれらの手法も、現実的な目標になりつつあります。
今回開発した手法は、衛生環境の管理や病理診断、創薬、基礎生物学研究などに幅広く応用されると期待できます。
原論文情報
Arno Germond, Taro Ichimura, Takaaki Horinouchi, Hideaki Fujita, Chikara Furusawa, and Tomonobu M. Watanabe, “Raman spectral signature reflects transcriptomic features of antibiotic resistance”, Communications Biology, 10.1038/s42003-018-0093-8
発表者
理化学研究所
生命機能科学研究センター 先端バイオイメージング研究チーム
チームリーダー 渡邉 朋信(わたなべ とものぶ)
研究員 アルノ・ジェルモン(Arno Germond)
上級研究員(研究当時) 市村 垂生(いちむら たろう)
(現 客員研究員、大阪大学 先導的学際研究機構 超次元ライフイメージング研究部門 特任准教授)
お問い合わせ先
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- ラマン散乱光
- 光を物質に入射すると、その一部が散乱する。そのほとんどは入射光と同じ波長(レイリー散乱光)であるが、一部の光は、物質を構成する分子の固有の振動からエネルギーを得たり、逆に奪われたりすることで、入射光とは異なる波長で散乱される。この現象をラマン散乱といい、そのときの光をラマン散乱光と呼ぶ。1928年に、インドの物理学者C. V. Ramanによって発見された。
-
- 分光、スペクトル
- 光には通常、さまざまな波長が含まれている。光をプリズムに通したり回折格子に反射させたりすることで、波長ごとの成分に分けることを分光と呼ぶ。スペクトルは、分光した結果を波長の強さなどで表した図。ラマン散乱分光では、横軸の単位には、振動数を表すcm-1を用いる。可視光の波長域(400~700nm)では、1cm-1のシフトは0.02~0.05nm程度の波長シフトに相当する。
-
- 主成分分析法、判別分析法
- どちらも多次元データを低次元に縮約(次元削減)することで、データ全体の傾向を視覚化しデータが持つ情報を解釈しやすくする多変量解析の手法。主成分分析法は教師なし学習であり、判別分析法は教師あり学習である。ここでは、主成分分析法がデータ全体の次元削減の役割を担い、判別分析法は分類に寄与の大きい特徴軸を見つけ出す働きをする。
-
- 機械学習
- 機械学習は、コンピュータに反復的にデータを与え、データの特徴づけや分類などを自動的に習得させるデータ解析法である。この特徴づけや分類にしたがって、未知のデータに対する推定や将来予測などが可能になる。上述の判別分析法は、基礎的な機械学習手法の一つである。

図1 ハイスループットラマン散乱分光装置
(a)今回開発した、ハイスループットラマン散乱分光装置。96の試料を同時に培養できる96ウェルプレート用のステージと倒立顕微鏡、レーザー照射装置からなる。
(b)実験の概要図。培養した大腸菌を96ウェルプレートのウェル(くぼみ)に入れ、ウェル内の焦点領域を通過した菌のレーザー照射とラマン散乱スペクトルの取得を行う。ステージは自動制御で動き、96の試料を連続的に計測できる。
(c)システムの光学経路図。レーザーの照射と散乱光の取得は同じ対物レンズで行い、対物レンズ側に散乱したラマン散乱光が二色性ミラーを通過して分光器に入る。
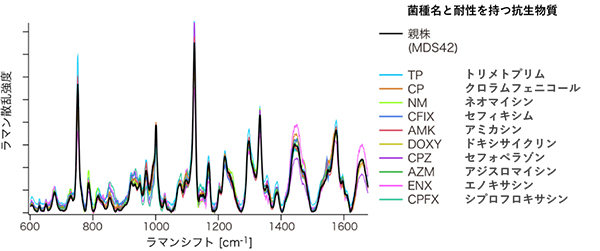
図2 ハイスループットラマン散乱分光装置による薬剤耐性大腸菌のラマン散乱スペクトル
10種の薬剤耐性大腸菌と親株のラマン散乱スペクトルを色分けで示した。縦軸はラマン散乱光の強度、横軸はラマンシフト(照射したレーザー光と散乱光の振動数の差)を表す。

図3 ラマン散乱スペクトルの平面投影による比較
各点が一つの試料を表す。ラマン散乱スペクトル形状の相違を表す二つの特徴量の軸で構成される二次元平面上に、各試料のスペクトルをプロットした。同じ種類の薬剤耐性大腸菌のスペクトルが近接していて、異なる種類の薬剤耐性大腸菌のスペクトルは、互いに離れていることが分かる。それぞれの薬剤耐性大腸菌に描かれている楕円は、統計的に推定される分布の広がりの大きさを表す。(a)では、菌種AZMとCP、MDS42とTPは、それぞれ分布が重なって分離できないように見えるが、これらは(b)に示すように、3番目の軸(特徴軸3)の方向((a)の紙面に垂直な方向)で分離される。

図4 遺伝子の発現量とラマン散乱の振動数点(cm-1)のピークの強度との関係
縦軸はマイクロアレイによるRNA発現解析でみた遺伝子発現量、横軸はラマン散乱の振動数点(cm-1)のピーク強度を表し、グラフ内の各点は薬剤耐性大腸菌の種類(抗生物質の種類)を示す。
(a) ストレス耐性機能に重要な膜タンパク質のelaB遺伝子の発現量と、1209cm-1に検出されるタンパク質量を表すピーク強度の関係。elaB遺伝子の発現量が多いほど、このピーク強度も強い。
(b) チトクロムの合成に関係するcyoA遺伝子の発現量と、核酸に含まれるアデニンの存在を表す730cm-1のピーク強度の相関。cyoA遺伝子の発現量が低いときほど、スペクトルのピークが高くなっている。とくに、薬剤耐性大腸菌種NMはこのcyoA遺伝子に変異があるため、他の薬剤耐性大腸菌と比べて発現量が低いが、特異的に強いラマン散乱強度を持つことが分かった。これは仮説として、チトクロムの生成量や活性が下がると、チトクロムのATP消費量が下がるため、アデニンのピークが上がったと解釈できる。