2018-07-20 理化学研究所
理化学研究所(理研)バイオリソース研究センター遺伝工学基盤技術室の的場章悟専任研究員、井上貴美子専任研究員、小倉淳郎室長らの国際共同研究チーム※は、マウスクローン胚の包括的な解析を行い、新たなエピゲノム[1]異常を発見しました。
本研究成果は、有用な形質を持ったクローン動物の出生効率の改善や再生医療に向けた、ヒト体細胞核移植胚由来ES細胞[2]の樹立効率改善に貢献すると期待できます。
クローン動物の生まれる率は1%程度と非常に低く、ほとんどが胚発生の途中で死んでしまうことが問題となっていました。今回、国際共同研究チームは、クローン胚で見られる発生異常の原因を探索することを目的として、マウスクローン胚について包括的なトランスクリプトーム・エピゲノム解析[3]を行いました。その結果、新たなエピゲノム異常として、ヒストン修飾[4]依存的なインプリント遺伝子[5]群が全てインプリント情報[5]を失っていることを発見しました。これらのインプリント遺伝子の多くが胎盤の形成や着床後の胚発生に関わる因子であることから、クローン胚の発生異常の原因の一つであると考えられます。
本研究は、米国の科学雑誌『Cell Stem Cell』(9月6日号)の掲載に先立ち、オンライン版(7月19日付け:日本時間7月20日)に掲載されます。
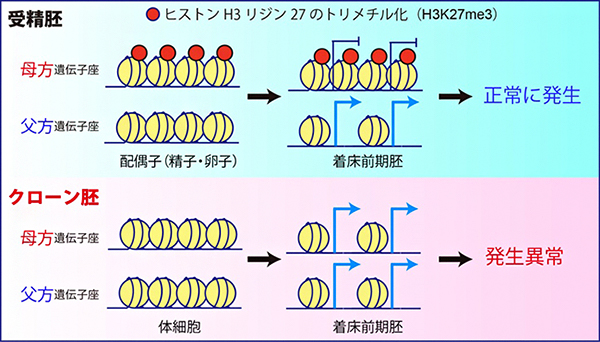
図1 最適化したクローン胚でもヒストン修飾依存的なインプリント遺伝子が破綻
※国際共同研究チーム
理化学研究所 バイオリソース研究センター 遺伝工学基盤技術室
専任研究員 的場 章悟(まとば しょうご)
専任研究員 井上 貴美子(いのうえ きみこ)
室長 小倉 淳郎(おぐら あつお)
(理化学研究所 開拓研究本部 小倉発生遺伝工学研究室 主任研究員)
浙江大学生命科学研究院
教授 リ・シェン(Li Shen)
ハーバード大学 医学部 ボストン小児病院 ハワードヒューズ医学研究所
教授 イ・ジャン(Yi Zhang)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究A「エピゲノム編集による体細胞核移植法の改善(研究代表者:的場章悟)」による支援を受けて行われました。
背景
体細胞核移植法によってクローン動物の作製が可能です。2018年のはじめにも、霊長類で初めてカニクイザルのクローンが生まれたことが報告され注1)、世界中でニュースとなりました。1997年に初めて哺乳類のクローン羊「ドリー」の誕生が報告されて以来、有用な形質を持った動物を増やすことだけでなく、複雑なヒトの疾患モデルを効率的に作出すること、さらに再生医療へ向けての患者体細胞核移植胚由来ES細胞の樹立など、さまざまな応用が注目されてきました。
ただし、クローン動物の生まれる率は1%程度と非常に低く、ほとんどが発生の途中で死んでしまうことが問題となっていました。この原因として、クローン胚の発生を阻害する因子がもともとのドナー体細胞核に存在することが想定されていますが、その実態はまだよく分かっていません。
これまでの小倉淳郎室長らおよびイ・ジャン教授らの研究から、クローン胚の発生を阻害する重要な二つの因子が同定されています。一つは、X染色体の不活性化を誘導するXist遺伝子[6]の異常な活性化です注2)。この異常は、ドナーとしてXist遺伝子を一部欠損した体細胞を使用すること、もしくはXist遺伝子に対するsiRNA[7]を導入することで回避でき、これによりマウスクローンの出生効率を10%程度にまで高めることができます注3)。
もう一つの因子は、ヒストン修飾の一つヒストンH3の9番目リジンのトリメチル化(H3K9me3)で、このヒストン修飾の存在するゲノム領域は核移植直後の転写活性化に抵抗性を示します。H3K9me3は、ヒストン脱メチル化酵素Kdm4dをコードする遺伝子のメッセンジャーRNA(Kdm4d mRNA)のクローン胚への注入によって除去することができ、その結果としてマウスクローンの出生効率を1%程度から8%程度にまで高めることができます注4)。
注1)Liu Z, Cai Y, Wang Y, Nie Y, Zhang C, Xu Y, Zhang X, Lu Y, Wang Z, Poo M, Sun Q.“Cloning of Macaque Monkeys by Somatic Cell Nuclear Transfer.”Cell. 2018 Feb 8;172(4):881-887.e7
注2)2010年9月17日プレスリリース「マウス体細胞クローンの産子出生効率が10倍近くも改善」
注3)2011年11月8日プレスリリース「遺伝子改変なしにクローンマウスの出生率を10倍高める技術を開発」
注4)Matoba S, Liu Y, Lu F, Iwabuchi KA, Shen L, Inoue A, Zhang Y.“Embryonic development following somatic cell nuclear transfer impeded by persisting histone methylation.”Cell. 2014 Nov 6;159(4):884-95.
研究手法と成果
共同研究グループはまず、上記の発生を阻害する二つの因子を同時に取り除く実験を行いました。その結果、マウスのクローン出生効率は相乗的に上昇し、最大24%にまで達しました。しかし、この効率はマウス受精胚の出生効率(50%以上)の半分以下であり、クローン特有の異常である胎盤の過形成などの表現型も回復しなかったことから、クローン胚にはまだ重要な発生阻害因子が存在すると考えられました。
そこで、上記のように最適化して作製したクローン胚について、新たな異常を同定するために包括的なトランスクリプトーム・エピゲノム解析を行いました。クローン胚で見られる胎盤形成異常などの表現型には、片親性発現を示すインプリント遺伝子の関与の可能性が示されていたことから、インプリント遺伝子について詳細な解析を行いました。その結果、予想に反して、一般的なDNAのメチル化に依存するインプリント遺伝子はほとんどが正常なインプリント発現を維持していました。
その一方で、最近新たに同定された「ヒストン修飾(ヒストンH3の27番目リジンのトリメチル化:H3K27me3)依存的なインプリント遺伝子群」が、全て片親性(父方)の発現パターンを失って、父方・母方の両遺伝子座から発現していることが明らかになりました。実際に、クローン胚におけるH3K27me3のゲノム上の局在をクロマチン免疫沈降-シークエンシング法(ChIP-seq)[8]で解析したところ、受精胚で見られるような母方遺伝子座に特異的なH3K27me3の局在が完全に失われていることが分かりました。(図1)
着床前の受精胚で見られる母方遺伝子座へのH3K27me3の局在は、卵子で確立されたものが受精後も引き継がれたものだと考えられています。実際に、さまざまな細胞種におけるH3K27me3の局在情報について、公開されているデータベースをもとに解析した結果、母方遺伝子座特異的なH3K27me3は卵子と着床前の受精胚に特異的なもので、その他の体細胞では解析したどの細胞種でも失われていることが分かりました。すなわち、ドナーとして使用する体細胞で既に母方遺伝子座のH3K27me3が存在しないことが、クローン胚での異常の根本的な原因と考えられます。
今後の期待
本研究では、マウスクローン胚の新たな異常として、H3K27me3依存的なゲノムインプリンティング[5]が完全に破綻していることを発見しました。これらのH3K27me3依存的なインプリント遺伝子の多くが胎盤の形成や着床後の胚発生に関与することが知られています。マウスクローン胚では、発生途上でこれらの遺伝子が過剰発現してしまうことで、さまざまな発生異常をきたしていることが考えられます。原因となるH3K27me3の異常を人為的に操作することで、これらの発生異常を回避できる可能性があります。
今後は、今回マウスクローン胚でみられたH3K27me3依存的なインプリント遺伝子の破綻が他の哺乳類のクローン胚でも保存されている現象なのか検証する必要があります。また、CRISPR/Cas9[9]などのゲノム領域特異的なタンパクリクルート技術とヒストン修飾転移酵素などを組み合わせた「エピゲノム編集」技術を開発することで、クローンの出生効率・品質がさらに改善し、クローン技術の実用化につながると期待できます。
原論文情報
Shogo Matoba, Huihan Wang, Lan Jiang, Falong Lu, Kumiko A. Iwabuchi, Xiaoji Wu, Kimiko Inoue, Lin Yang, William Press, Jeannie T. Lee, Atsuo Ogura, Li Shen and Yi Zhang, “Loss of H3K27me3 imprinting in somatic cell nuclear transfer embryos disrupts post-implantation development”, Cell Stem Cell
発表者
理化学研究所
バイオリソース研究センター 遺伝工学基盤技術室
専任研究員 的場 章悟(まとば しょうご)
専任研究員 井上 貴美子(いのうえ きみこ)
室長 小倉 淳郎(おぐら あつお)
(理化学研究所 開拓研究本部 小倉発生遺伝工学研究室 主任研究員)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- エピゲノム
- 染色体を構成するDNAやヒストンタンパク質は、メチル化、アセチル化などの後天的な化学修飾を受けている。この特定の細胞に固有なゲノム修飾状態全体を、エピゲノムと呼ぶ。
-
- ES細胞
- 脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。ES細胞は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。
-
- トランスクリプトーム・エピゲノム解析
- 細胞・組織サンプル内に存在する発現遺伝子(トランスクリプト)の全体像を次世代シーケンサーで解析したものをトランスクリプトームという。また、ここでいうエピゲノム解析は、ゲノム上に存在するエピゲノム修飾を次世代シーケンサーにより全ゲノムレベルで網羅的に解析することを指す。
-
- ヒストン修飾
- ヒストンタンパク質に付加される翻訳後修飾。メチル化、アセチル化、リン酸化、ユビキチン化などがある。
-
- インプリント遺伝子、インプリント情報、ゲノムインプリンティング
- 哺乳類のゲノムは父親と母親から半分ずつ染色体が引き継がれ、各染色体上に乗っている遺伝子を、父方遺伝子座・母方遺伝子座と呼ぶ。一般的に父方・母方遺伝子座にかかわらず遺伝子の発現制御は同じだが、一部の遺伝子は「ゲノム刷り込み(ゲノムインプリンティング)」を受けており、父方遺伝子座からのみもしくは母方遺伝子座からのみ発現する。これらの遺伝子は「インプリント遺伝子」と呼ばれ、このようなインプリント遺伝子の片親性の発現を制御するのが各遺伝子座に存在するエピゲノム修飾である「インプリント情報」である。
-
- Xist遺伝子
- X染色体上の遺伝子の一つ。その転写産物であるRNAが同X染色体を被覆し、クロマチン構造の抑制性変化が誘導される。最終的にX染色体上のほとんどの遺伝子発現が抑制されることにより、X染色体不活化が完成する。
-
- siRNA
- RNA干渉を引き起こす21から23塩基配列の短いRNA鎖。siRNAはshort interfering RNAの略。
-
- クロマチン免疫沈降-シークエンシング法(ChIP-seq)
- ゲノムへのタンパク質結合を調べるクロマチン免疫沈降法と、次世代シーケンサーを組み合わせた網羅的解析方法。クロマチン免疫沈降で回収したDNA断片を、次世代シーケンサーを用いてゲノムワイドかつ網羅的に解析する。
-
- CRISPR/Cas9
- ゲノム編集技術の一つ。Single guide RNA(sgRNA)と呼ばれるゲノム上の目的配列に特異的に結合する短いRNAとそれを認識するDNA切断酵素Cas9を、細胞内に導入することで、目的のDNA配列に変異を引き起こす。DNA切断酵素活性を失ったcatalytic dead Cas9(dCas9)にエピゲノム修飾変換酵素を結合させることで、ゲノムの特定の領域でエピゲノム編集が可能である。
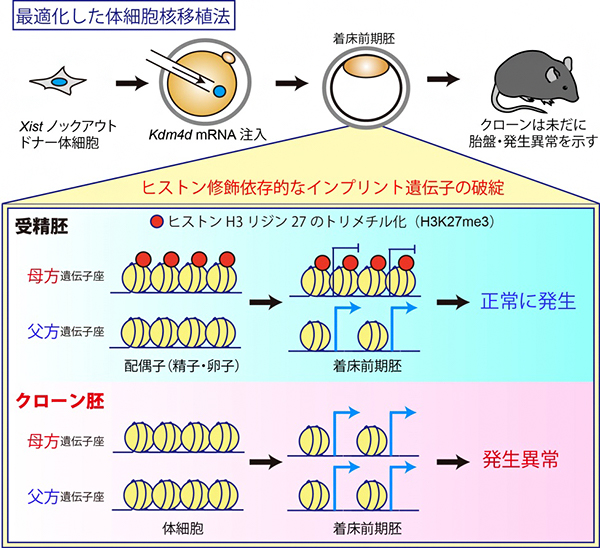
図1 最適化したクローン胚でもヒストン修飾依存的なインプリント遺伝子が破綻
マウスの受精胚では、ヒストン修飾(H3K27me3)依存的なインプリント遺伝子群の母方遺伝子座に、抑制性のヒストン修飾であるH3K27me3が存在するため、父方遺伝子座からのみ発現する。しかし、クローン胚では、これらの遺伝子群が全て母方遺伝子座にあるはずのH3K27me3修飾を失って、両遺伝子座から発現していることが明らかになった。