2018-07-26 理化学研究所
理化学研究所(理研)生命機能科学研究センター 一細胞質量分析研究チームの川井隆之研究員、集積バイオデバイス研究ユニットの太田亘俊研究員、田中陽ユニットリーダーらの共同研究チームは、わずか100細胞程度の超微量試料からN結合型糖鎖[1]を超高感度でプロファイリングできる「超微量糖鎖分析法」を開発しました。
本研究成果は、これまで検出が難しかった微量血中糖鎖を用いた次世代がん診断や、細胞数の少ない初期がんや難治性がんなどを対象とした創薬に貢献すると期待できます。
今回、共同研究チームは、高感度な糖鎖分析法として知られる「キャピラリー電気泳動[2]-レーザー励起蛍光[3](CE-LIF)分析法」において、糖鎖を2,000倍以上濃縮できる「新しい濃縮法(LDIS法[4])」を開発し、検出下限濃度350fmol/L(フェムトモーラー、1,000兆分の1モル濃度)という超高感度を実現しました。これは、東京ドーム3杯分の水に対して角砂糖1個分に相当します。LDIS法は、これまでの濃縮法では排除できなかった、不純物による悪影響をほとんど受けない優れた特性があります。これにより、100細胞という超微量の細胞から抽出された糖鎖をほとんどロスすることなく、濃縮・分離・検出することに成功しました。
本研究は、国際科学雑誌『Journal of Chromatography A』オンライン版(6月23日)に掲載されました。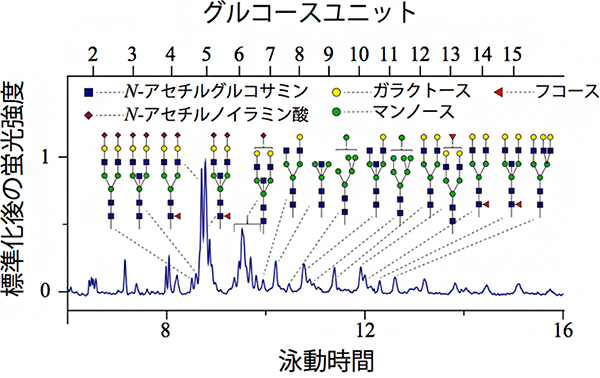
※共同研究チーム
理化学研究所 生命機能科学研究センター
一細胞質量分析研究チーム
研究員 川井 隆之(かわい たかゆき)
研究パートタイマーⅡ 今里 亜貴子(いまさ とあきこ)
研究パートタイマーⅡ 白﨑 葉子(しらさき ようこ)
集積バイオデバイス研究ユニット
研究員 太田 亘俊(おおた のぶとし)
ユニットリーダー 田中 陽(たなか よう)
※研究支援
本研究は、日本医療研究開発機構(AMED)糖鎖利用による革新的創薬技術開発事業「超高効率濃縮法に基づくCE-LIF-MS微量糖鎖分析システムの開発 (研究代表者: 川井隆之)」および科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「超高感度CE-MS分析システムによる極微量プロテオーム解析 (研究代表者: 川井隆之)」などによる支援を受けて行われました。
背景
糖鎖とは、単糖[5]であるマンノースやシアル酸などが数個以上、枝分かれしながら結合した物質です。タンパク質を構成するアミノ酸の一つアスパラギンに結合する糖鎖はN結合型糖鎖と呼ばれ、細胞ががん化するなど病変する際には、この糖鎖の構造が変化することが知られています。このような疾患特異的に変異する糖鎖を標的とした医薬品を開発できれば、これまでよりも副作用が少なく効果の高い画期的な治療を実現できると期待されています。
病変細胞を採取して解析する場合、まず組織切片を染色して顕微鏡で観察しながら病変細胞を切り取りますが、多くの場合1,000細胞未満のわずかな量しか得ることができません。高感度なN結合型糖鎖分析法として知られる「キャピラリー電気泳動-レーザー励起蛍光(CE-LIF)分析法」であっても、最低でも10,000細胞以上の試料が必要であり、病変細胞のみを糖鎖分析にかけることはできませんでした。
研究手法と成果
共同研究チームは、高感度なCE-LIF分析法をさらに大幅に高感度化するため、キャピラリー内部で糖鎖を効率的に濃縮する手法の開発を行いました。これまでにもさまざまな濃縮法が開発され、感度だけであれば10万倍もの濃縮が実現された例もありました。しかし、生体試料に含まれるさまざまな夾雑(きょうざつ)物質の影響を受けずに、微量の細胞から生じる貴重な糖鎖を余すことなく濃縮し、分離・検出できる手法は全く存在しませんでした。
そこで今回、試料をロスすることなく、効率的に濃縮と分離を行えるLVSS法[6]と、夾雑物質に強い過渡的等速電気泳動(tITP)法[7]を組み合わせ、新たな濃縮法である「LDIS法」を開発しました。LDIS法では、キャピラリーに注入された大量の糖鎖溶液は、まずLVSS法の原理によって濃縮された後、tITP法の原理に従って再度濃縮されます。その後、CE-LIF分析法により、サイズが小さい糖鎖の順番に分離・検出されます(図1)。
開発したLDIS法の性能を検証するため、まず糖鎖を8-アミノピレン-1,3,6-トリスルフォン酸(APTS)と呼ばれる蛍光色素で標識しました。APTSで標識することで、通常の方法では分離も検出もできない糖鎖を、サイズの小さい順にキャピラリー電気泳動(CE)で分離してレーザー励起蛍光(LIF)検出することができます。
糖鎖標準品であるグルコースオリゴマー(ブドウ糖が1~15個程度ランダムにつながった糖鎖、G1~G15)を、①濃縮なし、②従来のLVSS法による濃縮、③LDIS法による濃縮の条件で、それぞれCE-LIFを行い比較したところ、濃縮なしと比較してLDIS法による濃縮では約2,300倍もの高感度化を達成しました(図2)。このとき検出できる最小濃度は、わずか350fmol/Lでした。これは、30億リットル(東京ドーム3杯分)の水に、角砂糖1個程度(3g)を溶かした超希薄濃度の糖鎖を検出できる性能です。また、糖鎖と関係のない夾雑物質濃度が10mmol/L(1リットルに角砂糖1個程度)という汚い試料であっても、分析性能の低下はありませんでした。
次に、このLDIS法を使って、実際に100細胞程度の試料を測定できるか検証しました。まず、さまざまな濃度のHeLa細胞(子宮頸がん由来)の溶解液(試験管あたり100個から100,000個)からペプチド-N-グルコシダーゼFという酵素を用いて糖鎖を切り出し、蛍光色素APTSで標識して分析を行ったところ、細胞の量にかかわらず同様のピークパターンが得られることが分かりました(図3)。これは、どんな構造の糖鎖がそれぞれどれくらいの量含まれるかを調べるプロファイリング解析において、微量の細胞であっても分析信頼性が失われていないことを示しています。
最後に、複数種類の細胞株に対して、約100細胞程度の試料から糖鎖プロファイリングを行いました。肝臓がん由来のHepG2細胞、乳がん由来のMCF7細胞、子宮頸がん由来のHeLa細胞をそれぞれ解析したところ、特にHepG2細胞において著しく異なるプロファイルが得られました。各ピークの検出時間からグルコースユニット[8]と呼ばれる値を算出してデータベースと照合することで、各ピークの糖鎖構造を推定したところ、HepG2ではN-アセチルノイラミン酸[9]などシアル酸の多い糖鎖プロファイルが得られていることが分かりました(図4)。
今後の期待
今回、100細胞という微量糖鎖であっても、十分な感度と信頼性でN結合型糖鎖のプロファイリングが可能であることが実証されました。今後、実際の病理切片や血液試料などからの疾患特異的な糖鎖バイオマーカーの検出に応用することで、新たながん診断法や新治療薬の開発につながると期待できます。
また、今回開発したLDIS法は、糖鎖のみならず他のさまざまな生体関連物質を効率的に濃縮できる手法です。特に組織微小領域や、一細胞レベルでの代謝物解析・タンパク質解析などに適用することで、新たな生命現象の解明、疾患メカニズムの解明など、医療・創薬への貢献が期待できます。
原論文情報
Takayuki Kawai, Nobutoshi Ota, Akiko Imasato, Yoko Shirasaki, Koji Otsuka, Yo Tanaka, “Profiling of N-linked glycans from 100 cells by capillary electrophoresis with large-volume dual preconcentration by isotachophoresis and stacking”, Journal of Chromatography A, 10.1016/j.chroma.2018.06.034
発表者
理化学研究所
生命機能科学研究センター 一細胞質量分析研究チーム
研究員 川井 隆之(かわい たかゆき)
生命機能科学研究センター 集積バイオデバイス研究ユニット
研究員 太田 亘俊(おおた のぶとし)
ユニットリーダー 田中 陽(たなか よう)
お問い合わせ先
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- N結合型糖鎖
- 糖鎖は、グルコース(ブドウ糖)などの糖が鎖状につながった物質の総称。N結合型糖鎖は、タンパク質のアスパラギン側鎖のアミド窒素に結合している糖鎖。細胞内では、タンパク質のフォールディング(ポリペプチドの折り畳みによる高次構造の構築)や細胞内での輸送を制御することが分かっている。一方、細胞外では、タンパク質の血中内安定性、タンパク質/タンパク質相互作用、免疫調節、細胞増殖、がんの浸潤など多くの生物学的現象に重要な役割を果たしていると考えられている。
-
- キャピラリー電気泳動(CE)
- 内径数十μm,外径数百μm,全長数十cm程度の石英ガラス細管に、数万ボルト程度の高電圧をかけることで、電荷を持った分子を分離する手法。分離分析法として有名な液体クロマトグラフィー法と比べて高い分離性能、少ない試料消費量などの利点がある。CEはcapillary electrophoresisの略。
-
- レーザー励起蛍光(LIF)
- キャピラリー内部へレーザーを照射し、蛍光性物質を高感度に検出する手法。ナノmol/Lオーダーの極めて高い感度を実現できる。LIFはLaser Induced Fluorescenceの略。
-
- LDIS法
- 高感度な糖鎖分析法として知られるキャピラリー電気泳動-レーザー励起蛍光(CE-LIF)分析法において、糖鎖を2,000倍以上濃縮できる新しい濃縮法。LDISはlarge-volume dual preconcentration by isotachophoresis and stackingの略。
-
- 単糖
- 最も単純な糖。五炭糖のリボースや、六炭糖のグルコース、マンノース、九炭糖のシアル酸などがある。
-
- LVSS法
- 夾雑物の少ない、電気伝導度の低い試料をキャピラリーに大量に導入し、濃縮する手法。電気伝導度の差によって形成される電場強度の勾配によって、試料は濃縮される。簡単な操作で、試料をほとんどロスすることなく分析できるが、夾雑成分が多くなると試料を濃縮できなくなる。LVSSはlarge-volume sample stackingの略。
-
- 過渡的等速電気泳動(tITP)法
- 試料の前に、泳動速度の速いイオンを配置することで、それより遅いイオンを後ろに集めて濃縮する手法。夾雑成分には強いが、大量の試料を濃縮すると試料をほとんど分離できなくなる。tITP はtransient isotachophoresisの略。
-
- グルコースユニット
- 各ピークの検出時間とグルコースオリゴマーの検出時間とを、比較することで得られる値。糖鎖の構造によって固有の値であるため、データベースと照合することで構造を推定することが可能である。
-
- N-アセチルノイラミン酸
- シアル酸と呼ばれるカルボキシル基を持つ酸性糖の一種。悪性がんではシアル酸を多く含む糖鎖が増加することが知られており、がん診断や創薬に重要な要素だと考えられている。

図1 新たな濃縮法「LDIS法」とそれに続くCE-LIF分析法の原理
本研究では、内径50マイクロメートル(μm、1μmは100万分の1メートル)のキャピラリーを用いて一連の濃縮、分離、検出を行った。1.でキャピラリーに注入された試料は、2.のLVSS法、3.の過渡的等速電気泳動(tITP)法の二段階濃縮を経て、4.のキャピラリー電気泳動(CE)-レーザー励起蛍光(LIF)分析法で糖鎖分析される。+は陽極、-は陰極を示す。4.の緑色の矢頭は、レーザー励起蛍光分析を行う窓を示す。
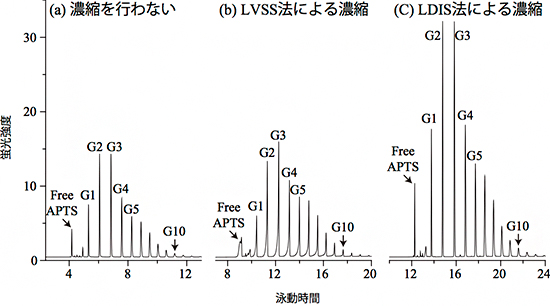
図2 LDIS法と従来法を用いた糖鎖標準品(グルコースオリゴマー)の分析の比較
糖鎖標準品(G1~G15)に還元的アミノ化という化学反応を用いて、蛍光色素(APTS)を結合させて分析を行った。サイズの小さい糖鎖の順にキャピラリー電気泳動(CE)で分離して、レーザー励起蛍光(LIF)検出を行った。
(a) 濃縮を行わない通常のCE-LIF分析(試料濃度は40ppm)。
(b) 従来のLVSS法による濃縮後、CE-LIF分析を行った結果。濃度比は(a)の500倍のため、図では500倍濃縮を示す。ピークは広がり、夾雑(きょうざつ)物質にも弱い。最大1,000倍まで濃縮できた。
(c) 本研究で開発したLDIS法による濃縮後、CE-LIF分析を行った分析。濃度比は(a)の500倍のため、図では1,000倍濃縮を示す。ピークは極めてシャープで夾雑物にも強く、最大2,300倍まで濃縮できた。

図3 さまざまな濃度のHeLa細胞から得られた糖鎖プロファイリング結果
試験管あたり100~100,000個のHeLa細胞からの溶解液を用い、LDIS法による糖鎖プロファイリングを行った。1,000倍の濃度の差があっても、安定したプロファイルが得られた。グルコースユニットは、糖鎖の構造による固有の値で、データベースと照合することで構造を推定できる。

図4 複数種類の細胞株に対する100細胞糖鎖プロファイリング解析例
肝臓がん由来のHepG2細胞、乳がん由来のMCF7細胞、子宮頸がん由来のHeLa細胞のそれぞれ100個程度の試料から、LDIS法による糖鎖プロファイリングを行った。HepG2細胞では、N-アセチルノイラミン酸(赤菱形)を含むなどシアル酸の多いプロファイルが得られた。