2018-07-26 理化学研究所,神戸大学
理化学研究所(理研)生命機能科学研究センター呼吸器形成研究チームの森本充チームリーダー、岸本圭史研究員、バイオリソース研究センターの田村勝チームリーダー、神戸大学大学院医学研究科の南康博教授、西田満准教授らの共同研究チーム※は、気管[1]など管状の臓器(管腔臓器)が正しい形へと発生する仕組みをマウスで明らかにしました。
本研究成果は臓器形成の基本原理を説明するとともに、再生臓器の成形技術への応用や、先天性気管狭窄症[2]などの病態の理解にもつながると期待できます。
気管、食道、腸などの“管”の長さ、太さ(径)、配置は、精密に制御されており、何らかの理由で変形してしまうと正常な機能が果たせなくなります。しかし、これらの太く長い管が作られるメカニズムは分かっていませんでした。
今回、共同研究チームは、発生過程のマウスを用いて、気管の長さと太さを決める仕組みを調べました。その結果、気管は初めに長さ方向に伸長し、続いて径が拡大することが分かりました。また、遺伝子の機能解析から、①Wnt5a[3]-Ror2[4]シグナルにより、細胞極性[5]が同調した気管平滑筋[6]のもとになる細胞が円周方向に整列して連結され、気管上皮[7]の長軸方向の伸長を促していること、②Sox9[8]遺伝子が気管軟骨組織の分化・成長を促して径の調節をしていることが分かりました。平滑筋や軟骨は間充織[9]に由来する組織であり、間充織細胞の極性、分化が管構造の形成に重要な役割を担うことが明らかになりました。
本研究成果は英国のオンライン科学雑誌『Nature Communications』(7月19日付)に掲載されました。
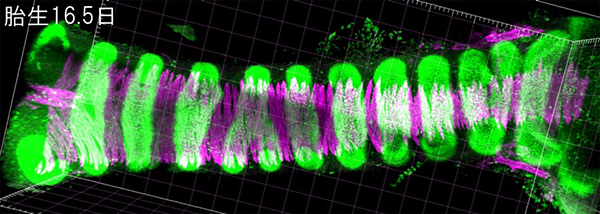
図 マウス気管の管腔構造(周縁をパターン化された平滑筋(マゼンタ)と軟骨(緑)が覆う)
※共同研究チーム
理化学研究所
生命機能科学研究センター 呼吸器形成研究チーム
チームリーダー 森本 充(もりもと みつる)
(旧 多細胞システム形成研究センター 呼吸器形成研究チーム チームリーダー)
研究員 岸本 圭史(きしもと けいし)
テクニカルスタッフII 山岡 玲(やまおか あきら)
生命機能科学研究センター 生体モデル開発ユニット・生体ゲノム工学研究チーム
研究員 阿部 高也(あべ たかや)
(旧 ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 生命動態情報研究グループ 生体モデル開発ユニット・生体ゲノム工学研究チーム研究員)
テクニカルスタッフII 繁田 麻葉(しげた まよ)
バイオリソース研究センター マウス表現型解析開発チーム
チームリーダー 田村 勝(たむら まさる)
神戸大学大学院
医学研究科 生理学・細胞生物学講座 細胞生理学分野
教授 南 康博(みなみ やすひろ)
准教授 西田 満(にした みちる)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究A「気道上皮の多分化能細胞と組織構造の解析(研究代表者:森本充)」等の支援を受けて行われました。
背景
多細胞生物の生命機能を支える器官の基本形は、細胞が作る筒の内部に空間が備わった管腔構造であり、管腔のサイズと形態が臓器の機能と密接に関わっています。例えば、血管は全身に血液を届ける輸送路、消化器は食べ物を処理する作業ライン、気管支は呼吸の効率を決める吸排気装置としてそれぞれ働いています。管腔形成のメカニズムを包括的に理解することは、生体の生理と病理の根本的理解につながります。しかし、これまで、哺乳動物の管腔形成に関する研究は、毛細血管、唾液腺、乳腺などの細い管腔が中心であり、臓器のような大型の管腔構造の全体像を1細胞レベルから体系的に理解する研究は全く行われてきませんでした。
気管は空気を肺に導く通り道であり、ヒト(成人)ではおよそ長さ13cm、直径2cmの内腔を持つ大型管腔へ成長します。管腔の形状が呼吸効率に直接影響することが知られており、主に内腔を覆う「上皮組織」とそれを支える馬蹄型の「軟骨組織」、管径を収縮させる「平滑筋組織」により構造が保たれています(図1)。気管は腸管などの管腔と比べ、ひだがなく、シンプルな直管構造をしています。共同研究チームは、気管が大型管腔の研究モデルに適していると考え、マウスの発生過程での気管形成を詳しく調べました。
研究手法と成果
共同研究チームは気管の形成過程を統合的に理解するため、まず、一つ一つの細胞形態を検出する解像度で、マウス胎児の気管が成長するプロセスを包括的に定量解析しました。その結果、気管は前期(胎生10.5日~14.5日)と後期(胎生14.5日~18.5日)で、異なる様式で成長していることが分かりました。すなわち、初めに長さ方向に伸長し、追いかけるように直径が拡大するという段階的な発生過程で管腔が作られていたのです(図2)。
続いて、マイクロCT[10]と呼ばれる超高感度の3次元定量測定装置で検査したところ、やはり発生後期で大きく内腔が広がっていることが示されました。個々の細胞の形態と増殖を調べてみると、後期における内腔拡大は上皮細胞の形態変化、配列再編成が主な要因であり、細胞増殖の貢献は小さいことが分かりました(図3)。
ここまでの解析結果から、共同研究チームは前期の気管伸長のメカニズムと、後期の気管拡大、上皮細胞再編成のメカニズムの解明に焦点を当てることにしました。
まず、気管形成前期の気管伸長のメカニズムを解明するため、気管形成の異常が報告されている遺伝子変異マウスを探したところ、分泌タンパク質であるWnt5aとその受容体であるRor2の変異マウスでは、気管が短いことを発見しました(図4左)。そこで、気管の発生過程におけるWnt5aおよびRor2の遺伝子発現パターンを調べたところ、いずれも上皮組織ではなく「間充織」、特に平滑筋細胞とその前駆細胞に発現することが分かりました。さらに、平滑筋の組織構造を解析したところ、正常であれば円周方向に秩序正しく配列する平滑筋細胞が、遺伝子変異マウスでは無秩序に配置されて収縮運動ができないことが分かりました(図4右)。
次に、変異マウスで見られた平滑筋の異常が平滑筋細胞のどのような性質に由来するかを詳しく解析したところ、正常な平滑筋の前駆細胞は、初めはばらばらだった細胞極性がやがて同調し、上皮(内腔側)に向かって整列することを突き止めました(図5b)。一方、Wnt5aまたはRor2遺伝子の変異マウスでは平滑筋細胞の極性化が起きず、整列は見られなくなりました(図5c)。
気管の内腔に向かってそろった細胞極性は今回新たに発見されたため、共同研究チームはこの同調極性パターンを「放射状細胞極性(Radial cell polarity)」と名付けました。さらに、放射状細胞極性の役割は細胞を整列させるだけではなく、平滑筋前駆細胞を上皮直下まで移動させることと、細胞同士が円周方向に連結するために必要であることも判明しました。これらの結果は、間充織細胞が秩序をもって集合、整列することで気管が延びることを示します。
さらに、マウスの食道の発生過程についても同様に解析し、やはり放射状細胞極性によって食道の長さが制御されていることが分かりました。すなわち、間充織の細胞極性の同調化という共通のメカニズムを介して、気管と食道が伸長していることが示されました。
なお、平滑筋細胞の極性を制御することによって気管の長さが調節されるメカニズムは、森本チームリーダーと岸本研究員も参加した、マックスプランク研究所(ドイツ)ディディエ・ステイナー教授らによるマウスの遺伝学的解析によっても示され、この成果は『Nature Communications』誌で同時に報告されました注1)。
注1) The potassium channel KCNJ13 is essential for smooth muscle cytoskeletal organization during mouse tracheal tubulogenesis, Wenguang Yin, Hyun-Taek Kim, Sheng Peng Wang, Felix Gunawan, Lei Wang, Keishi Kishimoto, Hua Zhong, Dany Roman, Jens Preussner, Stefan Guenther, Viola Graef, Carmen Buettner, Beate Grohmann, Mario Looso, Mitsuru Morimoto, Graeme Mardon, Stefan Offermanns, and Didier Stainier, Nature Communications, 2018 Jul 19;9(1):2815
最後に、後期過程に起こる管腔直径の拡大メカニズムの解明に取り組みました。ヒトの疾患では、気管軟骨の異常により気道が狭窄することが知られていたため、軟骨の形成に関わるSox9およびCollagen 2a1[11]遺伝子を欠損した変異マウスを作製しました。これらの変異マウスではリング状の気管軟骨が形成されず、気管の長さには異常は見られない一方、径は著しく細くなりました(図6)。この結果は、予想通り、気管軟骨の発生が気管直径の拡大を促していることを示しています。さらに、これらの変異マウスでは、発生後期の気管内腔の拡大時に起こる上皮組織の再編成(図3d)が起こらなくなっていたことから、軟骨形成が直径の拡大のみならず、内腔面の正常な拡大にも重要な役割を担っていることが明らかになりました。
以上の結果から、気管を構成する2種類の間充織の細胞 (平滑筋前駆細胞と軟骨細胞)がタイミングをずらして極性化と分化を起こすことで、臓器の形が決定されることが初めて示されました。初期には、Wnt5a-Ror2 シグナルが平滑筋前駆細胞の極性化を介して平滑筋の形態を正常に配向することで、気管伸長を誘導し、後期では、軟骨組織の分化・成長が径の拡大および平滑な内腔面の拡大を調節していることが分かりました。
今後の期待
従来の管腔組織の研究では、上皮組織の振る舞いによる形態制御に焦点が当てられてきましたが、本研究により間充織細胞の極性、分化が大型管腔組織の形態に重要な役割を担っていることが明らかになりました。間充織細胞による管腔組織の形態制御は、臓器形成の基本原理を説明する新たな視点を提供すると期待できます。
また、臓器形成過程の体系的な理解は病態の解明や臓器の再建にも必須であり、本研究で得られた知見は先天性気管狭窄症をはじめとした管腔臓器の閉塞をきたす病態の理解や、将来的には再生臓器の成型技術としての応用が期待できます。
原論文情報
Keishi Kishimoto, Masaru Tamura, Michiru Nishita, Yasuhiro Minami, Akira Yamaoka, Takaya Abe, Mayo Shigeta and Mitsuru Morimoto, “Synchronized mesenchymal cell polarization and differentiation shape the formation of the murine trachea and esophagus”, Nature Communications, 10.1038/s41467-018-05189-2
発表者
理化学研究所
生命機能科学研究センター 呼吸器形成研究チーム
チームリーダー 森本 充(もりもと みつる)
研究員 岸本 圭史(きしもと けいし)
バイオリソース研究センター マウス表現型解析開発チーム
チームリーダー 田村 勝(たむら まさる)
神戸大学大学院
医学研究科 生理学・細胞生物学講座 細胞生理学分野
教授 南 康博(みなみ やすひろ)
准教授 西田 満(にした みちる)
お問い合わせ先
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
報道担当
理化学研究所 広報室 報道担当
神戸大学 総務部広報課
補足説明
-
- 気管
- 脊椎動物では食道の腹側に位置し、空気の通り道となる1本の管状の呼吸器官を指す。上部は喉頭に接続し、下部は分岐して左右の肺に接続する。
-
- 先天性気管狭窄症
- 生まれつき気管が細くなる疾患。新生児期に症状が現れることが多く、主な症状は呼吸困難。気管軟骨の形成異常が原因の一つと考えられている。
-
- Wnt5a
- 分泌型の糖タンパク質であるWnt familyの一つ。一般的(古典的)なWntはβ-カテニンを介してシグナルを制御するが、Wnt5aはβ-カテニンを介さず、PCP経路やCa経路などの非古典的な経路を介して、細胞の移動、極性といった多様な細胞の機能を調節する。
-
- Ror2
- 膜貫通受容体型のチロシンリン酸化酵素。Wnt5aの受容体の一つとして知られている。Ror2は、Receptor tyrosine kinase-like orphan receptor2の略。
-
- 細胞極性
- 細胞に対して、相対的な方向性や同調性を与える初めのプロセス。極性が破綻すると、神経管閉鎖や左右非対称性といった秩序だった細胞の挙動が要求される発生のイベントに重篤な異常が生じることが知られている。
-
- 気管平滑筋
- 気管の内腔を取り囲み、弛緩・収縮することにより、気管径を変化させる筋組織。
-
- 上皮
- 隙間なく敷き詰められた細胞が作るシート状の構造。体表や管腔の表面を覆って、さまざまな生理的機能を果たす。
-
- Sox9
- 軟骨細胞分化のマスターレギュレーター遺伝子。軟骨細胞への分化に必須な遺伝子群の発現を上昇させる転写因子をコードする。Sox9は、SRY-box9の略。
-
- 間充織
- 中胚葉に由来する未熟な結合組織。器官形成では上皮組織と接していることが多い。
-
- マイクロCT
- 高感度・高解像度で対象の内部構造を三次元画像で観察するX線CTの一種。
-
- Collagen 2a1
- 軟骨組織に発現するコラーゲンの一つ。軟骨組織に硬度を与える。
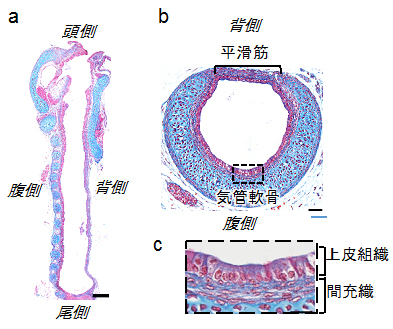
図1 マウス気管の構造(胎生18.5日)
組織切片のアザン染色像。マウス気管の矢状面(a)、横断面(b)および(b)の点線部分の拡大図(c)。赤が細胞核、青が膠原繊維(ここでは気管軟骨)を示す。スケールバーは、(a)200マイクロメートル(μm、1μmは1,000分の1mm)と(b)50μm。
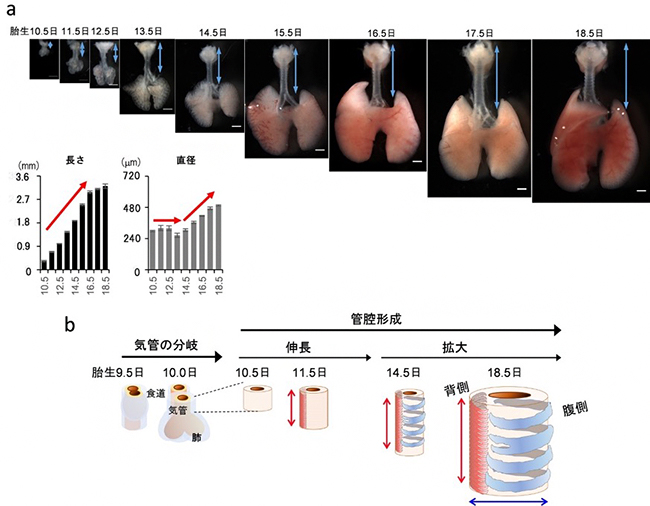
図2 マウス胎児における段階的に進行する気管発生
(a)胎生期におけるマウス呼吸器の発生様式。スケールバーは500μm。
(b)気管と食道は、胎生9.5日目から発生が始まる。14.5日目までは径を変えず伸長し、14.5日目以降、径の拡大を開始する。気管平滑筋(赤)は11.5日の背側に出現し、気管軟骨(青)は14.5日目にリング状の繰り返し構造を作る。
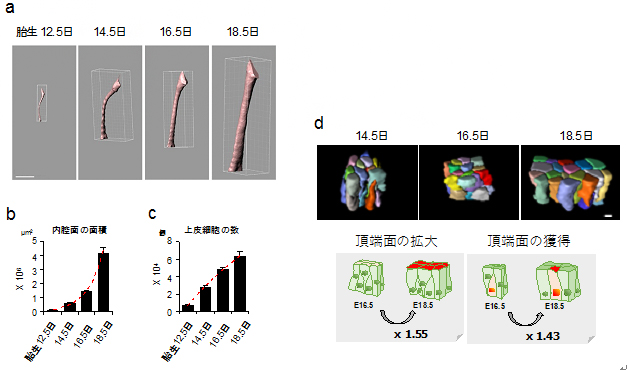
図3 マウス胎児における気管内腔面の拡大様式
(a)マイクロCTによって撮影した気管画像をPC上で3次元再構築した。スケールバーは500μm
(b)気管内腔面の面積の定量。胎生16.5日から18.5日にかけて、内腔面積は2.87倍に増加した。
(c)気管内腔を覆う上皮細胞の数の定量結果。胎生16.5日から18.5日にかけて1.31倍しか増加しておらず、内腔面積の増加率に比べて低い。スケールバーは5μm
(d)上皮細胞の3次元再構築図。後期過程では頂端面(内腔に接している面)の拡大と獲得が起こる。
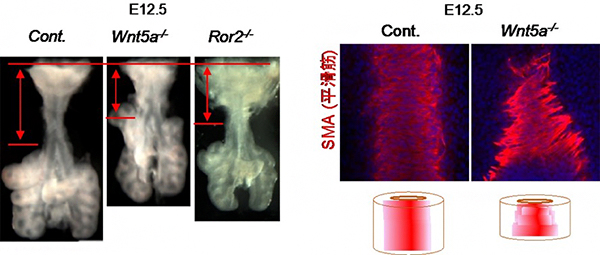
図4 Wnt5aおよびRor2遺伝子変異マウスの気管形態異常
(左) Wnt5aおよびRor2遺伝子変異マウスの胎生12.5日目の気管の形態。それぞれの遺伝子欠損マウスでは、正常マウス(Cont.)と比較して気管の長さが短い。赤の矢印は、気管の長さを示す。
(右) Wnt5a遺伝子変異マウスの胎生12.5日目の気管平滑筋形態。背側から見た蛍光顕微鏡像(上)と気管全体の模式図(下)。正常マウス(Cont.)では、平滑筋は円周方向に整然と配列するのに対して、Wnt5a遺伝子欠損マウスでは平滑筋の配向が乱れる。赤色は平滑筋のアクチン繊維を示し、青色は細胞核を示す。
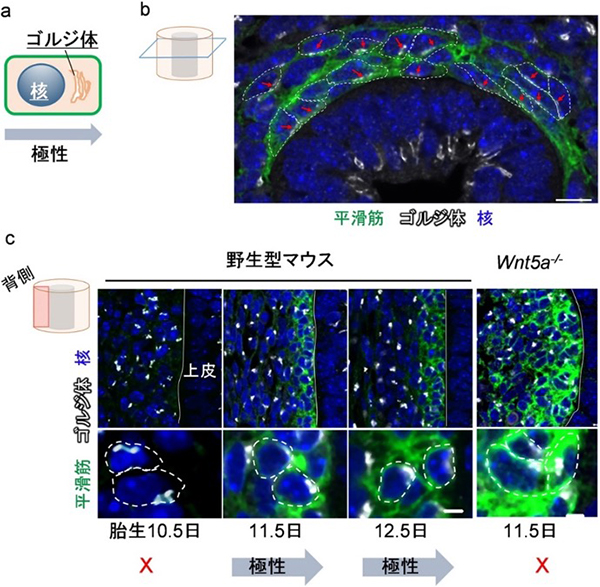
図5 平滑筋細胞の放射状細胞極性とWnt5a遺伝子変異マウスにおける極性異常
(a)ゴルジ体は極性化方向に局在することが知られているため、ゴルジ体の位置を指標に細胞極性を評価した。
(b)胎生12.5日のマウス気管横断面。平滑筋細胞(緑)において、ゴルジ体(白)の局在が上皮組織側(写真下側)に整列する。このときの細胞極性(赤矢印)は気管の内腔側に向かって同調しており、共同研究チームは、この同調極性パターンを「放射状細胞極性(Radial cell polarity)」と名付けた。スケールバーは10μm。
(c)胎生11.5日目以降、平滑筋細胞(緑)において、ゴルジ体(白)は上皮組織方向(写真右側)に極性化する。極性化はWnt5a遺伝子変異により阻害されることが分かる。スケールバーは3μm。
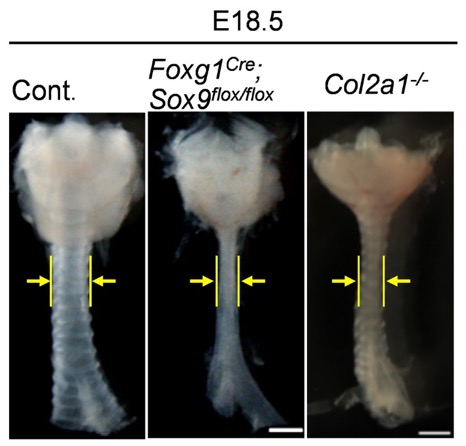
図6 組織特異的Sox9遺伝子変異マウスとCollagen 2a1遺伝子変異マウスの気管狭窄形態
胎生18.5日目における組織特異的Sox9遺伝子変異マウスおよびCollagen 2a1遺伝子変異マウスの気管形態を示す。Sox9遺伝子変異マウスでは気管間充織細胞から軟骨細胞への分化が見られず、Collagen 2a1遺伝子変異マウスでは、軟骨細胞は分化しても気管軟骨の形成が阻害される。それぞれの変異マウスでは、正常マウス(Cont.)と比較して気管が細い。黄色の矢印は、気管の太さを示す。スケールバーは500μm。