2023-12-18 東京大学
発表のポイント
- 病原体が分泌する病原性因子には、特定のタンパク質に結合して分解する働きを持つものが数多くあります。その場合、「病原性因子が結合するタンパク質は分解の標的である」と考えるのが一般的でした。
- 今回、ファイトプラズマの分泌する病原性因子「ファイロジェン」が、植物タンパク質と結合するにも関わらず分解しない場合があることを発見し、その標的選択性が分解装置への輸送の可否により決まることを明らかにしました。
- ファイロジェンと結合しても分解されない植物タンパク質は、ファイロジェンの働きを阻害する治療薬として逆利用できる可能性があり、葉化病の予防・治療につながることが期待されます。

ファイトプラズマは植物のMADS転写因子を分解することで葉化病を引き起こす
発表内容
研究成果概要
東京大学大学院農学生命科学研究科の鈴木誠人大学院生と前島健作准教授らの研究グループは、植物の花を葉に変える細菌タンパク質「ファイロジェン」が宿主タンパク質を選択的に分解する新しい分子メカニズムを明らかにしました。
研究の背景
カビ・細菌・ウイルスなどの病原微生物は、ヒトや家畜、農作物に感染して多くの被害を引き起こします。病原微生物は、感染対象である生物(宿主)の細胞に多種多様な病原性タンパク質を分泌し、免疫反応を抑制するなど、宿主の細胞を自身の生存に有利な状態へと変化させます。分子レベルで見ると、病原性タンパク質は特定の宿主タンパク質に結合して、分解したり構造を変化させたりすることにより、その機能を巧みに操作しています。病原性タンパク質が宿主タンパク質の機能を操作する仕組みの解明は、微生物の感染メカニズムの理解と病気の予防・治療方法の開発のために極めて重要な研究領域となっています。
植物病原細菌ファイトプラズマ(注1)は感染植物に様々な病気を引き起こしますが、中でも特徴的なのは、花を葉や茎に変化させ、子孫を残せなくする「葉化病」です(図1)。作物は葉化病になると果実や種子が実らず収穫できなくなります。例えば、油糧作物として重要なゴマでは、葉化病により80-100%もの収穫量低下が引き起こされます。アジアやアフリカの主要なゴマ生産国で蔓延しており、現地農家の生活を脅かすのみならず、国内需要の99.9%以上をこれらの国々からの輸入に依存している日本にとっても深刻な問題となっています。このように、葉化病は農作物の収穫量を著しく低下させ、大きな経済的損失を引き起こすため、予防・治療方法の確立が求められています。

図1. 葉化病により実をつけなくなったソバの花(右)
葉化病の原因となる病原性タンパク質「ファイロジェン(注2)」は、花の形成に必要な宿主タンパク質(MADS転写因子;注3)に結合します。続いて、タンパク質を分解装置へと運ぶタンパク質(シャトル因子;注4)にも結合し、MADS転写因子の分解を引き起こします(図2上段)。ファイロジェンによるMADS転写因子の分解が起きることで植物は花を形成できなくなり、葉化病が引き起こされます。これまでの研究では、ファイロジェンのMADS転写因子への結合性と分解活性は相関することから、ファイロジェンが結合したMADS転写因子は全て分解されてしまうと考えられていました。
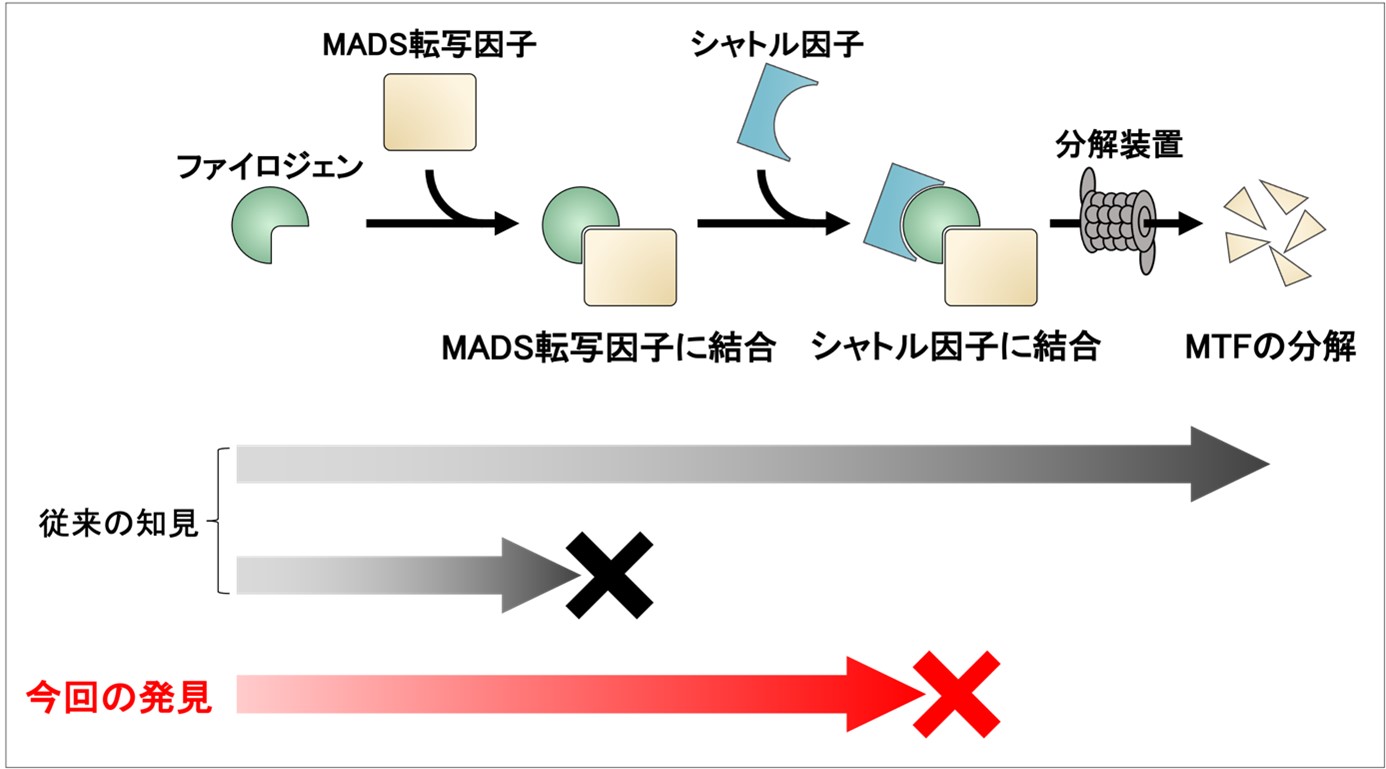
図2. ファイロジェンの分解標的の選択性メカニズム
ファイロジェンは、分解標的とするMADS転写因子に結合し、続いてシャトル因子とも結合することで、MADS転写因子の分解を引き起こす。一方で、ファイロジェンが結合しないMADS転写因子は分解標的とはならない。本研究では、ファイロジェンがMADS転写因子に結合してもシャトル因子とは結合しない場合には、MADS転写因子を分解できないことを明らかにした。以上のことから、ファイロジェンがMADS転写因子を分解するかどうかは、MADS転写因子自体との結合性、およびシャトル因子との結合性の2段階で決まることが示唆された。
研究内容
本研究では、イネに感染するファイトプラズマ(rice yellow dwarf phytoplasma;RYD)由来のファイロジェン(RYDファイロジェン)が、他のファイロジェンと比べて多数のアミノ酸変異を持つことに着目し、その機能を解析しました。RYDファイロジェンをモデル植物であるシロイヌナズナで発現させ、葉化を引き起こすか検証したところ、通常のファイロジェンが花を葉化させた一方、RYDファイロジェンは軽微な形態異常しか誘導しませんでした(図3)。そこで、RYDファイロジェンのMADS転写因子に対する分解活性を調べたところ、分解可能なMADS転写因子の種類が通常のファイロジェンよりも少ないことが明らかになり、これが葉化誘導活性の違いをもたらしていると考えられました。
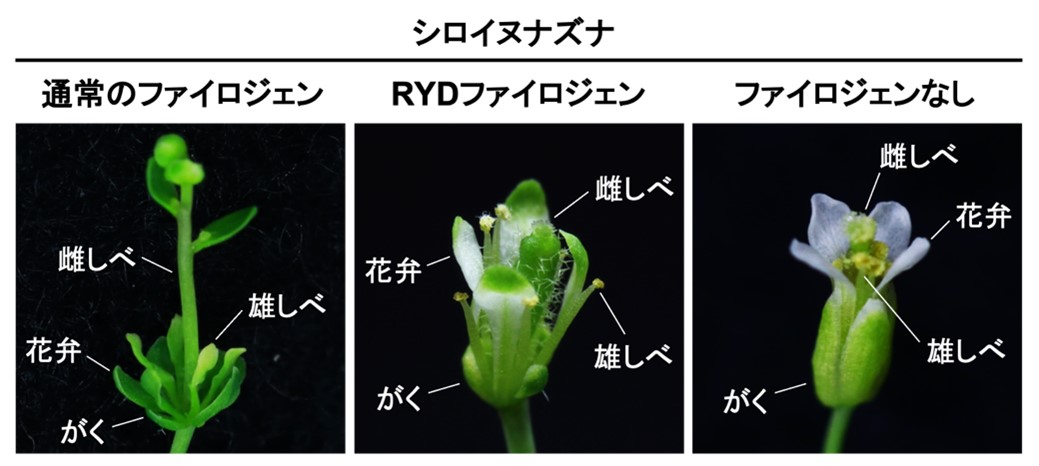
図3. RYDファイロジェンは葉化誘導活性が低下
通常のファイロジェンは、A、EクラスのMADS転写因子を分解することで、がく・花弁・雄しべの葉への変化と雌しべの茎への変化を引き起こす。一方、RYDファイロジェンは、EクラスMADS転写因子の一部を分解できず、主にがく・花弁に軽微な異常を引き起こすだけである。
続いて、なぜ一部のMADS転写因子がRYDファイロジェンによる分解の標的とならないのかを調べるため、RYDファイロジェンとMADS転写因子の結合性を検証しました。その結果、意外なことにRYDファイロジェンは分解されないMADS転写因子とも結合することがわかり、結合性と分解活性が必ずしも相関しないことが明らかになりました。そこで次に、MADS転写因子を分解装置へと運ぶ役割を持つシャトル因子との結合性を解析しました。その結果、RYDファイロジェンは分解可能なMADS転写因子と結合した際にはシャトル因子とも結合したのに対して、分解されないMADS転写因子と結合した際にはシャトル因子とは結合しませんでした(図2)。すなわち、ファイロジェンと結合しているMADS転写因子の種類に応じてシャトル因子との結合性が変化し、結果として一部のMADS転写因子は分解装置へと輸送されず、分解を受けないことが明らかになりました。 本研究により、ファイロジェンが分解標的とするMADS転写因子の選択性は、従来考えられてきた「ファイロジェンとMADS転写因子の結合性」に加えて、「両者が結合した後のシャトル因子との結合性」という2段階で制御されていることが示されました(図2)。
社会的意義
ファイロジェンと結合しても分解を受けないMADS転写因子は、ファイロジェンの本来の標的因子への結合と分解を阻害すると考えられます。ファイロジェンと結合するMADS転写因子はこれまで多数見つかっており、その中にはファイロジェンと結合しても分解されず逆に機能を阻害するものが存在する可能性があります。このようなMADS転写因子を探索・応用することで、ファイロジェンの機能を抑制し、葉化病を予防・治療できる薬剤の開発につながると期待されます。
また、ファイロジェンに限らず多くの病原性タンパク質では、結合性こそが標的を決める主要因だと考えられており、病原性タンパク質と様々な宿主タンパク質との結合性を網羅的に調べることで標的を探索する研究が盛んに行われています。しかし本研究で発見されたように、病原性タンパク質の標的を直接的な結合性だけで予測できない場合があることは、多くの研究においても考慮されなければならない点であると考えられます。
関連するプレスリリース
・植物病原体が花を葉に変えるメカニズムを解明 【2011年9月12日】
https://www.a.u-tokyo.ac.jp/topics/2011/20110912-1.html
・「花」を「葉」に変える病気の謎を解く ―原因遺伝子の発見と発症メカニズムの解明― 【2014年3月18日】
https://www.a.u-tokyo.ac.jp/topics/2014/20140318-3.html
・1つの病原性因子があらゆる植物種の花形成因子を分解する ―葉化病発症メカニズムは植物に共通であることを解明― 【2017年5月16日】
https://www.a.u-tokyo.ac.jp/topics/2017/20170516-1.html
・葉化病発症の仕組みを構造化学的に解明 ―葉化病治療薬開発や新品種開発に新たな道― 【2019年4月19日】
https://www.a.u-tokyo.ac.jp/topics/topics_20190419-1.html
・葉化病の病原タンパク質「ファイロジェン」の機能は1アミノ酸の変異で制御される ―水平移動による進化と病原性の変異メカニズムを解明― 【2020年8月19日】
https://www.a.u-tokyo.ac.jp/topics/topics_20200819-2.html
・タンパク質の新たな分解システム―ファイロジェンによる葉化誘導メカニズム解明で発見! 【2022年3月2日】
https://www.a.u-tokyo.ac.jp/topics/topics_20220302-1.html
・プロテインノックダウン技術の確立に一歩近づく ―花を葉化する細菌タンパク質「ファイロジェン」の花形成タンパク質認識機構を解明― 【2023年3月30日】
https://www.a.u-tokyo.ac.jp/topics/topics_20230330-1.html
・ファイトプラズマの病原性獲得の原動力を解明 ―病原性遺伝子はトランスポゾンによってシェアされる― 【2023年5月16日】
https://www.a.u-tokyo.ac.jp/topics/topics_20230511-1.html
発表者
東京大学大学院農学生命科学研究科
鈴木 誠人 大学院生
北沢 優悟 特任助教
岩渕 望 特任研究員
前島 健作 准教授
発表雑誌
- 雑誌
- Molecular Plant Pathology
- 題名
- Target degradation specificity of phytoplasma effector phyllogen is regulated by the recruitment of host proteasome shuttle protein
- 著者
- Masato Suzuki, Yugo Kitazawa, Nozomu Iwabuchi, Kensaku Maejima*, Juri Matsuyama, Oki Matsumoto, Kenro Oshima, Shigetou Namba, and Yasuyuki Yamaji
- DOI
- 10.1111/mpp.13410
- URL
- https://bsppjournals.onlinelibrary.wiley.com/doi/abs/10.1111/mpp.13410
研究助成
本研究は、日本学術振興会科学研究費補助金 (課題番号:20H02991、20KK0132、21H04722、21K14847、21K14853、22KJ1076、23K05237、23K13941) の支援を受けて行われました。
用語解説
注1 ファイトプラズマ
モリキューテス綱ファイトプラズマ属に分類される細菌群であり、1,000種を超える植物に病気を引き起こす。植物の篩管組織に寄生し、ヨコバイやウンカなどの篩管液を吸汁する昆虫により他の植物へと伝染する。ファイトプラズマが感染した植物は、葉化病(がく・花弁・雄しべが葉に、雌しべが茎に置き換わってしまう症状)・萎縮病(茎や葉の生長が抑制され、植物体全体が著しく小さくなる症状)・天狗巣病(わき芽が多数発生し、小さな枝葉が密生する症状)などの特徴的な症状を示し、枯れてしまう場合も多い。ファイトプラズマは世界各地で農業生産に大きな損失を及ぼしている一方で、その特徴的な症状が鑑賞利用される場合もある。例えば、ファイトプラズマが感染して花が緑色になったアジサイは、それがファイトプラズマによる葉化病だと判明する以前は、貴重な園芸品種として流通していた。また、ポインセチアは元来高さ2mを超える大きな植物であるが、ファイトプラズマを感染させて天狗巣病を引き起こすことにより、人工的に植物体を小さくしたものが園芸利用されている。
注2 ファイロジェン(phyllogen)
ファイトプラズマが引き起こす葉化病(phyllody)の原因タンパク質であり、phyllody-inducing gene familyの略。ファイロジェンは、様々な植物の間で保存されている花形成因子 (MADS転写因子)を分解することで、あらゆる植物に葉化病を引き起こすと考えられている。
注3 MADS転写因子
植物の生育に関わる様々な遺伝子の発現量を調節する転写因子。MADS転写因子の中でも、花の形成を制御するものはA・B・C・Eクラスの4つに分類され、それぞれ異なる花器官の形成に関与する(ABCEモデル)。例えばシロイヌナズナでは、AクラスのMADS転写因子はがく・花弁の形成に、EクラスのMADS転写因子は全花器官(がく・花弁・雄しべ・雌しべ)の形成に関わっている。花形成を制御する4クラスのMADS転写因子のうち、ファイロジェンは特にA・EクラスのMADS転写因子に結合して分解を誘導する。これにより、MADS転写因子による花器官の形成が阻害され、花器官が葉や茎へと退化してしまう。
注4 シャトル因子
タンパク質に結合して、プロテアソームと呼ばれる分解装置へと輸送する因子。シャトル因子は本来、細胞内の不要なタンパク質に結合して分解を誘導する役割を持つが、ファイロジェンは本因子を巧みに利用し、植物の花器官形成に重要なMADS転写因子を分解させている。
問い合わせ先
東京大学大学院農学生命科学研究科 生産・環境生物学専攻
准教授 前島 健作(まえじま けんさく)
〈報道に関する問合せ〉
東京大学大学院農学生命科学研究科・農学部
事務部 総務課総務チーム 総務・広報情報担当(広報情報担当)