2024-09-04 量子科学技術研究開発機構,創価大学
【発表のポイント】
- 血管内に投与したヒトMuse細胞1)が放射線障害を受けたマウスの腸管に集積し、腸管の再生を促進することを発見
- Muse細胞が放射線障害を受けたマウス腸管に集積するメカニズムを解明
- 有効な治療法がない放射線腸管障害2)への応用が期待される
【概要】
量子科学技術研究開発機構(理事長 小安重夫、以下「QST」)放射線医学研究所 放射線規制科学研究部 組織再生治療研究グループの三浦太一主任研究員、中山文明専門業務員とQST病院 治療診断部 消化器腫瘍課の山田滋課長、瀧山博年医長、創価大学 糖鎖生命システム融合研究所の西原祥子特別教授(所長)らは、ヒトの骨髄に含まれるMuse細胞がマウス放射線腸管障害に対して治療効果を有することを発見しました。
腸は放射線感受性3)が非常に高く、放射線障害が起きやすい臓器として知られていますが、放射線腸管障害に対する有効な治療法はありません。そのため、子宮頸がんや前立腺がん、膵臓がんなど腹部の腫瘍に対して放射線治療を行う際は、腸に放射線がなるべく当たらないように照射することで安全性を確保しています。しかし、まれに放射線腸管障害が起きてしまうケースや、腸管を避けて照射することができないため放射線治療を断念するケースがあります。放射線腸管障害に対する治療法を確立することができれば、放射線治療に伴うリスクを軽減して、安心・安全な放射線治療をより多くの患者に提供することができます。
研究グループは、放射線腸管障害を治療するツールとしてMuse細胞に着目しました。Muse細胞はヒトの骨髄や脂肪に存在し、その最大の特徴は、傷ついた部位に集まり組織の再生を促進する能力を持つことです。そのため、再生医療への応用が期待されており、脳梗塞や心筋梗塞などを対象とした臨床試験が行われています。今回、研究グループはヒトのMuse細胞が放射線腸管障害の治療に有効であるか、マウスを用いて検討しました。
全身への放射線(γ線、10Gy)照射により、放射線腸管障害を起こしたマウスにヒトMuse細胞を投与しました。すると、Muse細胞が放射線障害を受けた部位に集積し、組織の再生が促進されることがわかりました。さらに、放射線障害を受けた腸では、スフィンゴシン1リン酸(S1P)4)と呼ばれる物質が多く分泌されており、Muse細胞はこのS1Pを認識して障害部位に集積することを明らかにしました。これらの結果は、Muse細胞を用いた治療がヒトの放射線腸管障害に対しても有望であることを示しています。
今後、ヒトの腸における放射線障害に伴うS1Pの分泌の増加や、放射線腸管障害に対するMuse細胞による治療の安全性を明らかにすることにより、放射線治療のみならず、予期せぬ被ばくによる放射線腸管障害に対する治療への応用が期待されます。
この成果は、放射線腫瘍学分野の米国科学誌「Advances in Radiation Oncology」2024年9月号に掲載されます。本研究は、JSPS 科学研究費(JP20K16809、JP20K08064)、日立財団、濱口生化学振興財団の助成を一部受けています。
【研究開発の背景と目的】
腸管は放射線障害を受けやすい組織であるため、放射線腸管障害に対する治療法の確立が必要ですが、未だに有効な治療法はありません。そこで、研究グループは、放射線腸管障害を治療するツールとして、骨髄や脂肪に存在し、傷ついた組織の修復を担っているMuse細胞(図1)に着目しました。Muse細胞の最大の特徴は、ダメージ受けた箇所を認識して集積し、組織の修復を促進することです。実際に、急性心筋梗塞、脳梗塞、皮膚潰瘍、表皮水疱症などの疾患に対してMuse細胞の投与が有効であることが動物実験により明らかにされており、近年では脳梗塞や心筋梗塞などを対象とした臨床試験も進められています。しかし、Muse細胞の放射線腸管障害に対する治療効果については解明されていませんでした。そこで今回、研究グループはマウスを用いてヒトのMuse細胞が放射線腸管障害の治療に有効であるか検討しました。
【研究の手法と成果】
(1)Muse細胞は放射線腸管障害部位に集積するのか?
Muse細胞の細胞膜上にはスフィンゴシン1リン酸(S1P)に対する受容体(S1PR2)5)が高発現していることが知られています。また、これまでのMuse細胞研究によると、ダメージを受けた組織の細胞から分泌されるS1PとMuse細胞上のS1PR2が結合することで、Muse細胞がダメージを受けた箇所に集積することが報告されています(図2A)。
はじめに、放射線照射後のマウスの腸管でS1Pが増加するかを解析しました。マウスの全身に放射線(γ線、10Gy)を照射し、放射線腸管障害を起こした小腸におけるS1Pの発現を質量分析6)により検討しました。その結果、照射後24時間からS1Pの分泌量が増加し、48時間後には約2倍に増加することが分かりました(図2B)。このことから、Muse細胞を投与すれば、腸管の放射線障害部位に集積する可能性が高いと考えました。
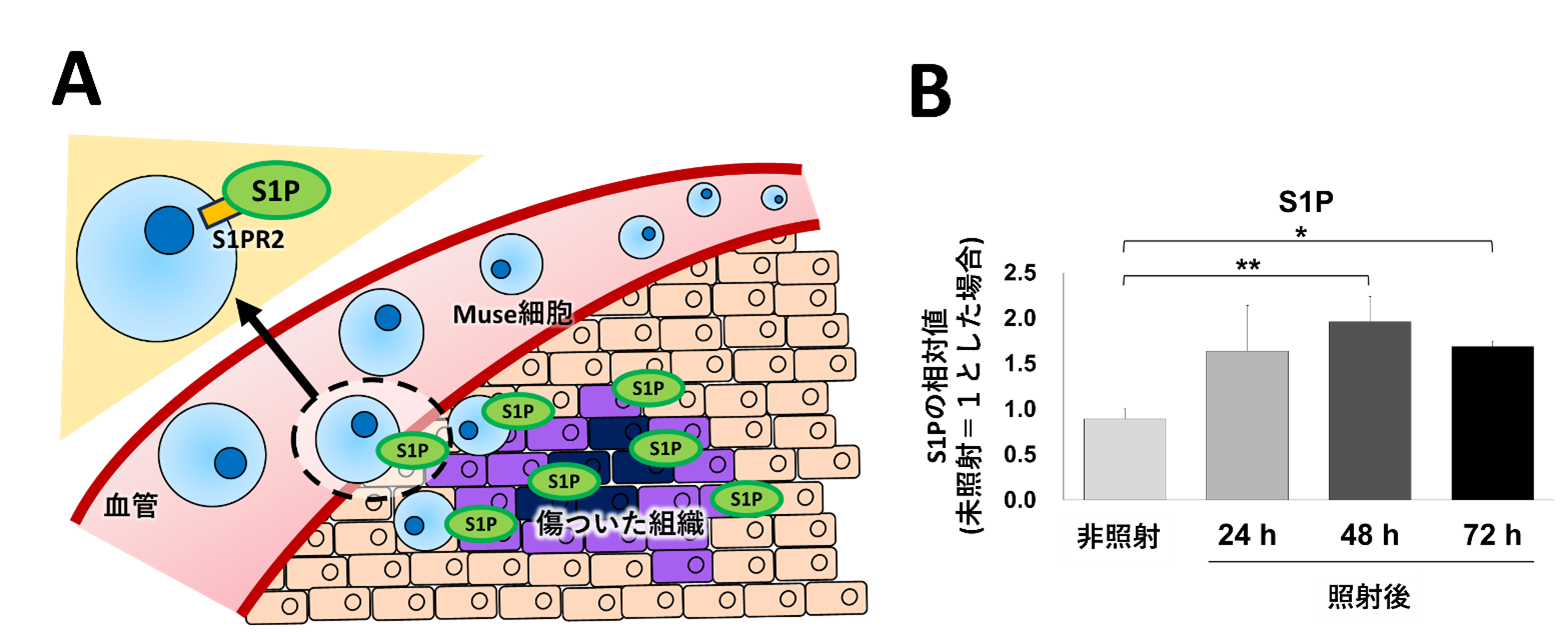
図2:マウス小腸における放射線照射後のS1P解析
有意差:*P <0.05; **P <0.01
次に、赤色に光る色素を取り込ませたヒトMuse細胞(5×105個)(図3A)を、放射線(γ線、10Gy)照射したマウスの静脈に注射しました。投与48時間後にマウスを解剖し、小腸内を観察したところ、投与したヒトMuse細胞が放射線障害部位に集積していることがわかりました(図3B中央)。また、ヒトMuse細胞を投与する際にMuse細胞上のS1PR2とS1Pとの結合を阻害する薬剤JTE-0137)を併用したマウスでは、投与したMuse細胞が小腸に集まらないこともわかりました(図3B右)。これらの結果から、投与したヒトMuse細胞のS1PR2が、放射線腸管障害を受けた小腸細胞で分泌されたS1Pと結合することによって障害部位に集積することがわかりました。
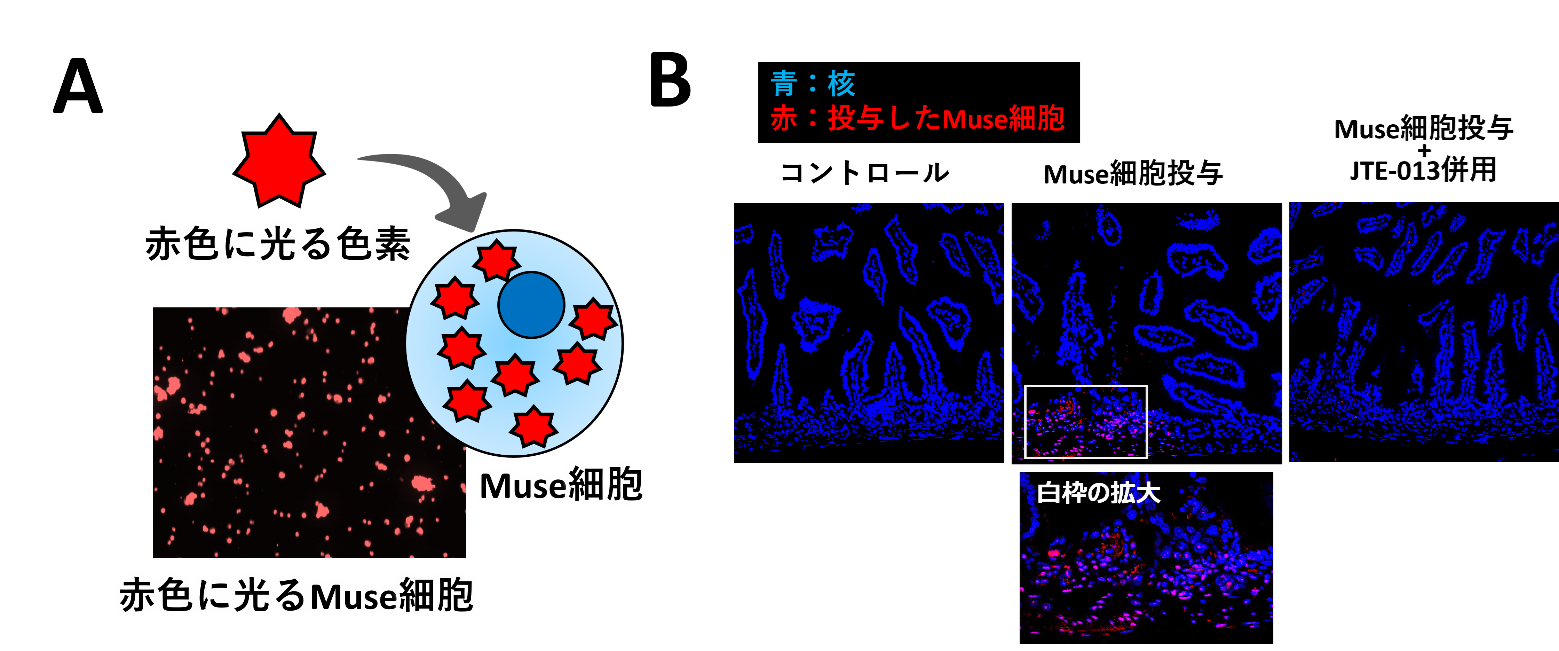
図3:投与したヒトMuse細胞が放射線障害を受けたマウス小腸に集積する様子
(2)Muse細胞は放射線腸管障害に対する治療効果を有しているのか?
放射線照射後に小腸などの腸管で障害が起こる主要な原因の一つに、腸を構成する様々な細胞を作ることができる特殊な細胞(幹細胞)が放射線により死滅することがあげられます。この幹細胞はクリプトと呼ばれるユニークな構造(図4A)を形成しており、放射線障害が起きた小腸ではこのクリプト数が少なくなることがわかっています。したがって、放射線照射後にクリプト数を計測することで放射線腸管障害の程度を評価することができ、これをクリプト解析と呼びます。
ヒトMuse細胞の投与による放射線腸管障害に対する治療効果を評価するため、マウスの全身に放射線(γ線、10Gy)を照射した2時間後に、ヒトMuse細胞(5×105個)を静脈より投与し、その後クリプト解析を行いました。その結果、ヒトMuse細胞を投与していないマウスおよびJTE-013を併用したマウスと比較して、ヒトMuse細胞を投与したマウスではクリプト数が約2.8倍多いことがわかりました(図4B)。この結果から、ヒトMuse細胞はマウス小腸における放射線腸管障害に対して治療効果を発揮することがわかりました。
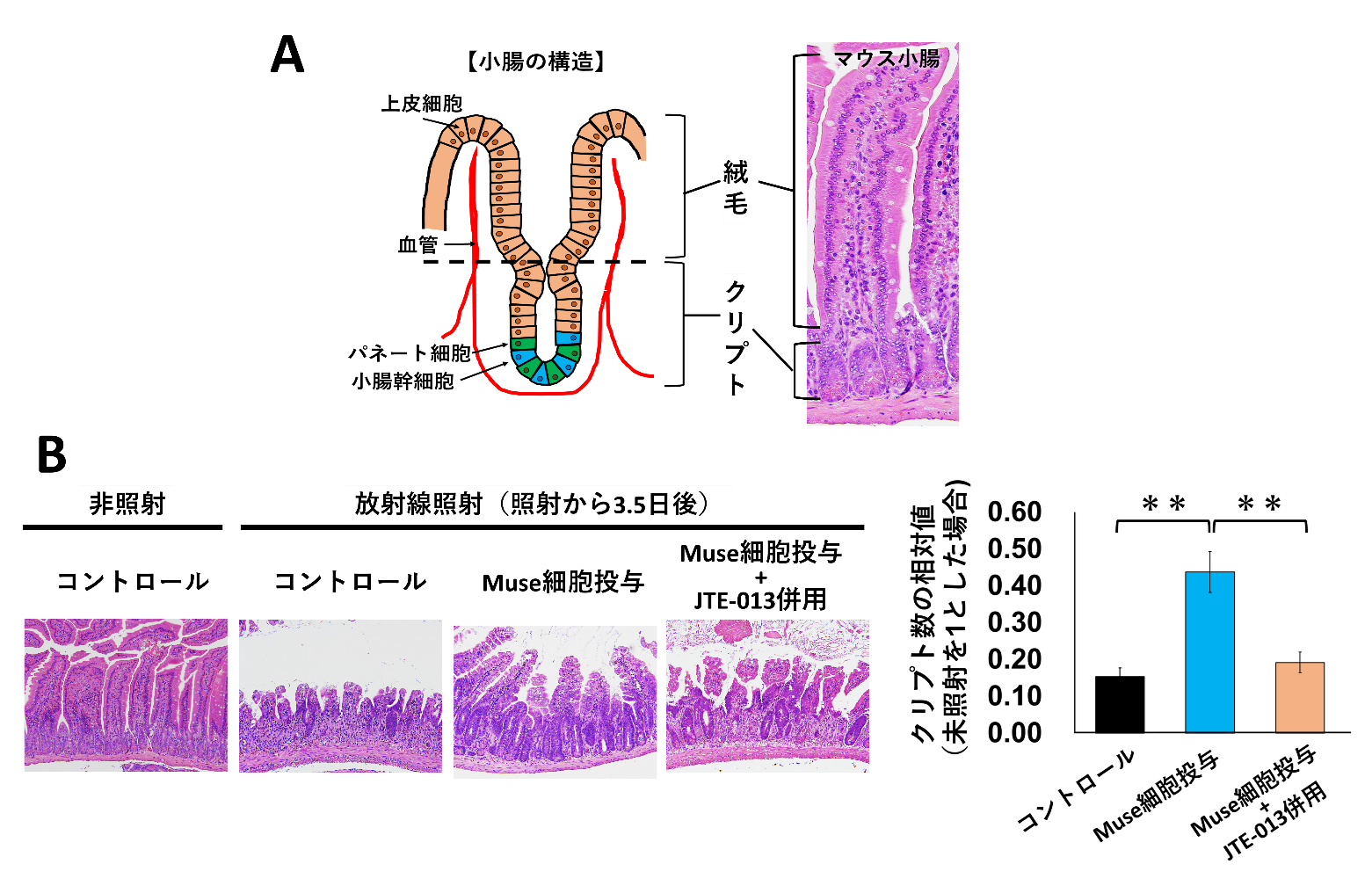
図4:ヒトMuse細胞の放射線腸管障害に対する治療効果(クリプト解析)
有意差: **P <0.01
また、放射線(γ線、10Gy)を照射した2時間後にヒトMuse細胞を投与し、小腸を構成する様々な細胞を観察しました。その結果、ヒトMuse細胞を投与していないマウスでは、小腸を構成する細胞の多くが死滅していました。ヒトMuse細胞のみを投与したマウスと、JTE-013を併用したマウスを比較すると、Muse細胞のみを投与したマウスの方が各細胞とも多くが生存し、組織としての形は非照射マウスのものに比較的近いことがわかりました(図5)。
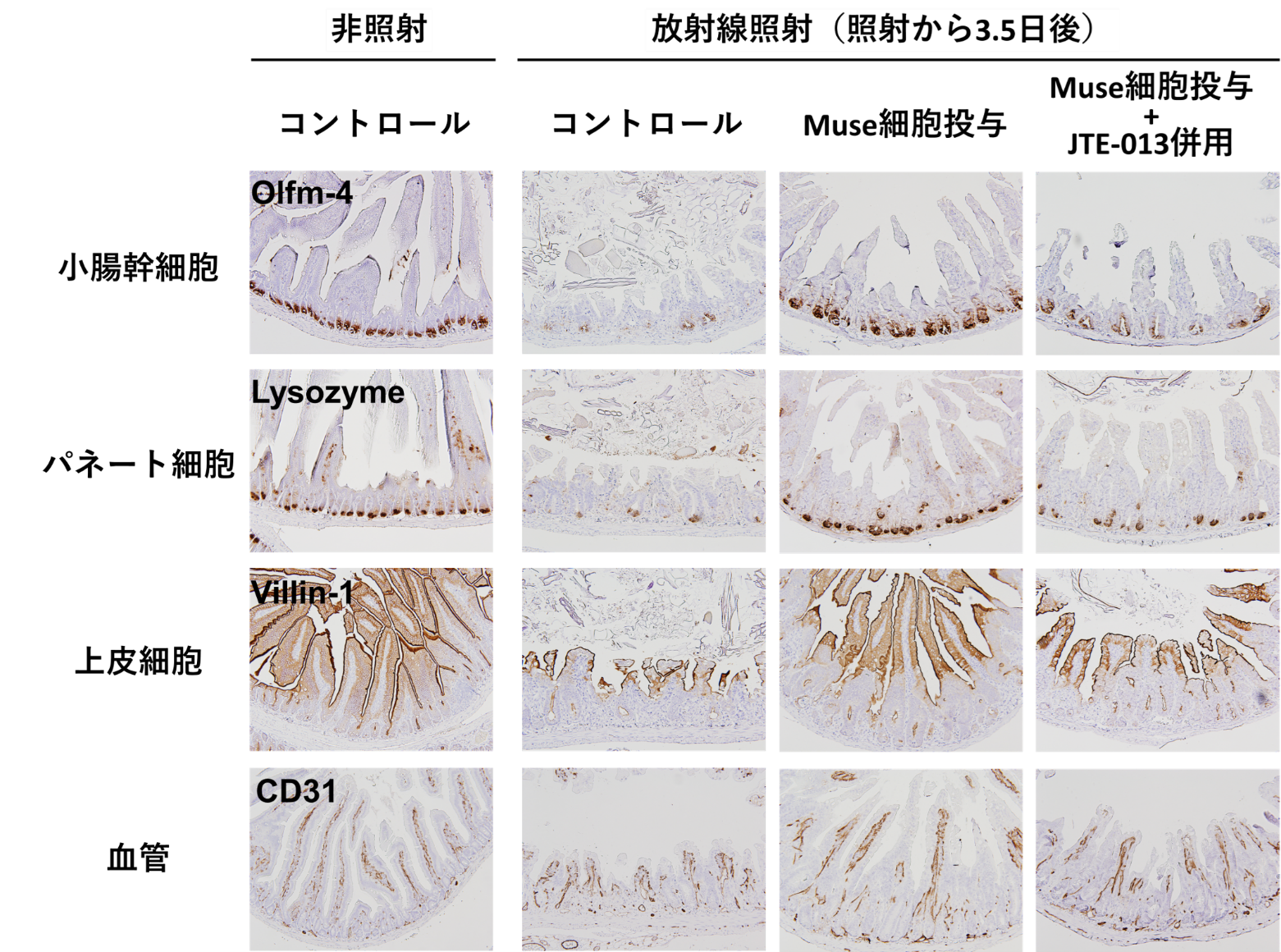
図5:ヒトMuse細胞の放射線腸管障害に対する治療効果(小腸構成細胞の観察)
【今後の展開】
本研究により、ヒトMuse細胞が放射線腸管障害の治療に有望であることを示すことができました。今後は、ヒトの腸でも放射線照射に伴いS1Pが増加するか、また予期せぬ被ばく後の再生治療にもMuse細胞を用いることができるかなどを解析し、Muse細胞による放射線腸管障害治療への臨床応用の可能性を探りたいと考えています。また、腸以外の皮膚、肺、神経などの放射線障害に対してもMuse細胞の投与が有効か調べる予定です。
【用語解説】
1)Muse細胞(Multi-lineage differentiating Stress Enduring cell)
骨髄、脂肪、臍帯などに存在している幹細胞です。Stage-specific embryonic antigen (SSEA)-3がMuse細胞マーカーとして知られており、例えばヒトの骨髄由来の細胞からSSEA-3陽性細胞を単離することでMuse細胞を回収することができます。非腫瘍性なため体内に投与した際の安全性も高く、また免疫拒絶を受けにくいという特徴もあり、免疫抑制剤を使用しなくても他家移植が可能とされています。本実験でもマウスにヒトMuse細胞を投与する際は免疫抑制剤を併用していません。
2) 放射線腸管障害
小腸などの消化管に放射線が照射されると、まず放射線による影響を受けやすい幹細胞に増殖の抑制や細胞死の誘導が起こり、続いて粘膜の炎症などが起こります。高い線量の被ばくでは、広範囲で幹細胞が死滅し、細胞の供給は断たれ、絨毛の構造は消失し、粘膜上皮に潰瘍や出血が進み、やがて壊死します。また、被ばくにより急性の腸疾患を起こした場合は高い確率で晩期障害(数ヶ月〜数年後に現れる障害)が起こり、粘膜上皮の障害だけでなく血管の損失や繊維化などの慢性的・複合的な症状が現れます。
3) 放射線感受性
生物に放射線が照射されると、一般的に細胞分裂が盛んな細胞や未成熟な細胞ほど大きなダメージを受けます。この放射線による影響の受け方の度合を感受性といいます。体内で放射線に対して高い感受性を示す臓器としては、骨髄、リンパ節、脾臓、胃、腸、生殖腺、皮膚などがあります。
4) スフィンゴシン1リン酸(S1P)
S1Pは、生体膜を構成するスフィンゴ脂質の代謝産物であり、リゾリン脂質と呼ばれる脂質に属しています。スフィンゴシンと呼ばれる脂質が、スフィンゴシンキナーゼと呼ばれる酵素によりリン酸化されるとS1Pになります。
5) スフィンゴシン1リン酸(S1P)に対する受容体(S1PR2)
S1Pに対する受容体は、S1PR1~5の5種類存在しており、そのうちヒトMuse細胞ではS1PR2が高発現しています。
6) 質量分析
分子をイオン化し、イオンや分子の質量を測定する特殊な分析法です。既知物質の同定や未知物質の構造の決定などに使われます。
7) JTE-013
S1PR2に選択的なアンタゴニスト(拮抗剤)です。JTE-013とS1PR2が強く結合すると、S1PはS1PR2と結合できなくなります。
【掲載論文】
タイトル: Stem Cell Therapy Using Bone Marrow-Derived Muse Cells Repairs Radiation-Induced Intestinal Injury Through Their Intestine-Homing via Sphingosine Monophosphate-Sphingosine Monophosphate Receptor 2 Interaction
著者: Taichi Miura PhD 1, Junko Kado MS1, Hirotoshi Takiyama MD, PhD2, Mitsuko Kawano PhD1, Asako Yamagiri BS1, Shoko Nishihara PhD3,4, Shigeru Yamada MD, PhD2, Fumiaki Nakayama MD, PhD1,5
著者所属:
1; Regenerative Therapy Research Group, Department of Radiation Regulatory Science Research, National Institute of Radiological Sciences (NIRS), National Institutes for Quantum Science and Technology (QST), Chiba, Japan
2; QST Hospital, National Institutes for QST, Chiba, Japan
3; Glycan and Life Systems Integration Center (GaLSIC), Soka University, Hachioji, Tokyo, Japan
4; Laboratory of Cell Biology, Department of Biosciences, Graduate School of Science and Engineering, Soka University, Hachioji, Tokyo, Japan
5; Donation Course of Advanced Regenerative Plastic Surgery, Chiba University Graduate School of Medicine, Chiba, Japan
DOI: https://doi.org/10.1016/j.adro.2024.101565