2024-11-19 理化学研究所
理化学研究所(理研)生命医科学研究センター 統合ゲノミクス研究チームの渡辺 貴志 技師、分化制御研究チームの福山 英啓 副チームリーダー(研究当時、現 感染免疫研究チーム 客員主管研究員)らの研究グループは、数百個のB細胞[1]から高精度にモノクローナル抗体[2]をスクリーニングする手法を開発しました。
本成果は、診断ツールとしての利用から、がん治療、自己免疫疾患治療への応用、感染症治療など、治療用あるいは診断用抗体の単離に貢献するとともに、パンデミックが予測される場合に特に有用です。
今回、研究グループは、独自の技術にGolden Gate法[3]を応用しての二重発現ベクターの確立に成功し、生体内(in vivo)で膜結合抗体[2]を発現させることにより、組換えモノクローナル抗体を迅速にスクリーニングする方法を開発しました。この方法を用いて、インフルエンザウイルスの抗原を注射した免疫マウスから高い親和性を有するインフルエンザ交差反応性抗体[2]を7日以内という短い期間に単離できることを実証しました。
本研究は、英国の科学雑誌『eLife』オンライン版(11月19日付:日本時間11月19日)に掲載されました。
背景
人間には、病気を引き起こす抗原を狙って結合して攻撃・排除する抗体により体を守る「抗原抗体反応」という働きが備わっています。抗体医薬は、この働きを利用して、抗体を人工的に作製して体内に投与し、病気を予防したり治療したりします。
抗体医薬に利用される抗体は、リンパ球の一種であるB細胞から作られ、ある特定の抗原だけを認識して攻撃する性質を持ちます。この性質を利用して作られたのがモノクローナル抗体です。
1975年にKohlerとMilsteinは、ハイブリドーマ法を開発し、モノクローナル抗体の作製技術を確立させました。ハイブリドーマ法はまず、マウスなどに病原菌などの異物を注入し、抗体を作り出すB細胞を増やします。次に、無限に増殖できる骨髄腫がん細胞(ミエローマ細胞)とB細胞を融合させて、増殖力と生存力の強い融合細胞(ハイブリドーマ[4])を作製し、長期間にわたって抗体産生B細胞を産生させます。生み出された抗体産生B細胞の中から有用なモノクローナル抗体を生成する細胞を選び出して抗体を大量生産することができます。
しかし、ハイブリドーマ法は、マウス、ラット、ハムスターなどの動物モデルから貴重な抗体を単離するのには非常に信頼性が高い技術である一方、単離には時間がかかり、扱いには技術的な熟練が必要です。また、B細胞とミエローマ細胞の融合率は低い(0.001%未満)ため、1群のB細胞から得られるハイブリドーマの数は数百クローンに限られ、モノクローナル抗体の産生には限界があります。また、ハイブリドーマ法で作られる抗体は、細胞外に放出される分泌型タンパク質のため細胞から離れています。そのため、細胞が混合状態では、どの細胞が所望の抗体を作っているか分からないため、細胞を一つ一つ分離して、どの細胞が所望の抗体を作っているのか、有用な機能を持っているのかを確認する作業が必要となります。この抗体の機能とその遺伝子を結び付けるプロセスは数カ月もの時間がかかっていました。
また、抗体のスクリーニングは、免疫グロブリン(lg)の遺伝子のクローニング[3]と組換え抗体産生後に開始されます。抗体は重鎖と軽鎖[5]のペアから構成されるため、一般的に二つの独立した発現ベクター(運び屋)から発現させる必要があり、プラスミド(小さな環状のDNA)の調整・維持のためにも時間を要していました。
DNAやRNAの配列を決定する次世代シーケンサー[6]技術は、特定の抗原に特異的な数万のIg可変領域コード遺伝子[7]の塩基配列を同定することができますが、次世代シーケンサー技術と互換性のあるハイスループット(大量処理)形式で抗体をスクリーニングする方法はありません。
このため、次世代シーケンサー技術と互換性のあるハイスループット形式で抗体をスクリーニングする方法の開発が求められていました。
今回、共同研究グループは、組換えモノクローナル抗体を迅速にスクリーニングする方法の開発に挑みました。
研究手法と成果
研究グループは、生体内(in vivo)で膜結合抗体を発現させることにより、迅速な組換えモノクローナル抗体のスクリーニング方法を開発しました(図1右)。
まず、インフルエンザウイルスのヘマグルチニン(HA)[8]の抗原をマウスに注射して、免疫マウスを作りました。その免疫マウスの脾臓(ひぞう)を取り出し、そこからB細胞を分離しました。分離したB細胞の抗体の遺伝子配列をポリメラーゼ連鎖反応(PCR)で増幅し、二重発現ベクターを作製しました。この二重発現ベクターは、重鎖と軽鎖の遺伝子を連結しているため、重鎖と軽鎖のそれぞれを調整・維持する必要がなくなり、プラスミドの調整・維持の時間を従来の半分に短縮するだけでなく、Igプラスミド・ライブラリーの作製に要する時間も短縮します。
この二重発現ベクターを培養細胞に導入して、細胞表面に膜結合型Igを発現させました(Ig提示細胞)。そのIg提示細胞のIg部分に抗原が結合すると抗原結合細胞となります。抗原結合細胞は、細胞表面の膜結合型Igを介してIg遺伝子をコードするプラスミドを運びます。そして、免疫マウスから高い親和性を有するインフルエンザ交差反応性抗体を7日以内という短い期間に単離することを実証しました。
抗原結合細胞は細胞表面のIgを介してIg遺伝子をコードするプラスミドを運ぶため、膜結合型Igの抗原結合機能と今回開発したプラスミド構築物上のIg DNA配列情報とを結び付けることができるとともに抗体が細胞から離れないので、細胞が混合状態のままでも所望の抗体を提示している細胞を容易に選択することができます。
また、研究グループが開発した複数のDNA断片を迅速かつ効率的に組み立てる技術にGolden Gate法の技術を応用して、抗体の重鎖と軽鎖のフラグメントを容易に膜型抗体として発現可能なベクターに組み込んで二重発現ベクターの作製に成功したのは今回が初めてです。
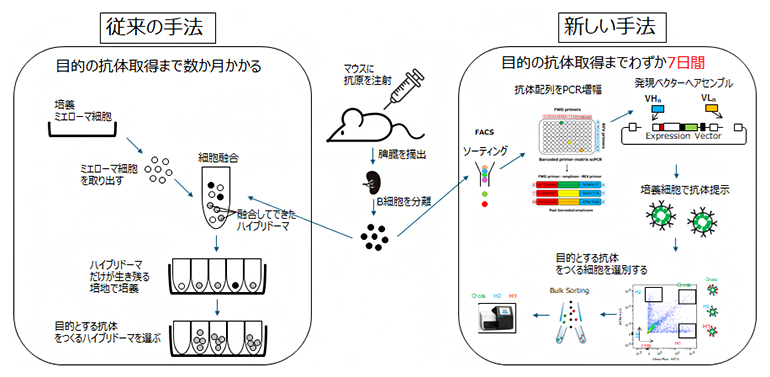
図1 スクリーニングの従来型と今回開発した新手法
インフルエンザウイルスの抗原を注射されたマウス(免疫マウス)から脾臓(ひぞう)を取り出し、B細胞を分離する。いずれの手法でもそのB細胞を使っている。
(左)従来の手法(ハイブリドーマ法)。抗体産生B細胞とミエローマ細胞を融合させてハイブリドーマを作製して、目的とする抗体を作るハイブリドーマを選ぶ。目的の抗体を得るまでに数ケ月もかかる。
(右)研究グループが新たに開発した手法。分離したB細胞の抗体の遺伝子配列をPCRで増幅した後、二重発現ベクターを使い膜結合抗体を作製した。その後、目的の抗体を作る細胞を選別した。この結果、免疫マウスからインフルエンザの抗原に高い親和性を有する抗体を7日以内という短い期間に単離することができた。
そこで、抗原に反応して目的の抗体を作るB細胞を選別しました。選別したB細胞のクローニング効率は75%以上でした。分離したB細胞の抗体の遺伝子配列をPCRで増幅して、抗体遺伝子の二重発現ベクターを作製しました。そして、培養細胞に二重発現ベクターを導入し、その抗体提示細胞に抗原を作用させました。フローサイトメトリー[9]で抗原に対する強い結合体を選んで機能スクリーニングを行った結果、交差反応性B細胞[1]のクローンを9個に絞り込むことができました(図2)。抗体提示細胞に蛍光標識抗原を作用させて、フローサイトメトリーでの蛍光強度を計測したところ、おのおの9クローンの分泌抗体の抗原親和性を直接反映していることが分かりました。そのうちの一つのクローンは、分子間の結合強度を示す解離定数(Kd)[10]が約5.66 × 10-10モーラー(M:mol/L)という低い値で、強い親和性を持ちました。さらに、図2に示すように、本研究で得られた交差反応性抗体は、6種類のヘマグルチニンに対して特徴的な結合能力を示しました。
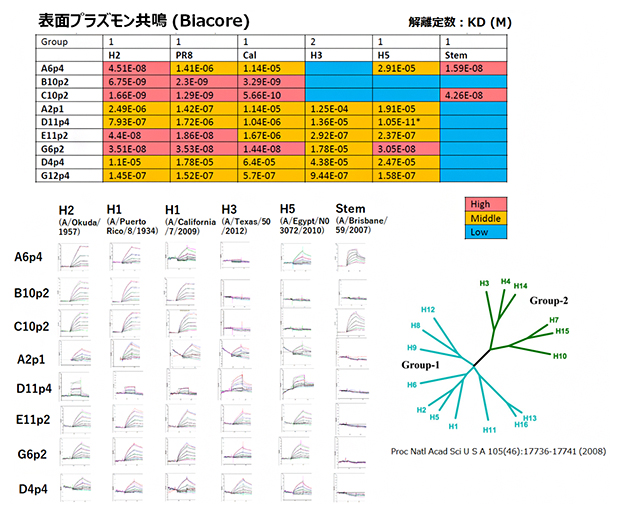
図2 ヘマグルチニンタイプに対する交差反応性抗体の結合能の比較
交差反応性抗体は6種類のヘマグルチニンに結合能力を示した。中でも特に親和性が高かったのは、交差反応性抗体のクローン「C10p2」とヘマグルチニン「Cal」だった。ヘマグルチニンはその抗原構造によって、グループに分けられ、H2、PR8、Cal、H5はグループ1(主に鳥類に見られる。一部はヒトに感染する)に属し、H3はグループ2(ヒトの季節性インフルエンザや他の哺乳類にも多く見られる)に属する。「*」~H5に対するD11p4の親和性は低く、不正確であった。
H2株:A/Okuda/1957(H2N2)、PR8株:A/Puerto Rico/8/1934(H1N1)、Cal:California/2009 (X-179A) [H1N1] Pdm09、H3:A/Texas/50/2012 (X-223) [H3N2]、H5:A/Egypt/N03072/2010(H5N1)、Stem:A/Brisbane/59/2007(H1N1)。
今後の期待
新型コロナウイルス(COVID-19)のパンデミックの際には、モノクローナル抗体を分離するのに時間を要したため、モノクローナル抗体の分離の技術的改善の必要性が顕在化しました。
今回、研究グループは、迅速な組換えモノクローナル抗体のスクリーニング方法の開発に成功しました。この方法は、迅速なだけでなく機能としての抗原抗体結合と抗体をコードする遺伝子とを直接結び付けることも可能です。また、作製した重鎖と軽鎖の遺伝子を連結した二重発現ベクターは、プラスミドの調整・維持の時間を従来の半分に短縮するだけでなく、Igプラスミド・ライブラリーの作製に要する時間も短縮します。さらに、免疫マウスから高い親和性を有するインフルエンザ交差反応性抗体を7日以内という短い期間に単離することを実証しました。
本研究成果は、診断ツールとしての利用から、がん治療、自己免疫疾患治療への応用、感染症治療など、治療用あるいは診断用抗体の単離に貢献するとともに、ワクチン開発の迅速化にも寄与することから、パンデミックが予測される場合に特に有用です。
また、本研究成果とロボットによる実験の自動化を組み合わせることで、いろいろな疾患に対して有用なモノクローナル抗体を迅速かつ大量に得ることが可能となり、さまざまな疾患に対するワクチンの開発にも広く貢献することが期待されます。
補足説明
1.B細胞、交差反応性B細胞
B細胞はリンパ球と呼ばれる免疫細胞の一種で、抗体(免疫グロブリン)というタンパク質の産生を担う。この抗体がウイルスや細菌、毒素といった異物に特異的に結合して排除する。交差反応性B細胞は一つの抗原に対する抗体を産生するだけでなく、他の類似した抗原にも反応することができる。
2.モノクローナル抗体、膜結合抗体、交差反応性抗体
モノクローナル抗体は、同一のB細胞クローンから生成される抗体。これらは特定の抗原(例えば、ウイルスのスパイクタンパク質やがん細胞の表面マーカー)に非常に高い特異性で結合する。この性質を利用して、病気の診断や治療に役立てられている。KohlerとMilsteinの両氏は1984年、モノクローナル抗体の作製技術の開発によってノーベル生理学医学賞を受賞している。膜結合抗体は、細胞の表面に固定された抗体。通常、B細胞の表面に存在し、抗原と結合して免疫応答を誘導する役割を果たす。交差反応性抗体は、異なる抗原に対して反応できる抗体。似た構造を持つ抗原に対しても結合し、免疫応答を引き起こす能力を持つ。
3.Golden Gate法、クローニング
Golden Gate法は、制限酵素の一つであるType IISエンドヌクレアーゼを使用して複数のDNA断片を迅速かつ効率的に組み立てる技術。この方法を用いて、重鎖断片と軽鎖断片を一つの発現ベクターに効率的に組み込むことが可能になる。クローニングとは、ある特定の遺伝子を単離して増やすこと。
4.ハイブリドーマ
ハイブリドーマは、モノクローナル抗体([2]参照)を産生するために、B細胞と骨髄腫がん細胞(ミエローマ細胞)が融合した細胞のこと。
5.重鎖と軽鎖
抗体の構造は、2本の重鎖と2本の軽鎖から成る。これらが結合し、Y字型の構造を形成する。この構造により、抗体は高い特異性で抗原に結合し、免疫系が病原体を認識し排除するのを助ける。
6.次世代シーケンサー
次世代シーケンサーは、DNAやRNAの配列を決定する技術で、がんやその他の生物学的現象に関連するさまざまな要因を研究するために利用される。この技術は1回のラン(作動)で超並列的に数百万から数兆の塩基配列を決定できるため、高スループットで効率的なデータ取得が可能。
7.可変領域コード遺伝子
抗体の特異性を決定する遺伝子であり、抗原と結合するための主要な部分。この遺伝子は、免疫グロブリン(Ig)の遺伝子の中で、特定の抗原に対する抗体を生成するために重要な役割を果たす。
8.ヘマグルチニン(HA)
インフルエンザウイルスなどのウイルスが細胞表面の糖鎖に結合して感染するための糖タンパク質。インフルエンザウイルスのHAは、宿主細胞の表面にあるシアル酸を含む糖鎖と結合し、ウイルスを細胞内に侵入させる役割を果たす。HAはHemagglutininの略。
9.フローサイトメトリー
細胞の蛍光や散乱光を検出して分析する技術。この技術を用いて、細胞のサイズや構造、表面や内部の分子の発現を1細胞レベルで調べることができる。
10.解離定数(Kd)
タンパク質に結合した分子(リガンド)が、タンパク質から離れるときに、どの程度離れやすいかを示す(平衡)定数のこと。濃度の単位(M、モーラー)で示され、この数値が小さいほど、リガンドがタンパク質から離れにくい、すなわちリガンドがタンパク質と強固に結合し、親和性が高いことを意味する。一般的に、ナノモーラー(nM)単位(10-9~10-7M)の解離定数の場合、そのリガンドはタンパク質と強固に結合すると認識される。
研究グループ
理化学研究所 生命医科学研究センター
統合ゲノミクス研究チーム
技師 渡辺 貴志(ワタナベ・タカシ)
専門技術員 望月 芳樹(モチヅキ・ヨシキ)
テクニカルスタッフⅠ 横山 史絵(ヨコヤマ・フミエ)
上級テクニカルスタッフ 長谷川 知子(ハセガワ・トモコ)
チームリーダー(研究当時)小原 收(オハラ・オサム)
分化制御研究チーム
副チームリーダー(研究当時)福山 英啓(フクヤマ・ヒデヒロ)
(現 関西医科大学 附属光免疫医学研究所 免疫部門 教授、現 理研 生命医科学研究センター 感染免疫研究チーム 客員主管研究員)
研修生(研究当時)畑 ひかる(ハタ・ヒカル)
チームリーダー 黒﨑 知博(クロサキ・トモヒロ)
共生微生物叢研究チーム
上級テクニカルスタッフ クマール・ナヴィーン(Naveen Kumar)
研究支援
本研究は、理化学研究所研究プログラム「シングルセル・プロジェクト(小原收、渡辺貴志、黒﨑知博、福山英啓)」の支援を受けて実施し、日本学術振興会(JSPS)科学研究費助成事業基盤研究(S)「メモリーB細胞の形成と維持を支える内的・外的メカニズム(研究代表者:黒﨑知博)」による助成を受けて行われました。
原論文情報
Takashi Watanabe*, Hikaru Hata, Yoshiki Mochizuki, Fumie Yokoyama, Tomoko Hasegawa, Naveen Kumar, Tomohiro Kurosaki, Osamu Ohara, and Hidehiro Fukuyama, “Development of a new genotype-phenotype linked antibody screening system”, eLife,
発表者
理化学研究所
生命医科学研究センター 統合ゲノミクス研究チーム
技師 渡辺 貴志(ワタナベ・タカシ)
分化制御研究チーム
副チームリーダー(研究当時)福山 英啓(フクヤマ・ヒデヒロ)
(現 感染免疫研究チーム 客員主管研究員)
報道担当
理化学研究所 広報室 報道担当