理化学研究所(理研)環境資源科学研究センター植物免疫研究グループの浅井秀太客員研究員、白須賢グループディレクターらの国際共同研究グループ※は、植物病原菌が植物への感染を成立させるために、宿主植物からの認識を回避する機構を発見しました。
植物と病原菌は、自身の存続をかけた攻防により共進化してきました。植物病原菌はエフェクター[1]と呼ばれる病原性タンパク質を植物細胞内に注入し、植物の防御反応を抑制することで、感染に成功します。一方、抵抗性を示す植物は、細胞内型免疫センサー[2]を用いてエフェクターを認識し、過敏感反応(HR)[3]と呼ばれる、細胞死を伴う強力な免疫応答を誘導します。
今回、国際共同研究グループは、卵菌綱[4]植物病原菌であるべと病[5]菌から、シロイヌナズナの細胞内型免疫センサーによって認識されるエフェクターを同定しました(図A)。また、認識を回避しているべと病菌分離株において、エフェクターの発現を抑制(図B)、または宿主細胞内での局在を変化させること(図C)で、認識を回避する2種類の機構を明らかにしました。
本研究は、英国のオンライン科学誌『Nature Communications』(12月5日付け:日本時間12月5日)に掲載されます。
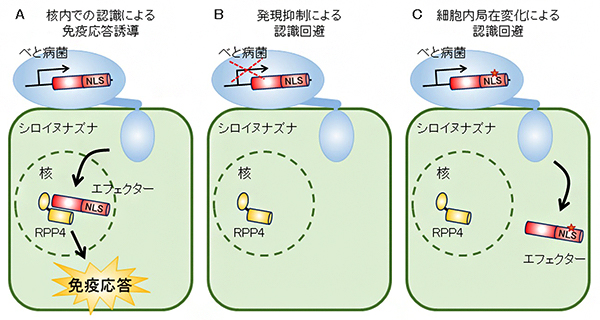
図 べと病菌の細胞内型免疫センサーRPP4による認識の回避機構
※国際共同研究グループ
理化学研究所 環境資源科学研究センター 植物免疫研究グループ
客員研究員 浅井 秀太(あさい しゅうた)
グループディレクター 白須 賢(しらす けん)
英国センズベリー研究所
博士研究員 オリバー・ファーザー(Oliver Furzer)
博士研究員 ヴォルカン・セビック(Volkan Cevik)
博士研究員 デーソン・キム(Dae Sung Kim)
博士研究員 ナビード・イシャクー(Naveed Ishaque)
グループリーダー ジョナサン・ジョーンズ(Jonathan Jones)
カリフォルニア大学バークレー校
博士研究員 サンドラ・ゴーリスチニック(Sandra Goritschnig)
博士研究員 ブライアン・スタスカヴィッツ(Brian Staskawicz)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究B「病原菌エフェクターの植物免疫抑制機構および認識回避機構の解明(研究代表者:浅井秀太)」をはじめ、同基盤研究C「細胞レベルでの宿主病原菌相互作用機構解析による病害防除に向けた有用遺伝子の探索(研究代表者:浅井秀太)」、同新学術領域研究「植物の成長可塑性を支える環境認識と記憶の自律分散型統御システム」の研究課題「寄生植物による維管束情報ハイジャック機構の解明(研究代表者:白須賢)」、同基盤研究S「植物と病原体の攻防における分子機構(研究代表者:白須賢)」、同特別研究員奨励費「核局在卵菌綱植物病原菌エフェクターの罹病性誘導機構および病害抵抗性抑制機構の解明(特別研究員SPD:浅井秀太)」による支援を受けて行われました。
背景
植物と病原菌は、自身の存続をかけた攻防により共進化してきました。植物病原菌はエフェクターと呼ばれる病原性タンパク質を植物細胞内に注入し、植物の防御反応を抑制することで、感染に成功します。一方、抵抗性を示す植物は、細胞内型免疫センサーを用いてエフェクターを認識し、過敏感反応(HR)と呼ばれる、細胞死を伴う強力な免疫応答を誘導します。
卵菌綱植物病原菌であるべと病菌(Hyaloperonospora arabidopsidis)は、モデル植物であるシロイヌナズナにべと病を引き起こす植物病原菌です。これまで、べと病菌-シロイヌナズナ間の相互作用については世界中で精力的に研究されており、べと病菌の異なる分離株とシロイヌナズナの異なるエコタイプ[6]間の親和性・非親和性(感染できる・できない)の関係が明らかにされています。シロイヌナズナのCol-0エコタイプは、細胞内型免疫センサーであるRPP4タンパク質によって、べと病菌の分離株Emoy2を認識することが知られていましたが、認識されるエフェクターはまだ見つかっていませんでした。
そこで、国際共同研究グループは、細胞内型免疫センサーRPP4により認識されるべと病菌エフェクターの同定を試みました。
研究手法と成果
国際共同研究グループは、まずシロイヌナズナ(Col-0)において、非病原性株Emoy2(RPP4による認識)と病原性株Waco9(RPP4による認識回避)を感染させた際の遺伝子発現解析(比較トランスクリプトーム解析[7])およびゲノム配列を決定したEmoy2とWaco9を含む七つのべと病菌分離株間の比較ゲノム解析[8]を通して、RPP4により認識されるべと病菌エフェクター候補をEmoy2株より五つ選抜しました。
一般的に、細胞内型免疫センサーと認識される病原菌エフェクターを同時に植物細胞内で発現させると、過敏感細胞死(HR細胞死)[3]という免疫応答が誘導されることが知られています。そこで、選抜された五つの候補エフェクターとRPP4をタバコ植物において一緒に発現させたところ、RPP4と候補エフェクターHaRxL103Emoy2を一緒に発現させた部位において、HR細胞死が観察されました(図1)。これにより、べと病菌エフェクターHaRxL103Emoy2(Emoy2由来)が、シロイヌナズナの細胞内型免疫センサーRPP4により認識されることが分かりました。
続いて、べと病菌の宿主細胞内型免疫センサーからの認識回避機構を調べるために、RPP4に認識されないべと病菌分離株(Waco9、Cala2、Emco5、Maks9、Hind2)由来のHaRxL103遺伝子をクローニング[9]し、タバコ植物においてRPP4と一緒に発現させました。その結果、HR細胞死はRPP4とHaRxL103のWaco9/Cala2型(HaRxL103Waco9/Cala2)およびEmco5/Maks9型(HaRxL103Emco5/Maks9)を一緒に発現させた部位においては観察されましたが、Hind2型(HaRxL103Hind2)を一緒に発現させた部位では観察されませんでした(図2A)。また、植物細胞内でのHaRxL103の局在を調べたところ、HR細胞死を誘導したEmoy2型、Waco9/Cala2型、Emco5/Maks9型は、細胞質と核(特に核小体[10])に局在しましたが、HR細胞死を誘導しなかったHind2型は、核小体内に局在する割合が著しく減少していることが分かりました(図2B)。
そこで、Hind2型に核局在シグナル配列(NLS)[11]を付加したところ(NLS-HaRxL103Hind2)、植物細胞内の核(特に核小体)内にNLS-HaRxL103Hind2の局在が見られました(図3A)。また、タバコ植物においてNLS-HaRxL103Hind2をRPP4と一緒に発現させたところ、HR細胞死が誘導されました(図3B)。さらに、配列を比較したところ、Hind2型ではEmoy2型が持つ推定のNLS内に変異が見つかりました。以上の結果より、HaRxL103Hind2は宿主細胞内局在を変化させる遺伝子変異によりRPP4による認識を回避していることが分かりました。
次に、異なる機構にてRPP4による認識を回避している可能性を探索するため、Hind2以外のべと病菌分離株(Waco9、Cala2、Emco5、Maks9)について調べたところ、感染時にHaRxL103遺伝子の発現誘導が見られませんでした(図4)。このことから、これらの分離株ではHaRxL103遺伝子の発現を抑制することでRPP4による認識を回避していることが分かりました。
本研究により、卵菌綱植物病原菌であるべと病菌よりシロイヌナズナの細胞内型免疫センサーにより認識されるエフェクターを同定しました(図5A)。加えて、認識を回避しているべと病菌分離株において、エフェクターの発現を抑制(図5B)、または宿主細胞内での局在を変化させる(図5C)ことにより認識を回避する2種類の機構が明らかになりました。
今後の期待
本研究により、植物と病原菌の攻防における植物の細胞内型免疫センサーによる病原菌エフェクターの認識、および病原菌側の認識回避機構の一端を明らかにしました。農地では、育種により細胞内型免疫センサーを導入した耐病性品種の抵抗性を打破する新たな病原菌系統の出現が問題となっているため、本研究成果は、将来的な病害防除法の開発に貢献することが期待できます。
さらに今回の研究は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)[12]」のうち「2.飢餓をゼロに」に大きく貢献する成果です。
原論文情報
Shuta Asai, Oliver J. Furzer, Volkan Cevik, Dae Sung Kim, Naveed Ishaque, Sandra Goritschnig, Brian J. Staskawicz, Ken Shirasu and Jonathan D.G. Jones, “A downy mildew effector evades recognition by polymorphism of expression and subcellular localization”, Nature Communications, 10.1038/s41467-018-07469-3
発表者
理化学研究所
環境資源科学研究センター 植物免疫研究グループ
客員研究員 浅井 秀太(あさい しゅうた)
グループディレクター 白須 賢(しらす けん)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- エフェクター
- 病原菌が分泌する病原性に関与する因子の総称。主に、タンパク質について用いられることが多い。分泌され機能する場所により、細胞外エフェクター、細胞内エフェクターと呼ばれることがあるが、ここでは宿主の細胞内に分泌される細胞内エフェクターについて言及している。
-
- 細胞内型免疫センサー
- 植物が細胞内に持つ免疫センサーのことで、主に病原菌エフェクターを特異的に認識し、過敏感反応と呼ばれる急速で強力な免疫反応を誘導する。抵抗性遺伝子と呼ばれるほとんどの場合が、細胞内型免疫センサーを指している。
-
- 過敏感反応(HR)、過敏感細胞死(HR細胞死)
- 植物が病原菌による感染の拡大を防ぐための機構であり、感染部位周囲の局所範囲における細胞死を特徴とし、その細胞死はHR細胞死とも呼ばれる。ほとんどの場合、細胞内型免疫センサーが、病原菌エフェクターを認識することにより引き起こされる。HRはhypersensitive responseの略。
-
- 卵菌綱
- 造卵器と造精器による有性生殖を行い、卵胞子を生じるグループのこと。かつては、菌類の1群とされていたが、細胞壁の主成分はセルロースで、菌類(キチン)と異なるなど、形態的に異なることから、現在は別系統と考えられている。
-
- べと病
- 卵菌のうち、ツユカビ科に属する菌による病害に対して名づけられる植物病害のこと。湿度が高い時期に蔓延しやすく、進行すると表面に分生子を形成するため、外見状は霜状の病徴を呈する。
-
- エコタイプ
- 生物が、異なった生育環境に適応して、それぞれ遺伝的な分化が進み、形態や生態に違いが固定されるようになるが、異なる種として分類するには、小さい変異の状態の生物群を指す用語。生殖地の異なるシロイヌナズナでは、DNAレベルで分化が生じており、可視的な形質の分化がみられる。それぞれのエコタイプには名前が付けられ、系統保存されて、研究に用いられている。
-
- 比較トランスクリプトーム解析
- トランスクリプトームとは、特定の状況下において細胞中に存在する全てのmRNAの総体を指す呼称であり、比較することにより、サンプル間での相違を見いだすための解析手法のこと。
-
- 比較ゲノム解析
- 異なる生物の間でゲノムの構造や塩基置換などを比較することにより、それらの進化上の関係、および進化の過程を推定するための解析手法のこと。ここでは、べと病菌エフェクターに焦点を絞り、異なる分離株間での塩基置換などの解析を行った。
-
- クローニング
- 分子生物学において、ある特定の遺伝子を単離して増やすこと。
-
- 核小体
- 真核生物の細胞核の中に存在する、分子密度の高い領域で、リボソームRNAの転写やリボソームの構築が行われる場所のこと。
-
- 核局在シグナル配列(NLS)
- タンパク質を、核膜孔を通して核内へ移行させる配列のこと。ペプチド鎖の内部にあり、塩基性アミノ酸からなる。NLSはnuclear localization signalの略。
-
- 持続可能な開発目標(SDGs)
- 持続可能な開発目標(SDGs)とは、2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標である。持続可能な世界を実現するための17のゴールから構成され、地球上の誰ひとりとして取り残さないことを誓っている。SDGsは発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省のホームページから一部改変して転載)。
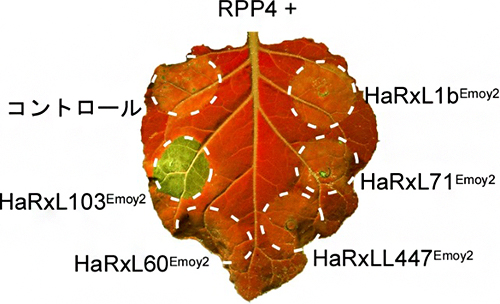
図1 細胞内型免疫センサーRPP4とべと病菌エフェクターを一緒に発現させた際のHR細胞死 タバコ植物において、五つのべと病菌エフェクター候補とRPP4を一緒に発現させたところ、HaRxL103Emoy2が発現した場所で、HR細胞死が観察された。*UV照射下で葉を撮影。細胞死が起きた部位は緑色で強調される。
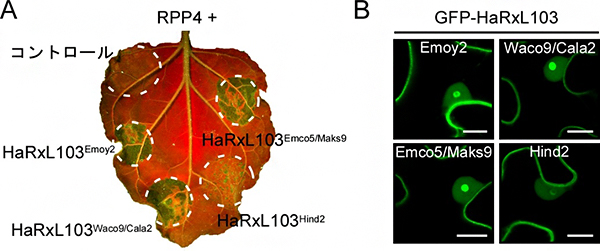
図2 HaRxL103のHR細胞死誘導と植物細胞内局在 A. タバコ植物において、HaRxL103のHind2型(HaRxL103Hind2)とRPP4を一緒に発現させた場所では、HR細胞死が観察されなかった(右下)。*UV照射下で葉を撮影。細胞死が起きた部位は緑色で強調される。 B. Emoy2型、Waco9/Cala2型、Emco5/Maks9型は、植物細胞内において細胞質と核(特に核小体)に局在したが(緑の部分)、HR細胞死を誘導しなかったHind2型は、核小体内に局在する割合が著しく減少していた(右下)。スケールバー:10マイクロメートル(μm、1μmは1,000分の1mm)
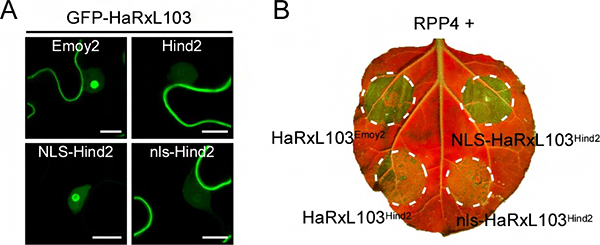
図3 核局在シグナル配列(NLS)を付加したHaRxL103Hind2の細胞内局在とHR細胞死誘導 A. 核局在シグナル配列(NLS)を付加したHaRxL103Hind2(NLS-HaRxL103Hind2)は、植物細胞内において核(特に核小体)内での局在を示した(左下)。nlsは、NLSの塩基性アミノ酸に変異を導入し、NLSとしての機能を失わせたペプチド鎖であり、nls-HaRxL103Hind2はHaRxL103Hind2と同様の細胞内局在を示した。スケールバー:10μm B. タバコ植物において、NLS-HaRxL103Hind2とRPP4を一緒に発現させた場所で、HR細胞死が観察された(右上)。*UV照射下で葉を撮影。細胞死が起きた部位は緑色で強調される。
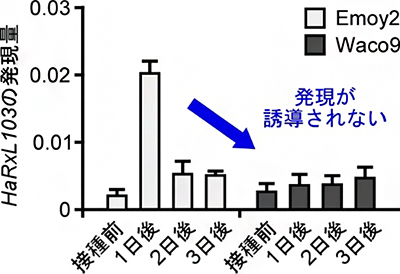
図4 感染時のべと病菌エフェクターHaRxL103の遺伝子発現パターン べと病菌分離株Emoy2では、接種一日後にHaRxL103の発現が誘導されるのに対して、Waco9では発現が誘導されなかった。

図5 べと病菌の細胞内型免疫センサーRPP4による認識の回避機構 A. べと病菌が感染時に注入するエフェクター(HaRxL103)を、核内においてシロイヌナズナの細胞内型免疫センサーRPP4が認識し、免疫応答を誘導する。 B. 認識されるエフェクター(HaRxL103)の発現を抑制することで、RPP4による認識を回避する。 C. 認識されるエフェクター(HaRxL103)が持つ核局在シグナル配列(NLS)内の変異に起因して、植物細胞内での局在を核外へ変化させることにより、RPP4による認識を回避する。