2019-02-26 大阪大学,日本医療研究開発機構
研究成果のポイント
- 腸内細菌が保有するタンパク質が胆汁酸を認識する分子機構を構造レベルで明らかにした。
- 腸内細菌科に属する病原細菌であるサルモネラは、これまで多くの遺伝子の発現が胆汁の存在により影響を受けることが知られていたが、その分子認識機構については不明であった。
- サルモネラは、細胞内レギュレーターであるRamRにより胆汁酸を認識し、その結果、排出タンパク質が発現誘導され、胆汁が存在する環境に適応していることが分かった。新たな感染症治療法や、腸内細菌バランスの制御法開発にも役立つと期待される。
概要
大阪大学産業科学研究所の西野邦彦教授らの研究グループは、腸内細菌科の病原細菌であるサルモネラ※1に存在する制御タンパク質RamRによる胆汁※2酸認識の分子機構を構造レベルで、初めて明らかにしました。
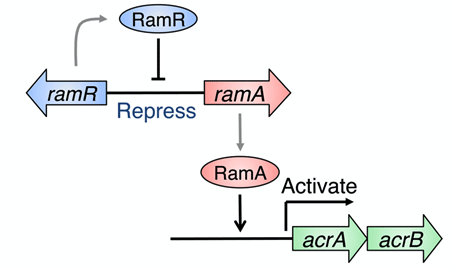
サルモネラは宿主に感染する過程において、小腸や胆嚢を含む胆汁が豊富に存在する環境を経験するとともに、この環境に適応することが感染成立に重要であることが知られています。これまでに、薬剤排出システム※3として知られているAcrAB-TolCが、薬剤耐性化に加えて、サルモネラの胆汁耐性に関与していることが知られていました。この薬剤排出システムの発現は、主に、RamAアクチベーターと、その上流に存在するRamRリプレッサー※4によって制御されています(図1)。
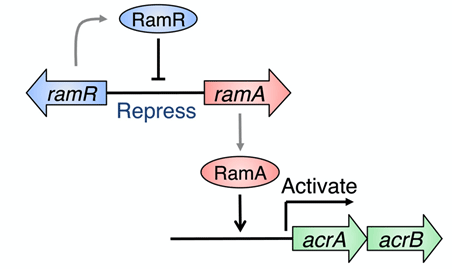
図1.RamR/Aによる薬剤排出システムacrAB遺伝子の制御。
RamRタンパク質(リプレッサー)は、薬剤排出システムacrAB遺伝子オペロンの発現促進因子RamAタンパク質(アクティベーター)をコードしている遺伝子ramAの発現を抑制している。RamRタンパク質は、ramA遺伝子上流に存在する特定DNA配列を認識し、結合することで発現抑制に関与する。
これまでに、西野教授らの研究グループにより、RamRタンパク質が、ベルベリン、クリスタルバイオレット、デカリニウム、臭化エチジウム、ローダミン6Gといった複数の抗菌性物質を認識し、RamAの発現を上昇させ、その結果、これら抗菌性物質の菌体外への排出に関与するAcrAB-TolCの発現を誘導することを明らかにしてきました(Nature Communications 4:2078,2013)。しかし、これらの抗菌性物質は通常、サルモネラが生存している環境、例えば腸内には存在しないことから、RamRは生理的に他の物質を認識している可能性がありました。
今回、西野教授らの研究グループは、胆汁構成成分の内、コール酸とケノデオキシコール酸がRamRタンパク質に結合して、このタンパク質が保有する薬剤排出システムの発現を抑制しているブレーキの機能を解除する機構を明らかにしました。コール酸とケノデオキシコール酸、そしてRamRタンパク質との共結晶構造解析により、これら2つの胆汁構成成分は、以前に明らかにされた抗菌性物質とは異なる機構で認識されていることが分かりました(図2)。コール酸とケノデオキシコール酸の認識には、他の5つの抗菌性物質の認識に必要な155番目のフェニルアラニン残基は関与しておらず、その代わりに、RamRタンパク質中に存在する他の4つのアミノ酸残基(59番目チロシン、85番目トレオニン、137番目セリン、152番目アスパラギン酸)との水素結合が重要であることが分かりました。
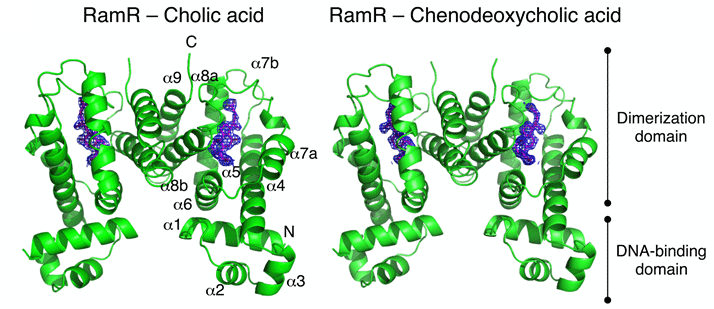
図2.RamRタンパク質とコール酸(左)、ケノデオキシコール酸(右)との共結晶構造。
RamRタンパク質は二量体であり、そこに二分子のコール酸(左)またはケノデオキシコール酸(右)が結合する。この結合により、RamRタンパク質のDNA結合力が低下し、RamAの発現が上昇することにより、薬剤排出システムAcrABの発現が誘導される。
これらの結果から、腸内細菌であるサルモネラは、菌の中に存在するRamRタンパク質によって胆汁成分を認識し、RamAの発現を上昇させ、排出タンパク質AcrAB-TolCの発現を誘導していることが分かりました。AcrAB—TolCは胆汁排出する機能を有することから、このような機構でサルモネラは排出タンパク質の発現を誘導して、胆汁に富んだ環境に適応していることが分かりました。これにより、細菌の腸内環境適応の機構が明らかになるとともに、薬剤耐性菌の克服や、病原細菌の環境適応能を軽減する治療法、そして腸内細菌の新たな制御法開発につながることが期待されます。
本研究成果は、英国科学誌「Scientific Reports」に、1月17日(木)に公開されました。
研究の背景
これまでの研究から、サルモネラの薬剤排出システムAcrABの発現促進因子RamAの発現を抑制するRamRタンパク質は、ベルベリン、クリスタルバイオレット、デカリニウム、臭化エチジウム、ローダミン6Gといった複数の抗菌性物質を認識することを明らかにしていました。一方で、これら化合物は通常、サルモネラが生育する環境には存在しておらず、どのような生理基質をRamRタンパク質が認識しているのかについては、よく分かっていませんでした。
西野教授らの研究グループでは、遺伝子発現解析、化合物とタンパク質との相互作用解析、化合物とタンパク質との共結晶構造解析等の方法により、RamRタンパク質が胆汁酸に含まれるコール酸とケノデオキシコール酸を認識していることを明らかにしました。これは、サルモネラが、宿主感染の場である、小腸や胆嚢等の胆汁が豊富に存在する環境において、RamRタンパク質により胆汁酸を感知し、胆汁排出に関与するAcrAB薬剤排出システムの発現を誘導していることを意味し、このような機構によりサルモネラが宿主環境に適応していることが今回、明らかになりました。また、AcrABは抗菌薬排出に関与することから、宿主環境において、サルモネラの薬剤耐性化が誘導されている可能性も示唆されます。本成果は、薬剤耐性菌の克服や、病原細菌の環境適応能を軽減する治療法、そして腸内細菌の新たな制御法開発につながることが期待されます。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、細菌の胆汁が存在する腸内の環境適応機構が明らかになるとともに、将来的に、薬剤耐性菌の克服や、病原細菌の環境適応能を軽減する治療法、そして腸内細菌の新たな制御法開発につながることが期待されます。
特記事項
本研究成果は、2019年1月17日(木)に英国科学誌「Scientific Reports」(オンライン)に掲載されました。
- タイトル:
- “Crystal structure of the multidrug resistance regulator RamR complexed with bile acids”
- 著者名:
- Suguru Yamasaki, Ryosuke Nakashima, Keisuke Sakurai, Sylvie Baucheron, Etienne Giraud, Benoît Doublet, Axel Cloeckaert and Kunihiko Nishino
なお、本研究は、日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業「多剤排出ポンプ阻害剤開発に関する研究」、日本学術振興会(JSPS)科学研究費補助金事業(若手研究A、基盤研究B、挑戦的萌芽研究)、科学技術振興機構(JST)センター・オブ・イノベーションプログラム(COI)、日本ワックスマン財団学術研究助成、物質・デバイス領域共同研究拠点、人・環境と物質をつなぐイノベーション創出ダイナミック・アライアンス、日本学術振興会(JSPS)二国間交流事業(フランス国立農学研究所[INRA]との共同研究)、フランス地域センターおよび欧州連合(EU)欧州地域開発事業の一環として行われ、大阪大学大学院薬学研究科の山崎優氏、大阪大学産業科学研究所の中島良介特任准教授(常勤)、東北大学情報科学研究科の櫻井啓介学術研究員(当時、大阪大学産業科学研究所特任助教(常勤))、フランス国立農学研究所(INRA)のSylvie Baucheron博士、Etienne Giraud博士、Benoît Doublet博士、Axel Cloeckaert博士の協力を得て行われました。
用語説明
- ※1 サルモネラ
- サルモネラは、ヒトをはじめとして、牛、豚、鶏などの家畜の腸内、また自然環境中に広く存在している細菌。食中毒の原因として問題となる上に、複数の抗菌剤に耐性を示す多剤耐性サルモネラが出現して、本菌の蔓延が国際的な課題となっている。
- ※2 胆汁
- 胆汁は、肝臓から分泌される消化液であり、一般的には脂肪の消化を助けることが知られている。胆汁酸と胆汁色素を含む。胆汁酸は界面活性剤としての性質があり、細菌の細胞膜を溶解する作用により、小腸内や胆管での腸内細菌の生育を妨げる作用を有している。サルモネラは胆汁酸に対しての抵抗性がある。
- ※3 薬剤排出システム
- 細菌の細胞膜に存在する、抗菌薬を排出する活性を有した膜タンパク質であり、薬剤耐性の原因となる。もともと薬剤耐性因子として同定された経緯から薬剤排出の名前が付けられているが、抗菌薬以外にも、色素や界面活性剤の排出にも関与していることが分かっており、細菌における排出システムの生理的役割についても研究が進みつつある。
- ※4 リプレッサー
- 遺伝子の発現を抑制的に調節するタンパク質。RamRリプレッサーは、薬剤排出システムAcrABの発現促進に関係するRamAをコードする遺伝子の上流に存在する特定のDNA配列に結合することで、ramA遺伝子発現を抑制している。胆汁酸や、抗菌薬がRamRに結合すると、本タンパク質のDNA結合能が低下し、RamAの転写活性が上昇し、薬剤排出システムAcrABの発現が誘導される。
研究者のコメント(西野 邦彦 教授)
細菌の薬剤排出システムは、もともと薬剤耐性因子として同定された経緯からこの名前が付いていますが、薬剤が存在しない環境で、これら排出システムがどのような形で、細菌の生存に利用されているのかに興味を持ち、私達のグループは、研究を進めてきました。2001年の時点で、私が論文で発表した、薬剤排出システムのポストゲノム解析においても、胆汁を認識する薬剤排出システムが大腸菌に少なくとも10個存在することを明らかにしていましたが、その当時はまだ、薬剤排出システムは抗菌薬耐性のために存在しているという認識が多くの研究者にあり、生理機能の部分に焦点は当てられていなかったように思います。今回、薬剤排出システムの制御因子の構造を明らかにすることにより、胆汁が存在する環境下で排出システムの発現が誘導され、その環境に適用するため、細菌が排出システムを利用していることが分かりました。細菌には様々な環境に適応するための仕組みが備わっていることに改めて感心するとともに、この成果をもとにして、細菌の新たな人工的制御法の開発に役立てたいと考えています。
本件に関する問い合わせ先
研究内容に関すること
大阪大学 産業科学研究所
教授 西野 邦彦(にしの くにひこ)
プレスリリースに関すること
大阪大学 産業科学研究所 広報室
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
戦略推進部 感染症研究課