霊長類の脳機能メカニズムの解明に向けて
2019-05-22 理化学研究所
理化学研究所(理研)脳神経科学研究センター脳統合機能研究チームの中道友研究員、谷藤学チームリーダーらの共同研究チーム※は、光を使って霊長類の脳の神経回路をトレースする方法「opto-OISI」を開発しました。
本研究成果により、脳のどことどこがつながっているか、つまり脳の情報処理の流れを可視化できるため、これまで難しかった霊長類の脳機能が形作られるメカニズムの解明につながり、また、脳疾患においては、神経回路を踏まえた上での診断や治療が可能になるため、医学への貢献も期待できます。
今回、共同研究チームは、霊長類の脳の神経回路での情報処理の流れを動物が生きた状態のまま高い空間分解能[1]でトレースする方法「opto-OISI」を開発し、視覚野[2]の左右半球間の神経回路を可視化することに成功しました。opto-OISIは、光遺伝学的手法[3]と光内因性信号イメージング(OISI)[4]という手法を併用することにより、0.5mm以下の空間分解能で再現性良く神経回路をマップでき、また可視化できる神経回路の数においても制限がありません。このため、近接する複数の細胞の回路をトレースすることで、これまでの解剖学研究では見つけられなかった詳細な神経回路を、動物が生きた状態のままマップすることに成功しました。
本研究は、英国の科学雑誌『Scientific Reports』オンライン版(4月23日付け:日本時間4月23日)に掲載されました。
※共同研究チーム
理化学研究所 脳神経科学研究センター 脳統合機能研究チーム
研究員 中道 友(なかみち ゆう)
研究員 佐藤 多加之(さとう たかゆき)
大学院生リサーチ・アソシエイト(研究当時) 大久保 甲斐(おおくぼ かい)
チームリーダー 谷藤 学(たにふじ まなぶ)
福島県立医科大学 神経解剖・発生学講座
助教 橋本 光広(はしもと みつひろ)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業 若手研究(B)「TEO-TE野における神経結合の光イメージングと応答特性変換機構の解明(研究代表者:中道友)」、同基盤研究(C)「TE野の神経細胞が表現する図形特徴と受容野の形成メカニズムの解明(研究代表者:中道友)」、同新学術領域研究(研究領域提案型)「スパースモデリングの深化と高次元データ駆動科学の創成(領域代表者:岡田真人)」の研究課題「スパースモデリングから脳における視覚物体像の時空間表現に挑む(研究代表者:谷藤学)」および最先端研究開発支援プログラム(FIRSTプログラム)「心を生み出す神経基盤の遺伝学的解析の戦略的展開(中心研究者:岡野栄之)」の研究課題「Optogenetics-光イメージング法による領野間の機能的マッピング法の開発(代表:谷藤学)」による支援を受けて行われました。
背景
これまでの脳研究により、脳のどの部分が、どのような機能を持っているかについて多くのことが分かってきました。例えば、ヒトやサルなど霊長類の後頭葉にある初期視覚野は、私たちが見た物体イメージの局所的な輪郭や明るさの情報を処理しています。より高次な脳の領域では、このような局所的な情報を統合して、複雑なイメージ、例えば「顔」の情報を処理します。しかし、その統合がどのような神経回路を経て生み出されるかについては、想像の域を出ません。この例のように、単純な情報から認知に関わるような複雑な情報がどのように生み出されるかという問題は、脳研究全般の課題となっています。これは、ヒトを含む霊長類において、単純な情報を担う脳の領域から高次の認知に関わる脳の領域に、どのように情報が流れているかを可視化する一般的な手法がなかったためです。
脳機能のメカニズムを調べるためには、まず脳の情報処理の流れをトレース、つまり領域間でつながっている神経細胞のペアを同定し、その後その神経細胞ペアの特性を詳細に調査する必要があります。神経細胞のペアを同定する最も一般的な手法は解剖学的手法で、神経細胞間を伝って染めることのできる特殊な色素を脳に注入した後、脳を薄く断片にして顕微鏡で観察します。しかし、この手法は色素の注入場所ごとの染め分けが難しく、一度に2、3カ所の神経回路しか見ることができません。また、死後脳を対象としているため、神経細胞ペアの特性を調査できません。
最近では、核磁気共鳴画像法(MRI)[5]を使って脳のどことどこがつながっているかを、動物が生きたままトレースする手法も開発されました注1)。しかし、MRIの空間分解能はおよそ1mm程度で、神経細胞ペアの特性を詳細に調査するには十分ではありません。このため、脳機能のメカニズムを調べるためには、このような問題を解決する新たな神経回路のトレース手法が必要です。
注1)Gerits, A., et al., induced behavioral and functional network changes in primates. Curr. Biol. 22, 1722-1726 (2012).
Ohayon, S. et al, Saccade modulation by optical and electrical stimulation in the macaque frontal eye field. J. Neurosci. 33, 16684-16697 (2013).
研究手法と成果
共同研究チームは、光遺伝学的手法と光内因性信号イメージング(OISI)という手法を併用し、霊長類の脳の神経回路を動物が生きた状態のまま0.5mm以下の高い空間分解能でトレースする方法「opto-OISI」を開発しました。この手法は、ある脳の領域(ソースエリア)から他のある脳の領域(ターゲットエリア)へ情報が流れているとき、ソースエリア内の小さな領域の神経細胞を、光遺伝学的手法で光刺激により活性化させ、ターゲットエリアに流れてきた信号をOISIで記録することにより、光刺激場所とOISI記録部位から神経回路を同定することができます(図1)。
このとき、光刺激する場所ごとの信号をOISIで記録するので、同定する神経回路の数に制限はありません。さらに、OISIの空間分解能はおよそ0.1mmであるため、MRIを用いた手法に比べ高い空間分解能で神経回路をトレースすることができます。
神経細胞を活性化させるために古くから用いられている手法として、微小な電極を脳に挿入し、電流を流す方法があります。しかし、この手法では刺激場所付近に走っている神経細胞の配線も刺激してしまうため、ターゲットエリアへ信号を誤送信してしまう可能性があります。opto-OISIでは、光遺伝学的手法により、光に反応するタンパク質(以下、光感受性タンパク質)が神経細胞の配線以外に発現するよう制御することで、この問題を解決しました(図2)。
また、opto-OISIでは、再現性良く神経回路をトレースできることが分かりました(図3)。実験では、解剖学的にその存在が知られている、サルの初期視覚野の両半球間の神経回路にopto-OISIを適用しました。ソースエリア(右半球視覚野)のある場所で光刺激を行い、ターゲットエリア(左半球視覚野)でソースエリアから流れてきた信号を記録したところ、光刺激を行った範囲に対応する小さな領域で信号が得られました。さらに、同様の実験をその8日後、22日後にも行った場合でも(図3矢印)、別の個体での実験でも、同じく再現性の良い結果が得られました。
さらに、サルの初期視覚野の両半球間において、ソースエリア(右半球視覚野)にて等間隔で5カ所に光刺激を行い、ターゲットエリア(左半球視覚野)でソースエリアから流れてきた信号をそれぞれ記録しました(図4)。その結果、初期視覚野の両半球間の神経回路は対称になっている傾向はあるものの、完全ではないことが分かりました。また、ソースエリアでは複数のターゲットエリアに信号を送っているところや、ターゲットエリアではソースエリアの複数の場所から信号を受け取っているところがあることが新たに分かりました。
今後の期待
本研究では、opto-OISIを開発し、視覚野の左右半球間の神経回路にopto-OISIを適用することにより、手法の有用性と再現性が実証されました。さらに、従来の解剖学研究では見つけられなかった、一つの場所から複数の場所へつながっている神経回路や、複数の場所から一つの場所へつながっている神経回路が存在することを発見しました。
opto-OISIは今後、霊長類の脳においてどのように情報が流れているかを可視化する一般的な手法になり得ます。この手法の普及により、脳の神経回路に関する研究の進展や、脳機能のメカニズムに関わる研究の進展、さらにこれらに関わる脳疾患の診断や治療などにも貢献することが期待できます。
原論文情報
Yu Nakamichi, Kai Okubo, Takayuki Sato, Mitsuhiro Hashimoto, Manabu Tanifuji, “Optical intrinsic signal imaging with optogenetics reveals functional cortico-cortical connectivity at the columnar level in living macaques”, Scientific Reports, 10.1038/s41598-019-42923-2
発表者
理化学研究所
脳神経科学研究センター 脳統合機能研究チーム
研究員 中道 友(なかみち ゆう)
チームリーダー 谷藤 学(たにふじ まなぶ)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 空間分解能
- 装置や手法が検出できる、最小の大きさのこと。例えば、MRI(後述)の空間分解能が1mmであるといったとき、そのMRIは1mm以下の構造を検出できない。
-
- 視覚野
- 脳の大脳皮質で視覚情報の処理を行う領域。今回の実験に使用したのは、初期視覚野(一次視覚野、二次視覚野)という線分や傾きなどの単純な視覚情報を処理する領域で、ヒトやサルの脳では後頭葉(後頭部)に位置する。
-
- 光遺伝学的手法
- 脳に特殊なウイルスを注入し、光に反応するタンパク質を神経細胞に発現させることによって、光により神経細胞の活動を引き起こす、あるいは抑制する技術。
-
- 光内因性信号イメージング(OISI)
- 赤色の光を脳に当て、その反射光の変化をカメラで記録することにより、脳表上の神経活動部位をマップする手法。OISIはOptical Intrinsic Signal Imagingの略。
-
- 核磁気共鳴画像法(MRI)
- 磁場を利用して人体の3次元構造を非侵襲に可視化する技術。MRIを利用して神経活動部位をマップする機能的MRIという手法もあり、脳研究で広く用いられている。MRIはMagnetic Resonance Imagingの略。
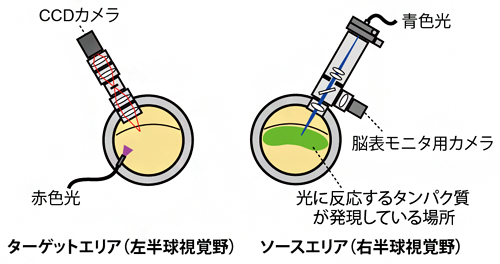
図1 両半球視覚野におけるopto-OISIの概略
光刺激およびOISI記録を行うため、光学窓(図中の灰色のリング)をインプラントし両半球の視覚野を露出している。右半球の視覚野がソースエリア(光刺激側)として光刺激により神経細胞を活性化させ、左半球の視覚野がターゲットエリア(OISI側)としてCCDカメラにより流れた信号を記録する。
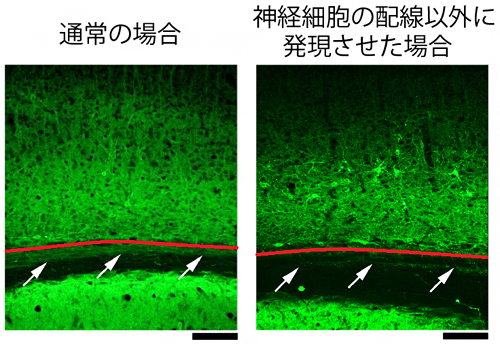
図2 opto-OISIにおける光感受性タンパク質の発現
マウス脳の灰白質(赤線の上側)と白質(赤線の下側)の境界付近の解剖画像。光感受性タンパク質が発現した場所は緑色になっている。白質は神経細胞の配線の束が走っており、通常の場合そこにも光感受性タンパク質が発現するが(左側矢印)、opto-OISIでは、白質では確認できない(右側矢印)。スケールバーは0.1mm。
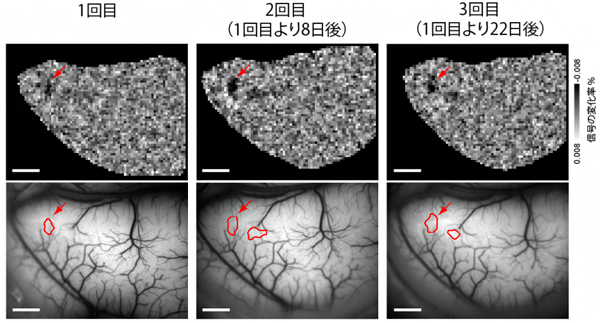
図3 サルのターゲットエリア(左半球視覚野)の神経活動のマップ
ソースエリア(右半球視覚野)のある場所に光刺激を与えたときの、ターゲットエリアで得られた信号のマップ。上段はOISIで得た生信号のマップで、赤い矢印で示した少し暗くなっている領域が強い信号が得られたところである。下段では、その強い信号が得られた領域を、脳表上に赤枠で表している。2回目、3回目の実験は、1回目からそれぞれ8日後、22日後に行った。スケールバーは2mm。
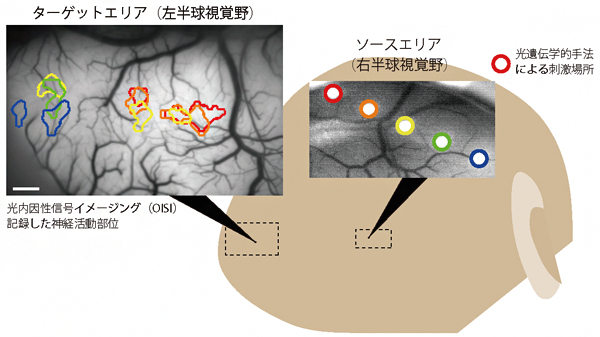
図4 opto-OISIで可視化したサルの初期視覚野における両半球の神経回路
右側の脳表画像がソースエリア(右半球視覚野)で、丸が光刺激をした場所を示している。左側の脳表画像はターゲットエリア(左半球視覚野)で、信号が得られた場所を色枠で示しており、右側のソースエリアでの光刺激の丸の色と対応している。黄色で示したように、ソースエリアの1点からターゲットエリアの複数点へ信号を送る場所や、ターゲットエリア中央(赤、橙、黄の枠が重なった場所)のように、ソースエリアの複数点から信号を受け取る場所が確認できる。スケールバーは1mm。