2020-03-11 理化学研究所
理化学研究所(理研)生命機能科学研究センター老化分子生物学研究チームの農野将功リサーチアソシエイト、宇野雅晴研究員、西田栄介チームリーダーらの共同研究チームは、親世代が獲得したストレス耐性能力が、エピジェネティック情報[1]の組織間伝達を介して次世代に継承されることを発見しました。
本研究成果は、さまざまな環境に適応する能力を速やかに子孫にのこす生物の生存戦略の一つとして、重要な知見となることが期待できます。
今回、共同研究チームは、モデル生物である線虫[2]を用いて、個体のストレス耐性制御において、各組織・臓器がどのように連携するのかについて解析しました。その結果、腸組織でのエピジェネティック変化が生殖腺におけるエピジェネティック変化を誘導し、この組織間コミュニケーションによって、個体のストレス耐性が上昇することを見いだしました。さらに、この腸-生殖腺の組織間コミュニケーションを介して、ストレス耐性の上昇が子世代へ継承されることを明らかにしました。
本研究は、科学雑誌『Cell Reports』(3月10日付:日本時間3月11日)にオンライン掲載されます。
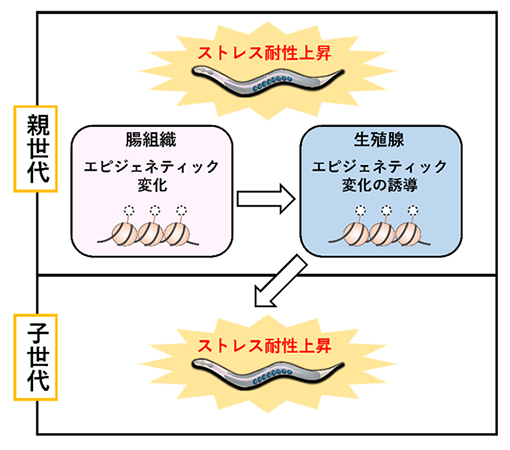
ストレス耐性上昇を子世代に継承させる腸-生殖腺の組織間コミュニケーション
背景
生物は、生体防御機構であるストレス応答[3]を活性化させることで、外界からのさまざまなストレスに適応していると考えられています。近年の研究によって、エピジェネティクス[1]の制御機構が個体のストレス応答において重要な役割を担うことが明らかになりつつあります。エピジェネティクスとは、DNAやヒストン[4]への後天的な化学修飾を通して、塩基配列の変化を伴わずに遺伝子発現が制御される仕組みのことです。個体は環境刺激に対してエピジェネティック修飾を変化させ、遺伝子発現を調節することで、恒常性を維持していると考えられています。
ストレス応答とエピジェネティクス制御については、二つの興味深い現象が知られています。一つは、ある臓器で生じたストレス応答が、個体全身の統合的なストレス応答を誘導すること、もう一つは、環境刺激によって生じたエピジェネティック修飾が世代を超えて伝わることです。これらは、エピジェネティック修飾による個体のストレス耐性制御に、組織・臓器間コミュニケーションと世代間継承の仕組みが備わっていることを示唆しています。
しかし、どの組織・臓器で生じるエピジェネティック修飾がきっかけとなって、個体のストレス耐性を制御するのか、また、そうして獲得されたストレス耐性がどのように次世代に受け継がれるのかという点については、まだ多くのことが明らかになっていません。そこで共同研究グループは、エピジェネティック修飾因子による個体のストレス耐性を制御する組織間コミュニケーションと、世代を超えたストレス耐性の制御メカニズムの解明に迫りました。
研究手法と成果
本研究では、モデル生物である線虫を実験対象に用いました。線虫では、酸化ストレス[3]などのストレス応答に関わるエピジェネティック修飾として、ヒストンのメチル化[5]が知られています。
共同研究チームはまず、このヒストンメチル化を触媒するエピジェネティック修飾因子の中で、酸化ストレス耐性に関わるものを探索しました。その結果、ヒストンH3リジン4トリメチル化(H3K4me3)修飾因子のASH-2タンパク質[5]をコードするash-2遺伝子を全身でノックダウン[6]すると、個体のストレス耐性が大きく上昇することを見いだしました。これは、ヒストンのメチル化が減少すると、ストレス耐性が上昇することを示しています。事実、ヒストンの脱メチル化を触媒する酵素のRBR-2タンパク質[5]をコードするrbr-2遺伝子をノックダウンしてヒストンメチル化の減少を抑制すると、ash-2遺伝子のノックダウンによるストレス耐性上昇の効果は見られなくなりました(図1)。
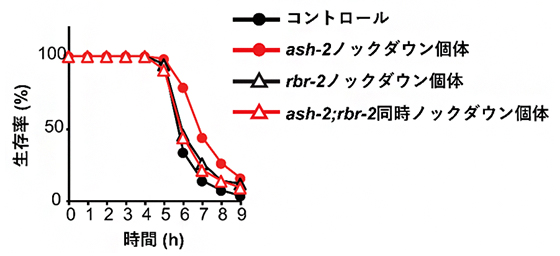
図1 ストレス耐性に関わる因子ASH-2とRBR-2
酸化ストレスである過酸化水素にさらした線虫の生存率を調べた。ash-2遺伝子をノックダウンした個体(赤丸)では、実験開始5時間目からの生存率が、コントロール個体(黒丸)よりも上昇した。この上昇効果は、rbr-2遺伝子を同時にノックダウン(赤三角)するとなくなった。
次に、ash-2遺伝子の欠損によるストレス応答に関わる組織を特定するため、組織ごとにash-2遺伝子をノックダウンする実験を行いました。その結果、腸組織あるいは生殖腺のどちらかでash-2遺伝子をノックダウンすると、個体のストレス耐性が上昇すること、そしてこの効果にはそれぞれの組織でのRBR-2タンパク質の機能(脱メチル化)が必要であることが分かりました。
そこで、腸組織と生殖腺の関係性について明らかにするため、これらの組織が個体のストレス応答に独立に関与するのか、それとも連携して機能を発揮するのかを、腸組織で特異的にash-2遺伝子を欠損させた変異体を用いて解析しました。その結果、腸組織でash-2遺伝子を欠損したときのストレス耐性の上昇に、腸組織だけではなく生殖腺のRBR-2タンパク質も必要であることを見いだしました。また、腸組織で特異的にash-2遺伝子を欠損した線虫は、生殖腺におけるASH-2タンパク質の機能(メチル化)が正常であるにもかかわらず、生殖腺でのヒストンメチル化レベルが減少することを明らかにしました。
これらの結果から、腸組織におけるヒストンメチル化の減少が、生殖腺のヒストンメチル化の減少を誘導するというエピジェネティック情報の伝達機構が存在し、この組織間コミュニケーションによって個体のストレス耐性が上昇することが分かりました。(図2)
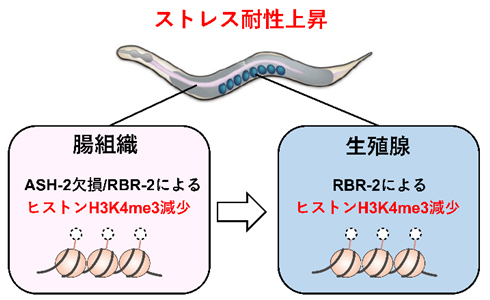
図2 エピジェネティック情報を伝達する腸-生殖腺間コミュニケーションのモデル図
ゲノム編集の手法を用いて腸組織特異的にash-2遺伝子を欠損させると、ASH-2タンパク質の機能欠損によるヒストンメチル化減少の情報が、腸組織から生殖腺へと伝達され、生殖腺において脱メチル化酵素RBR-2の働きによりヒストンH3K4me3の脱メチル化が生じることで、個体のストレス耐性が上昇する。
さらに、親世代の腸組織でのash-2遺伝子の欠損により誘導される生殖腺のエピジェネティック変化が、子世代のストレス耐性に影響を与えるかについて検証しました。その結果、腸組織のash-2遺伝子を欠損した親から産まれた野生型の子世代の線虫は、ASH-2タンパク質の機能(メチル化)は正常であるにもかかわらずストレス耐性が上昇すること、そしてその効果は孫世代まで継承されることを見いだしました。(図3)
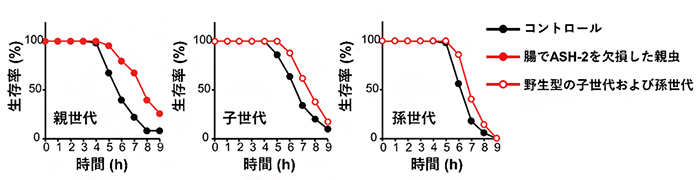
図3 腸組織でASH-2を欠損した親世代の線虫と次世代の線虫のストレス耐性
親世代の腸組織でash-2遺伝子を欠損させた線虫は、ストレス耐性が上昇するが(左: 上昇率23.3%)、そこから産まれてきた野生型の子世代および孫世代の線虫においても、ストレス耐性の上昇が見られた(中央: 上昇率12.6% 右: 上昇率9.1%)。
最後に、腸-生殖腺の組織間コミュニケーションとストレス応答の世代間継承を担う分子メカニズムを解明するため、ストレス応答に関わる既知の因子やash-2遺伝子ノックダウンにより、発現が変化する遺伝子の影響を調べました。その結果、ストレス耐性上昇には、腸組織において転写因子[7]DAF-16が機能していることと、腸組織から分泌されると予想される新たに同定したタンパク質F08F1.3の発現が減少することが必要であることが分かりました。
以上の結果より、腸-生殖腺間におけるエピジェネティック情報の伝達を介して、生存力の向上が子孫へと継承されることが示されました。
今後の期待
本研究成果は、腸組織のエピジェネティック変化が生殖腺のエピジェネティック変化を誘導することで、酸化ストレスに耐性を持つという生存優位性が次世代へと継承されることを初めて明らかにしました。消化器官は、外界から摂取したさまざま物質が集積する場所であり、このような環境変化に晒される腸組織から生殖腺へと情報が伝達されることで、親と子の生存力を向上させるという、生物の生存戦略の一部として機能する可能性が考えられます。
また近年、環境ストレスにより獲得した形質が遺伝する例がさまざまな生物種で報告されつつありますが、そのメカニズムについては未解明な部分が多く、本研究成果で示したエピジェネティック情報の組織間伝達による形質の継承メカニズムは、当該分野において重要な知見となると期待できます。
補足説明
1.エピジェネティクス、エピジェネティック情報
DNAの塩基配列に依存しない遺伝子の調節機構をエピジェネティクスと呼ぶ。エピジェネティクスの分子基盤は、DNAのメチル化やヒストンのメチル化/アセチル化によりゲノムの特定領域に可逆的につけられた「目印」であり、このメチル化やアセチル化の情報をエピジェネティック情報と呼ぶ。
2.線虫
線形動物門に属する体長1mmほどの土壌動物。学名Caenorhabditis elegans。体が無色透明であることから、生きたまま細胞の中を顕微鏡で観察できることや、動物では初めて全ゲノム配列が解読されたこと、発生時の細胞分裂パターン(細胞系譜)が全て分かっていること、遺伝学的な実験手法、遺伝子機能の操作が容易であることなどから、モデル生物として広く利用されている。
3.ストレス応答、酸化ストレス
熱ショック、活性酸素、高浸透圧、紫外線、放射線など、環境からのストレスに対して生体が示す反応。酸化ストレスは、活性酸素によって引き起こされ、脂質やタンパク質が酸化されることによる分子機能の低下、DNAの損傷による遺伝子変異などを招く。本研究では、過酸化水素に晒した線虫の生存率をストレス応答(酸化ストレス耐性)の指標とした。
4.ヒストン
DNAを巻き付けることで、長大なDNAを核内に納める役割を担うタンパク質。代表的なヒストンはH1、H2A、H2B、H3、H4の5種類があり、H2A、H2B、H3、H4の4種類(コアヒストン)が二つずつ集まってヒストン8量体を形成する。
5.ヒストンのメチル化、ASH-2タンパク質、RBR-2タンパク質
ヒストンはメチル化、アセチル化などさまざまな化学修飾を受け、これらがエピジェネティック情報として機能することが知られている。ヒストンのリジン残基またはアルギニン残基に生じるメチル化修飾は、ヒストンメチル化酵素と脱メチル化酵素によって可逆的に制御されており、遺伝子発現を促進または抑制する役割を持つ。ASH-2タンパク質は、ヒストンH3リジン4のメチル化修飾に働くタンパク質複合体の構成因子であり、遺伝子発現(メチル化)を促進することが知られている。逆にRBR-2タンパク質は、ヒストンH3リジン4のメチル基を特異的に脱メチル化する。
6.ノックダウン
mRNAの分解や翻訳抑制などの操作により、遺伝子機能の発現を大幅に低下させること。本研究では、線虫で一般的に用いられるRNA干渉(RNAi)と呼ばれる手法を用いた。
7.転写因子
遺伝子の発現を調節するタンパク質。DNA上に存在する遺伝子のシス転写調節領域に結合し、DNAを鋳型としてRNAが産生(転写)される時期や量を調節する。
共同研究チーム
理化学研究所 生命機能科学研究センター 老化分子生物学研究チーム
研究員 宇野 雅晴(うの まさはる)
リサーチアソシエイト 農野 将功(のうの まさのり)
研究員 岸本 沙耶(きしもと さや)
チームリーダー 西田 栄介(にしだ えいすけ)
京都大学大学院 生命科学研究科 染色体継承機能学分野
准教授 カールトン・ピーター(Peter Mark Carlton)
特別研究員 佐藤・カールトン綾(Aya Sato-Carlton)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(S)「寿命と発生を制御するシグナル伝達ネットワーク(研究代表者:西田栄介)」、同特別研究員奨励費「ストレス耐性上昇を次世代へと継承させる組織間ネットワークの解明(特別研究員:農野将功)」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業ユニットタイプおよび科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「組織・個体・次世代の恒常性を制御するシグナル伝達システムの解明(研究代表者:西田栄介)」による支援を受けて行われました。
原論文情報
Masanori Nono, Saya Kishimoto, Aya Sato-Carlton, Peter Mark Carlton, Eisuke Nishida, and Masaharu Uno, “Intestine-to-Germline Transmission of Epigenetic Information Intergenerationally Ensures Systemic Stress Resistance in C. elegans”, Cell Reports, 10.1016/j.celrep.2020.02.050
発表者
理化学研究所
生命機能科学研究センター 老化分子生物学研究チーム
研究員 宇野 雅晴(うの まさはる)
リサーチアソシエイト 農野 将功(のうの まさのり)
チームリーダー 西田 栄介(にしだ えいすけ)
お問い合わせ先
山岸 敦(やまぎし あつし)
報道担当
理化学研究所 広報室 報道担当