2020-03-18 東京大学
1.発表者
井上純一郎(東京大学医科学研究所 分子発癌分野 教授、アジア感染症研究拠点 北京拠点長)
山本 瑞生(東京大学医科学研究所 分子発癌分野 助教)
合田 仁(東京大学医科学研究所 アジア感染症研究拠点 特任講師)
松田 善衛(東京大学医科学研究所 アジア感染症研究拠点 特任教授)
川口 寧(東京大学医科学研究所 ウイルス病態制御分野 教授、アジア感染症研究拠点 拠点長、研究開発代表者)
2.発表のポイント
◆ 新型コロナウイルス感染症(COVID-19)の原因ウイルス SARS-CoV-2 の感染の最初の段階であるウイルス外膜と、感染する細胞の細胞膜との融合を阻止することで、ウイルスの侵入過程を効率的に阻止する可能性がある薬剤としてナファモスタット
(Nafamostat mesylate、商品名フサン)を同定した。
◆ 本年 3 月初めにドイツのグループはナファモスタットの類似の薬剤であるカモスタット(Camostat mesylate、商品名フォイパン)の SARS-CoV-2 に対する有効性を発表したが(参考文献1)、カモスタットと比較してナファモスタットは 10 分の 1 以下の低濃度でウイルスの侵入過程を阻止した。
◆ ナファモスタット、カモスタットともに急性膵炎などの治療薬剤として本邦で開発され、すでに国内で長年にわたって処方されてきた薬剤である。安全性については十分な臨床データが蓄積されており、速やかに臨床治験を行うことが可能である。
3.発表概要
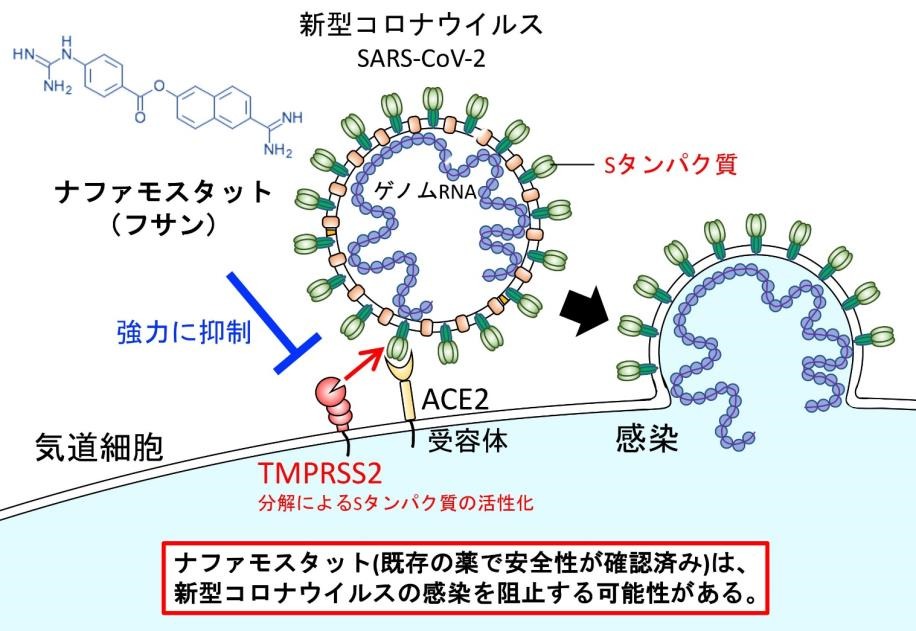
東京大学医科学研究所アジア感染症研究拠点の井上純一郎教授と山本瑞生助教は、新型コロナウイルス感染症(COVID-19)の原因ウイルスである SARS-CoV-2 が細胞に侵入する最初の過程であるウイルス外膜と細胞膜との融合を、安全かつ定量的に評価できる膜融合測定系を用いて、セリンプロテアーゼ阻害剤であるナファモスタットが、従来発表されている融合阻害剤に比べて 10 分の 1 以下の低濃度で膜融合を阻害することを見いだした。
SARS-CoV-2 が人体に感染するには細胞の表面に存在する受容体タンパク質(ACE2 受容体)に結合したのち、ウイルス外膜と細胞膜の融合を起こすことが重要である。コロナウイルスの場合、Spike タンパク質(S タンパク質)がヒト細胞の細胞膜の ACE2 受容体に結合したあとに、タンパク質分解酵素である TMPRSS2 で切断され、S タンパク質が活性化されることがウイルス外膜と細胞膜との融合には重要である。井上らは MERS コロナウイルスでの研究結果(参考文献2)をもとに、ナファモスタットやカモスタットの作用を調べたところ、ナファモスタットは 1-10 nM という低濃度で顕著にウイルス侵入過程を阻止した。このことから、ナファモスタットは SARS-CoV-2 感染を極めて効果的に阻害する可能性を持つと考えられる(本研究は国立研究開発法人日本医療研究開発機構(AMED)による感染症研究国際展開戦略プログラム(J-GRID)の支援を受けた)。
4.発表内容
新型コロナウイルス(SARS-CoV-2)が原因となる感染症(COVID-19)は、2019 年暮れに中国・武漢で世界で初めて患者が確認されてから、2ヶ月あまりで世界 152 カ国に拡散し、世界保健機構(WHO)も 2020 年 3 月 11 日にパンデミックを宣言した。日本では、感染者の多くが無症候性キャリアもしくは軽症であるものの、重症化しさらに高齢者や基礎疾患がある人の場合には死に至ることがある。しかしながら現時点で効果が確認された治療薬は存在せず、その開発は急務である。既に全世界的に SARS-CoV-2 の感染が拡大している現状を鑑みると、安全性が確認された既存の薬から治療薬を探すいわゆるドラッグリポジショニング(注1)は極めて有効と考えられる。
SARS-CoV-2 などのコロナウイルスは、脂質二重層と外膜タンパク質からなるエンベロープ(外膜)でウイルスゲノム RNA が囲まれている。SARS-CoV-2 はエンベロープに存在する Spike タンパク質(S タンパク質)が細胞膜の受容体(ACE2 受容体)に結合したあと、ヒトの細胞への侵入を開始する。S タンパク質は Furin と想定されるヒト細胞由来のプロテアーゼ(タンパク質分解酵素)により S1 と S2 に切断される。その後 S1 が受容体である ACE2 受容体に結合する。もう一方の断片 S2 はヒト細胞表面のセリンプロテアーゼである TMPRSS2(注2)で切断され、その結果膜融合が進行する。 Hoffmann らにより SARS-CoV-2 の感染には ACE2 と TMPRSS2 が気道細胞において必須であることが発表された(参考文献1)。
井上らは、2016 年に MERS-CoV S タンパク質、受容体 CD26、TMPRSS2 に依存した膜融合系を用いてセリンプロテアーゼ阻害剤であるナファモスタットが膜融合を効率よく抑制して MERS-CoV の感染阻害剤になることを提唱した(参考文献2)。そこで今回、293FT 細胞(ヒト胎児腎臓由来:注3)を用いて SARS-CoV-2 S タンパク質、受容体 ACE2、TMPRSS2 に依存した膜融合測定系(注4)を用いて、ナファモスタットが SARS-CoV-2 S タンパク質による膜融合を抑制するかどうか検討した。その結果ナファモスタットは 10 から 1000 nM の濃度域で濃度依存的に抑制した。つぎに ACE2 や TMPRSS2 を内在的に発現し、ヒトで感染が起こるさいに重要な感染細胞と考えられる気道上皮細胞由来の Calu-3 細胞(注5)を用いて同様の実験を行ったところ、さらに低濃度の 1-10 nM で顕著に膜融合を抑制した。この濃度域は MERS-CoV S タンパク質による膜融合に対する抑制濃度域とほぼ同じである。さらに井上らはナファモスタットと類似のタンパク質分解阻害剤であるカモスタットの作用を比較検討したところ、SARSCoV-2 S タンパク質による融合において、ナファモスタットはカモスタットのおよそ 10 分の1の濃度で阻害効果を示すことが明らかになった。
以上から、臨床的に用いられているタンパク分解阻害剤の中ではナファモスタットが最も強力であり、COVID-19 に有効であると期待される。ナファモスタット、カモスタットともに膵炎などの治療薬剤として本邦で開発され、すでに国内で長年にわたって処方されてきた薬剤である。ナファモスタットは臨床では点滴静注で投与されるが、投与後の血中濃度は今回の実験で得られた SARS-CoV-2 S タンパク質の膜融合を阻害する濃度を超えることが推測され、臨床的にウイルスのヒト細胞内への侵入を抑えることが期待される。カモスタットは経口剤であり、内服後の血中濃度はナファモスタットに劣ると思われるが、他の新型コロナウイルス薬剤と併用することで効果が期待できるかもしれない(本研究は国立研究開発法人日本医療研究開発機構(AMED)による感染症研究国際展開戦略プログラム(J-GRID)の支援を受けた)。
5.発表雑誌
本研究の成果は現時点では未発表である。
【参考文献】
1. Hoffmann et al. Cell 181, 1-10 (2020)
2. Yamamoto et al. Antimicrob Agents Chemother 60, 6532-6539 (2016)
6.問い合わせ先:
東京大学医科学研究所管理課総務チーム広報担当
E-mail: koho@ims.u-tokyo.ac.jp
7.用語解説:
(注1)ドラッグリポジショニング:ヒトでの安全性や体内動態が臨床で充分に確認されている既存薬から、新たな薬効を見つけ出し実用化へつなげていこうとする試み。
(注2)TMPRSS2:Transmembrane protease, serine 2。細胞膜に存在するセリンプロテアーゼで SARS-CoV-2 コロナウイルス S タンパク質は宿主受容体に結合後、TMPRSS2 によるタンパク質分解を受けるとされており、このタンパク質による分解を受けないと膜融合能を獲得できない。ナファモスタットは TMPRSS2 活性を阻害することで S タンパク質による膜融合を阻害していると考えられる。
(注3)293FT 細胞:ヒト胎児腎臓由来の不死化細胞株で細胞増殖が速く遺伝子導入が簡便などの優れた性質を持つ。
(注4)膜融合測定系:膜融合測定にはDSP(Dual Split Protein)というレポーターを用いる。DSPは、分割レニラルシフェラーゼと分割GFPのキメラタンパク質(DSP1-7, DSP8-11)でそれぞれ単独では活性を持たないが、分割GFPドメインを介して自己会合しGFP 活性並びにルシフェラーゼ活性を回復する。この特性を用いて、それぞれを別々の細胞に発現させておくと、GFP 活性並びにルシフェラーゼ活性をもとにそれらの細胞間の融合を定量できる。293FT細胞(ヒト胎児腎臓由来)またはCalu3細胞(ヒト気道上皮由来)にDSP1-7, ACE2, TMPRSS2を発現させ、さらに片方の293FL細胞にはウイルスの持つSARS-CoV-2 Sタンパク質とDCP8-11を発現させた。293FT細胞はSARS-CoV-2 Sタンパク質、ACE2、TRMSS2のいずれもそのままでは発現していないことからこれらを人為的に発現させた。Calu3細胞はそのままでACE2とTMPRSS2を発現している。2種類の細胞を同時に培養し、膜融合が起こるとそれぞれの細胞が持っているレポータータンパク質が反応しあって蛍光と光を発することから、定量的に膜融合を観察することができる。この実験系で同定した融合阻害剤の標的がSARS-CoV-2 Sタンパク質、ACE2、TMPRSS2のいずれかであった場合、明確なPOC(Proof of Concept)を有することになる。
(注5)Calu-3 細胞:ヒト肺がんから樹立されたヒト気管支上皮細胞由来の不死化細胞。呼吸器細胞の機能解析に使用されており、SARS-CoV2 や MERS-CoV が実際に感染する細胞のモデルと想定できる。