PPI阻害剤の効率的な創出により創薬の可能性を拡大
2020-10-05 次世代天然物化学技術研究組合,理化学研究所,産業技術総合研究所,第一三共RDノバーレ株式会社,日本医療研究開発機構
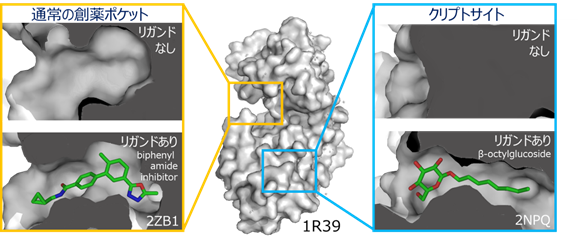
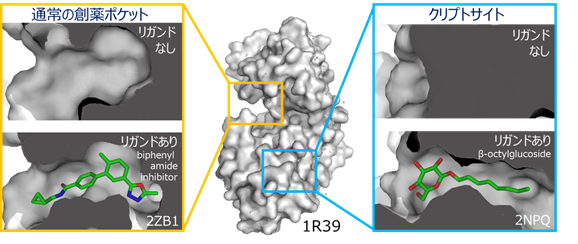
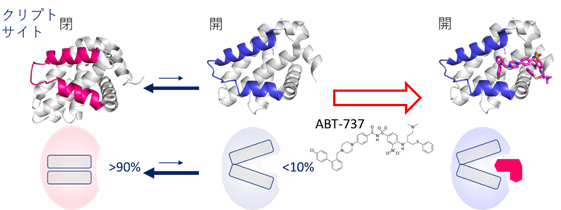
タンパク質―タンパク質相互作用(PPI)(注1)はその生物学的な重要性から、多くの魅力的な創薬標的を含んでいます。一方で、標的となるPPIサイトは、平面的で広いことに特徴があり、リガンドの取得が難しいことから、PPIを標的とした創薬は容易ではありませんでした。近年、タンパク質の構造的柔軟性が、PPIを標的とするリガンドの結合親和性や特異性を決定する重要な要素であるとの認識が広まりつつあります。特に、結合するリガンドが共存しないときには顕わでなく、リガンドが結合すると形成されるポケットは、隠れた薬剤結合部位「クリプトサイト」(注2)と呼ばれ、成功したPPI阻害剤の多くはクリプトサイトに結合する特徴を持っています(図1)。クリプトサイトは、これまで、発見されたリガンドと標的の複合体構造解析により発見されてきました。しかしながら、クリプトサイトをあらかじめ発見・活用する手段が開発できれば、創薬標的の枯渇を解決する切り札の一つになると考えられます。
理化学研究所生命機能科学研究センターおよび次世代天然物化学技術研究組合の嶋田一夫チームリーダー、次世代天然物化学技術研究組合の水越弓子研究員、産業技術総合研究所細胞分子工学研究部門の竹内恒研究グループ長と徳永裕二研究員、第一三共RDノバーレらのグループは、核磁気共鳴(NMR)(注3)技術により、リガンドが結合していない状態において、PPI阻害剤の標的となるタンパク質に僅かな割合で存在するクリプトサイトを同定し、同定したクリプトサイトをリガンド非存在下で安定に存在させる変異体を構築することで、中分子を含むPPI阻害剤の探索を容易にする新たな戦略を確立することに成功しました。このことは、NMR法を用いた構造平衡の制御により、PPIを含め、タンパク質のドラッガビリティを改善できることを示しています。本研究において確立した戦略は、中分子を含む様々なモダリティを活用したPPI阻害剤の探索に広く資するものです。
研究開発のポイント
- 困難であったクリプトサイトの同定を、独自のNMR技術開発により可能にした。
- クリプトサイトを安定化する変異体を、NMR情報から取得することで、中分子を含むPPI阻害剤の探索が容易となり、スクリーニング効率が上昇する新たな戦略を確立することに成功した。
- PPI阻害剤の探索を容易にする本技術は、創薬研究への幅広い貢献が期待される。
研究概要
タンパク質の柔軟な構造変化は、PPI阻害剤の親和性と特異性において、重要な役割を果たすことが知られています。特に、「クリプトサイト」と呼ばれる、普段は閉じているが薬剤が結合したときに形成される隠れた薬剤結合部位は、リガンドの親和性を改善する特徴があることから、その利用が期待されています(図1)。しかしながら、これまでクリプトサイトの多くは、発見されたリガンドと標的タンパク質との複合体構造解析が行われることで、後から偶然発見されることが多く、クリプトサイトをあらかじめ探し当て創薬に活かすことはできていませんでした。
理化学研究所生命機能科学研究センターおよび次世代天然物化学技術研究組合の嶋田一夫チームリーダー、次世代天然物化学技術研究組合の水越弓子研究員ら、産業技術総合研究所細胞分子工学研究部門の竹内恒研究グループ長と徳永裕二研究員、第一三共RDノバーレのグループは、抗がん活性を持つPPI阻害剤ABT-737の標的であり、クリプトサイトが見出されている抗アポトーシスタンパク質Bcl-xLをNMR法により解析し(図2)、リガンドが結合していない状態において僅かな割合で存在するクリプトサイトを同定することに成功しました。さらに、同定したクリプトサイトを安定に存在させる変異体を構築することで、中分子を含むPPI阻害剤の探索を容易にする新たな戦略を確立しました。
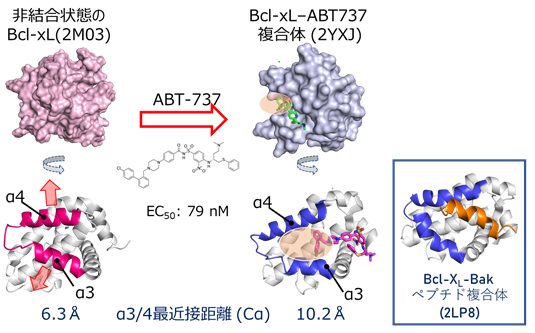
まず、非結合状態における温度依存性解析や緩和分散解析を行ったところ、Bcl-xLは薬剤が結合していない状態でも、クリプトサイトが閉じた構造と開いた構造との平衡にあり、10%以下の低い割合で開いた構造を取ることが明らかとなりました(図3)。また、クリプトサイトの開口にともないアロステリックな化学シフト変化を示したα5/α6へリックス領域に存在するPhe143に着目し、変異導入に伴う化学シフト変化を指標に、クリプトサイトを開口状態に安定化するアロステリック変異体を見出しました(図4A)。見出されたF143W変異体は、構造平衡におけるクリプトサイトが開いた状態の構造の割合が大幅に増大していることが予想され、等温滴定カロリメトリー(ITC)(注4)を用いた結合実験により、本来のリガンドでありクリプトサイトに結合するBakペプチドへの親和性が増大することが明らかとなりました。
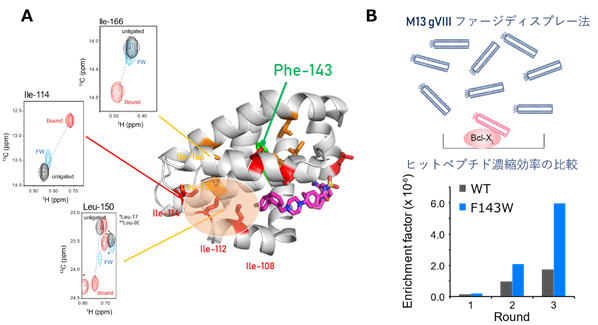
さらにクリプトサイト安定化変異体を用いることで、クリプトサイトに結合するリガンドのスクリーニングを効率化できると考え、ファージディスプレー法(注5)による検討を行いました。その結果、F143W変異体を用いると、野生型よりも結合活性を示すクローンが高頻度で見出され(図4B)、スクリーニング効率が向上することが確認できました。また、得られたペプチドリガンドのNMR滴定実験を行ったところ、野生型のBcl-xLのクリプトサイトに結合していることが示唆されました。このことは、NMR法を用いた構造平衡の制御により、PPI阻害剤の標的タンパク質のドラッガビリティを改善できることを示しています。また、PPIを形成するたんぱく質の約半数がクリプトサイトを持つとの試算もあることから、本研究において確立したクリプトサイトの特定・安定化戦略は、PPI阻害剤の探索に広く資するものと考えられます。
注釈
- (注1)タンパク質―タンパク質相互作用(PPI)
- 生体内に存在するタンパク質間の相互作用のこと。人の細胞には13万~65万のタンパク質相互作用があることが知られており、それらは人の病態とも深くかかわっている。魅力的な創薬標的を多く含むが、これまでに確立したPPI阻害剤は臨床試験が行われているものも含めて30種程度にとどまっている。
- (注2)クリプトサイト
- 隠れた薬剤結合部位であり、リガンドが共存しないときには閉じているがリガンドが共存すると開くように見える特徴を持つ。クリプトサイトに結合するリガンドはより広い結合面を得られるため、活性と特異性が高い特徴がある。
- (注3)核磁気共鳴(NMR)法
- 水溶液に溶けたタンパク質などを、強力な磁場の中におくことで生じる「原子の共鳴現象」を観測することで、溶液中のタンパク質などの分子の構造や運動性の性質を原子レベルで調べることができる分光法。タンパク質試料を水溶液のままで解析できるため、製薬だけでなく、食品、材料、化学などさまざまな分野で活用されている。
- (注4)等温滴定カロリメトリー(ITC)
- リガンドとタンパク質が相互作用する際に発生するわずかな熱をとらえ、定量的にリガンドの結合親和性や結合の熱力学的パラメーターを得ることのできる解析手法。
- (注5)ファージディスプレー法
- ファージゲノムにランダムな配列を持つ遺伝子を組み込むことで、対応するペプチドをファージの外殻に融合タンパク質として提示させ、選択操作により標的タンパク質などに結合するペプチドを選別する方法。考案したスミスらは、2018年にノーベル化学賞を受賞している。
特記事項
※この研究は、日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業」(革新的中分子創薬技術の開発)および「文部科学省科学研究費補助金」の支援によって行われました。
論文情報
- 雑誌名:
- Science Advances
- 論文タイトル:
- Targeting the cryptic sites: NMR-based strategy to improve protein druggability by controlling the conformational equilibrium
- 著者:
- Yumiko Mizukoshi*, Koh Takeuchi*†, Yuji Tokunaga, Hitomi Matsuo, Misaki Imai, Miwa Fujisaki, Hajime Kamoshida, Takeshi Takizawa, Hiroyuki Hanzawa, and Ichio Shimada†
- DOI番号:
-
10.1126/sciadv.abd0480
お問い合わせ先
内容に関するお問い合わせ
国立研究開発法人理化学研究所 生命機能科学研究センター
チームリーダー 嶋田一夫(しまだいちお)
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
創薬事業部 医薬品研究開発課
次世代治療・診断実現のための創薬基盤技術開発事業担当