2021-01-28 京都大学 iPS細胞研究所
ポイント
- 修飾塩基注1)を含む合成メッセンジャーRNA注2)の翻訳注3)を光により制御できる二種類の人工翻訳制御タンパク質(分割型CaVTならびに不安定化CaVT)を開発しました。
- 通常状態では翻訳が低く抑えられている特殊な合成メッセンジャーRNAと分割型CaVTまたは不安定化CaVTを組み合わせることにより、光が照射された細胞選択的に合成メッセンジャーRNAの翻訳を活性化できました。
- 通常状態で効率良く翻訳される合成メッセンジャーRNAと不安定化CaVTを組み合わせることで、光が照射された細胞選択的に合成メッセンジャーRNAの翻訳を抑制できることも確認しました。
1. 要旨
中西秀之プロジェクト助教(現東京医科歯科大学生体材料工学研究所、元京都大学CiRA未来生命科学開拓部門 特定研究員)、齊藤博英教授(CiRA同部門)らの研究グループは、細胞内に導入した合成メッセンジャーRNAからタンパク質への翻訳を光により制御するシステムを開発しました。
このシステムは「光により活性化される低分子化合物」、「活性化された化合物に応答する翻訳制御タンパク質」ならびに「翻訳制御タンパク質に結合するRNAモチーフを有する合成メッセンジャーRNA」の三つにより構成されます。また、外部からの合成メッセンジャーRNA導入は免疫応答を惹起するという問題点がありますが、このシステムで用いる合成メッセンジャーRNAは免疫応答を回避するための修飾塩基を含んでいます。
このシステムにより、光が照射された細胞特異的に合成メッセンジャーRNAからタンパク質への翻訳を活性化または抑制することができました。
合成メッセンジャーRNAはDNAと同様に導入先の細胞において任意の遺伝子を発現させられる一方で、DNAとは異なりゲノムに挿入変位を起こす危険性がありません。そのため、遺伝子治療やワクチンのような医療目的での遺伝子導入において期待が寄せられています。しかしながら、DNAと比べて部位特異的な遺伝子発現の制御が難しく、免疫応答を回避するための修飾塩基を含む合成メッセンジャーRNAの場合は特にそれが顕著でした。本研究の成果は、修飾塩基を含む合成メッセンジャーRNAの翻訳を光照射部位特異的に制御可能にするものであり、これにより疾患部位特異的に治療遺伝子を発現させることで、高い治療効果と正常部位での副作用回避を両立する新しい遺伝子治療に繋がるものと期待できます。
この研究成果は2021年1月28日午前0時30分 (日本時間)に米国科学誌「Cell Chemical Biology」でオンライン公開されました。
2. 研究の背景
外部からの遺伝子導入には一般にDNAが用いられますが、遺伝子治療や再生医療といった医療応用においては、外から導入したDNAが細胞本来のゲノムDNAへと組込まれることでゲノムDNA上に元々存在する内在遺伝子の変異を引き起こしてしまう危険性が懸念されます。
DNAではなく合成メッセンジャーRNAを用いた遺伝子導入では、このような内在遺伝子変異の危険を避けることができます。その一方で、外部からの合成メッセンジャーRNA導入には免疫応答の惹起という別の問題点がありますが、この問題は合成メッセンジャーRNAに修飾塩基を加えることにより回避可能です。
しかしながら合成メッセンジャーRNAからの遺伝子発現には、タンパク質への翻訳を光により部位特異的に制御するのが難しいという別の問題点もあります。特に修飾塩基を含む合成メッセンジャーRNAにおいては、修飾塩基を含まないメッセンジャーRNAで用いられる制御技術が適用できない場合も多く、光による翻訳制御はよりいっそう困難でした。
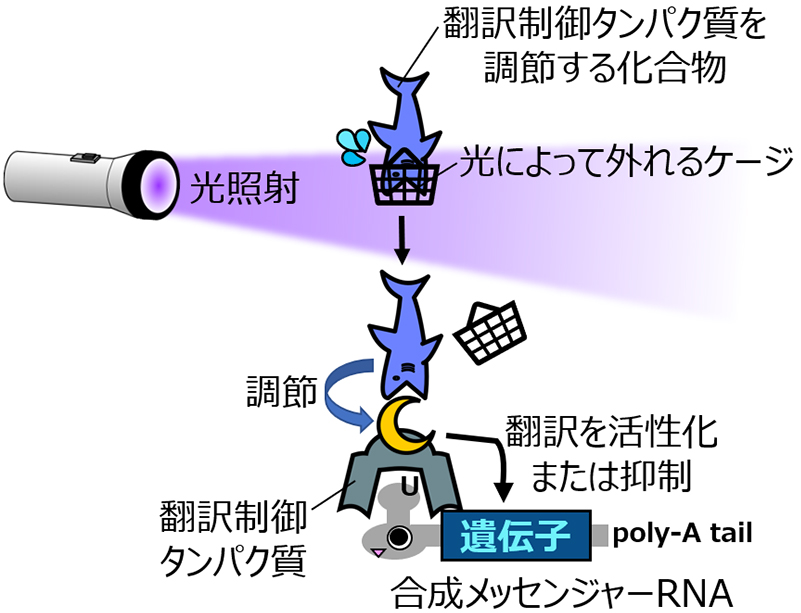
一方、同研究グループでは以前に、修飾塩基を含む合成メッセンジャーRNAの翻訳制御に適用可能な人工翻訳制御タンパク質であるCaliciviral VPg-based Translational activator (CaVT) を開発していました(参考:「合成メッセンジャーRNAからの遺伝子発現を人為的に制御できる 人工翻訳活性化タンパク質〝CaVT (カブト)〟の開発に成功」)。このCaVTは、真核生物のメッセンジャーRNAが持つCap(キャップ)構造を模倣するタンパク質と、制御対象の合成メッセンジャーRNAに特異的に結合するためのタンパク質により構成されます。
真核生物において、メッセンジャーRNAからタンパク質への翻訳は、メッセンジャーRNAが持つCapを真核細胞翻訳開始因子 (eukaryotic Initiation Factor, eIF) が認識することにより開始されます。正常なCapを持たない合成メッセンジャーRNAは効率的に翻訳されませんが、 CaVTはこうした合成メッセンジャーRNAに結合しCapの代わりにeIFに認識されることで、翻訳を活性化することができます(図1)。同グループは以前の研究において、このCaVTを用いることで細胞内状態や薬物に応じた翻訳制御に成功しました。しかしながら、部位特異的制御に適した光による翻訳制御は実現できていませんでした。
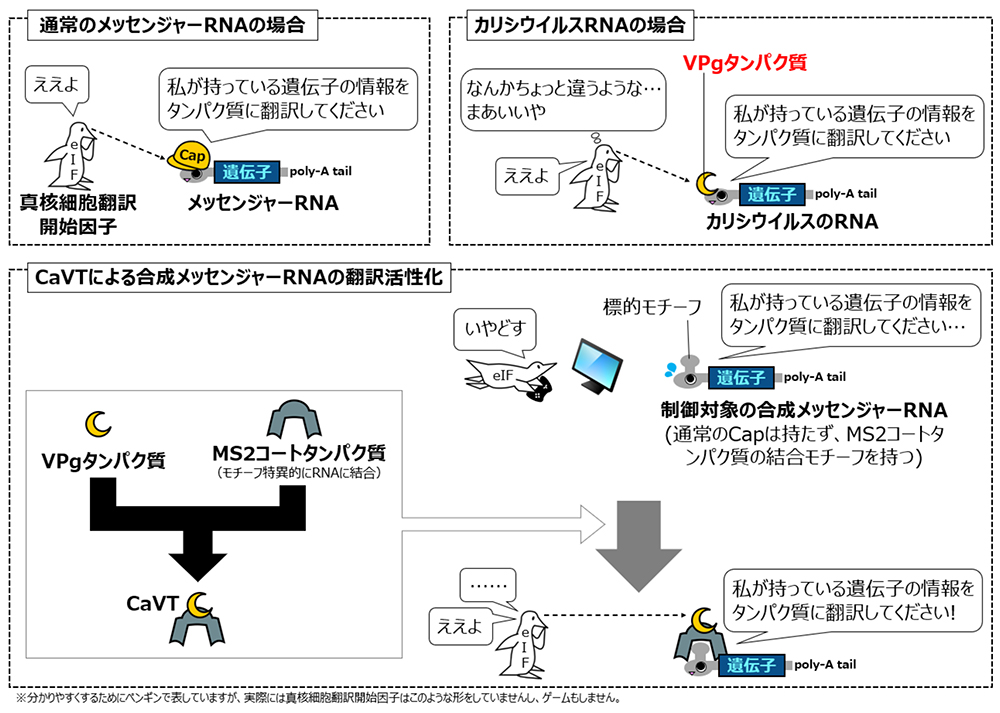
図1:CaVTによる合成メッセンジャーRNAの翻訳活性化
そこで本研究では、CaVTを改変することで、合成メッセンジャーRNAからタンパク質への翻訳を光により制御するためのシステムを開発しました。
3. 研究結果
1)光照射によって再構成される分割型CaVTにより、光照射を受けた細胞特異的に合成メッセンジャーRNAからの翻訳を活性化できました。
オリジナルのCaVTは、異なる機能を持つ二つのタンパク質を融合させることで作られています。一つは、制御対象の合成メッセンジャーRNA上のモチーフに結合する機能を持つ、MS2コートタンパク質(MS2 Coat Protein, MS2CP)と呼ばれるモチーフ特異的RNA結合タンパク質です。そしてもう一つは、結合した合成メッセンジャーRNAの翻訳を活性化する機能を持つ、VPgと呼ばれるCap模倣タンパク質です(図1)。
本研究ではまず、このCaVTをMS2CPとVPgに分割し、これらの分割断片が光照射時にのみ互いに結合して完全なCaVTを再構成するようにすれば、光による翻訳活性化ができるのではないかと考えました。
CaVTの分割断片を互いに結合させるための手法として、研究グループは光により活性化される低分子化合物を利用したタンパク質間結合制御法に着目しました。この手法では、大腸菌由来ジヒドロ葉酸還元酵素(E. coli dihydrofolate reductase; eDHFR)に結合する低分子化合物であるトリメトプリム(Trimethoprim; TMP)を光ケージ注4)により不活化したものと、HaloTagタンパク質に結合する低分子化合物であるHaloTagリガンド(HaloTag Ligand; HL)の融合により得られる光ケージドTMP-HLを用います。
光ケージドTMP-HLは、TMP部分についた光ケージがeDHFRとの結合を妨げるため、光が照射されていない状態ではHaloTagタンパク質にのみ結合します。一方、光照射下では光ケージがTMP部分から外れるため、eDHFRとも結合できるようになり、eDHFRとHaloTagタンパク質がTMP-HLを介して結合した複合体を形成するようになります。
このタンパク質間結合の光制御システムを光による翻訳制御に利用するため、本研究ではMS2CPにeDHFRを融合させたMS2CP-eDHFR、ならびにVPgにHaloTagタンパク質を融合させたHaloTag-VPgを発現する合成メッセンジャーRNAをそれぞれ作製しました。また、制御対象として、正常なCapを持たず、代わりにMS2CPの結合モチーフを持つ合成メッセンジャーRNAも作製しました。
これら三種類の合成メッセンジャーRNAと光ケージドTMP-HLを細胞に加えると、MS2CP-eDHFRの合成メッセンジャーRNAから翻訳されたMS2CP-eDHFRタンパク質は制御対象の合成メッセンジャーRNAに結合します。一方、翻訳活性化能を持つHaloTag-VPgタンパク質はこの段階では制御対象の合成メッセンジャーRNAには結合しません。この状態では、制御対象の合成メッセンジャーRNAの翻訳は抑えられています。ここへ光を照射すると、HaloTag-VPgタンパク質が光ケージの外れたTMP-HLを介してMS2CP-eDHFRと複合体を形成することで制御対象の合成メッセンジャーRNAに対して間接的に結合し、その翻訳を活性化するという仕組みです。
実際に、これらの合成メッセンジャーRNAと光ケージドTMP-HLを用いることで、光を照射した細胞特異的に制御対象の合成メッセンジャーRNAの翻訳を約三倍上昇させることができました(図2)。
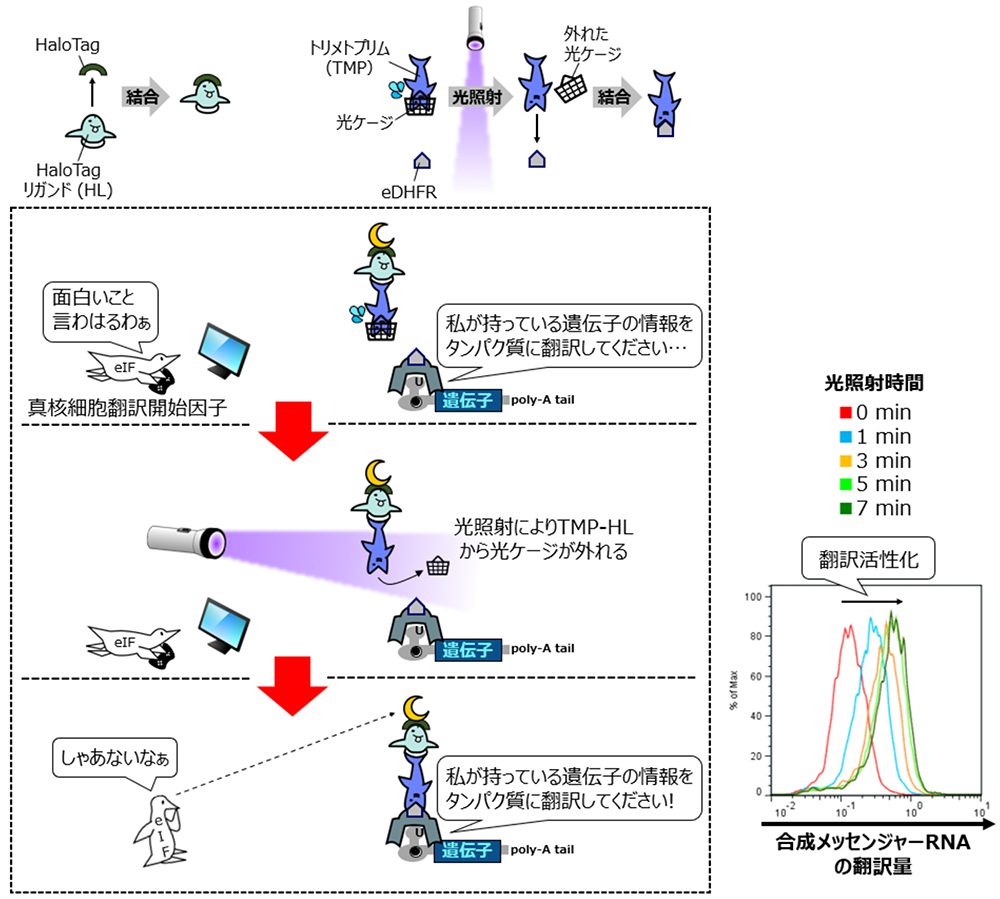
図2:光ケージドTMP-HLと分割型CaVTによる合成メッセンジャーRNAの翻訳活性化
2)光が照射されていない場合は速やかに分解され、光が照射されると分解が抑えられる性質を持つ不安定化CaVTにより、光照射を受けた細胞特異的に合成メッセンジャーRNAからの翻訳を活性化または抑制できました。
CaVTの特徴の一つに、制御対象の合成メッセンジャーRNAが持つMS2CP結合モチーフとの結合力の強さにより翻訳に与える影響が変化するというものが挙げられます。CaVTは、結合力が弱いモチーフを持つ合成メッセンジャーRNAの翻訳を活性化する一方で、結合力が強いモチーフを持つ合成メッセンジャーRNAの翻訳は抑制します。
以前の研究では、CaVTが持つこの性質を利用し、二種類の異なる制御対象合成メッセンジャーRNAのうち片方の翻訳を活性化し、もう片方の翻訳を抑制することで、細胞死やゲノム編集の精密な制御に成功しました。
しかしながら、分割型CaVTでは翻訳活性化の光制御はできても、翻訳抑制の光制御は困難です。なぜなら、翻訳活性化にはVPgが必要でも、翻訳抑制はMS2CPのみでも可能なため、分割型CaVTの片割れであるMS2CP-eDHFRの方は光によるHaloTag-VPgとの結合無しに翻訳抑制を引き起こすからです。
翻訳活性化だけでなく翻訳抑制も光により制御可能にするため、研究グループは次に、TMPにより分解を制御できる不安定化ドメインを融合させた不安定化CaVTを開発しました。この不安定化ドメインを融合させたタンパク質はTMPの非存在下では速やかに分解する一方で、TMPが不安定化ドメインに結合すると分解を抑えられることが知られています。
そこで本研究では、通常のTMPの代わりに光ケージドTMPを用い、これを不安定化CaVTと組み合わせることで、光を照射した細胞でのみ不安定化CaVTの分解を抑えてこれによる翻訳制御を可能とするシステムを開発しました。
まず弱い結合モチーフを持つ制御対象の合成メッセンジャーRNAを不安定化CaVTを発現する合成メッセンジャーRNAとともに細胞に導入し、更に光ケージドTMPを加えたところ、分割型CaVTの場合と同様に光照射による翻訳活性化を誘導できました(図3)。
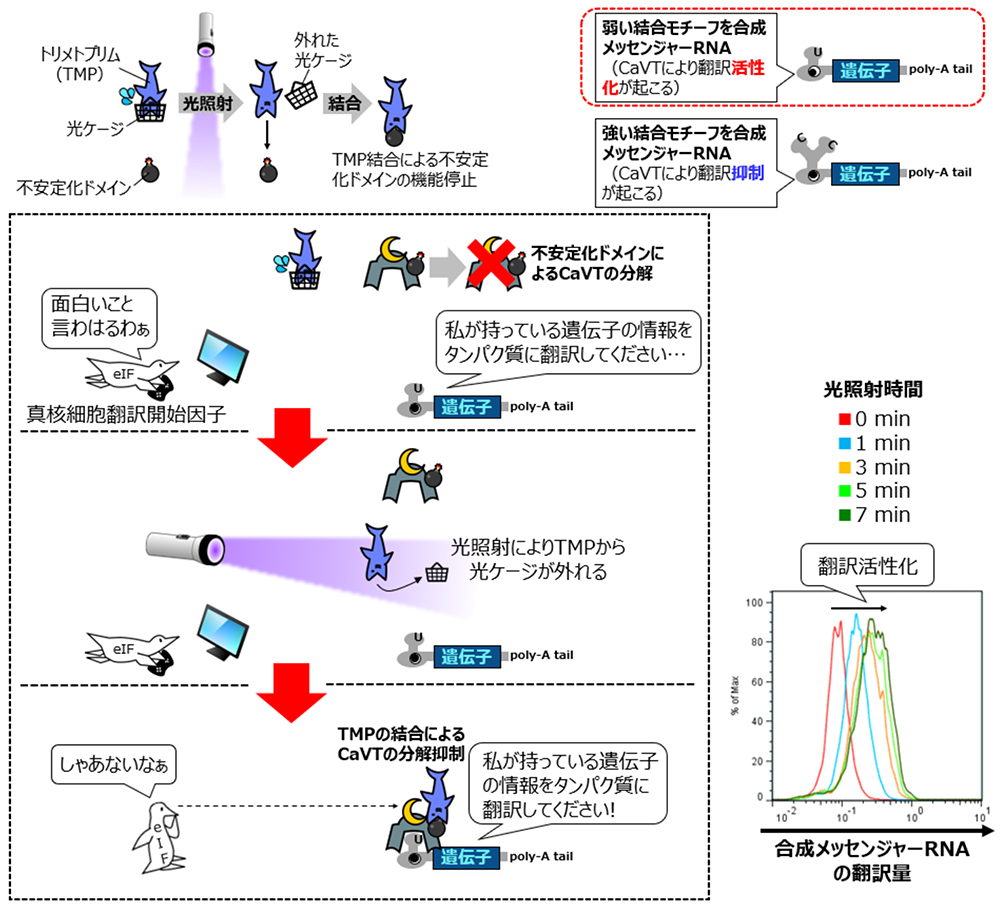
図3:光ケージドTMPと不安定化CaVTによる、弱い結合モチーフを持つ合成メッセンジャーRNAの翻訳活性化
次に、強い結合モチーフを持つ制御対象の合成メッセンジャーRNAを同じ不安定化CaVTならびに光ケージドTMPと組み合わせてみたところ、今度は光照射により翻訳抑制を誘導することができました(図4)。
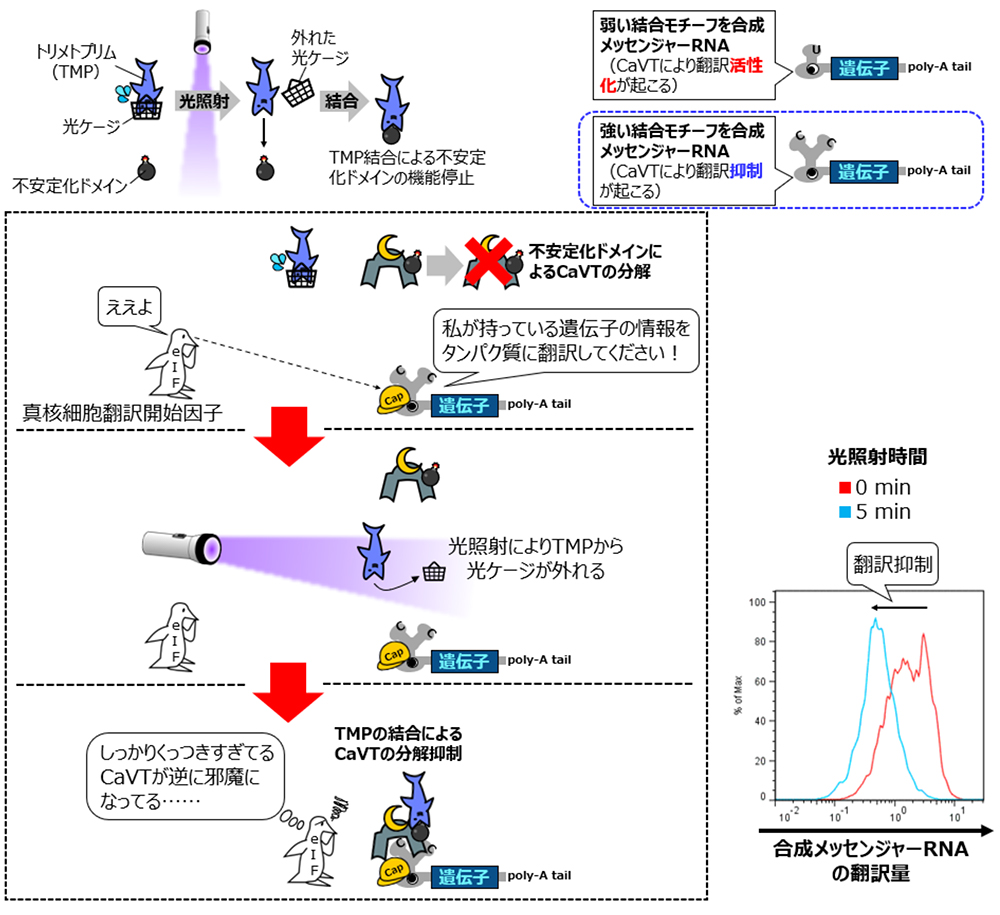
図4:光ケージドTMPと不安定化CaVTによる、強い結合モチーフを持つ合成メッセンジャーRNAの翻訳抑制
これらの結果より、不安定化CaVTは光による翻訳活性化と翻訳抑制の両方を可能にすることが示されました。
3)最適条件における分割型CaVTと不安定化CaVTの翻訳活性化能は同程度でしたが、光照射から翻訳量測定までの時間を短くした場合では分割型CaVTの方が高い翻訳活性化能を示しました。
最後に、分割型CaVTと不安定化CaVTそれぞれによる翻訳活性化効果の比較を行いました。その結果、分割型CaVTと不安定化CaVTは、それぞれの最適条件では同程度の翻訳活性化効果を示しました。その一方で、光照射のタイミングを後ろにずらして光を照射してから翻訳量を測定するまでの時間を短くすると、不安定化CaVTでは翻訳量が大きく低下しましたが、分割型CaVTは不安定化CaVTほどの低下は見られませんでした(図5)。
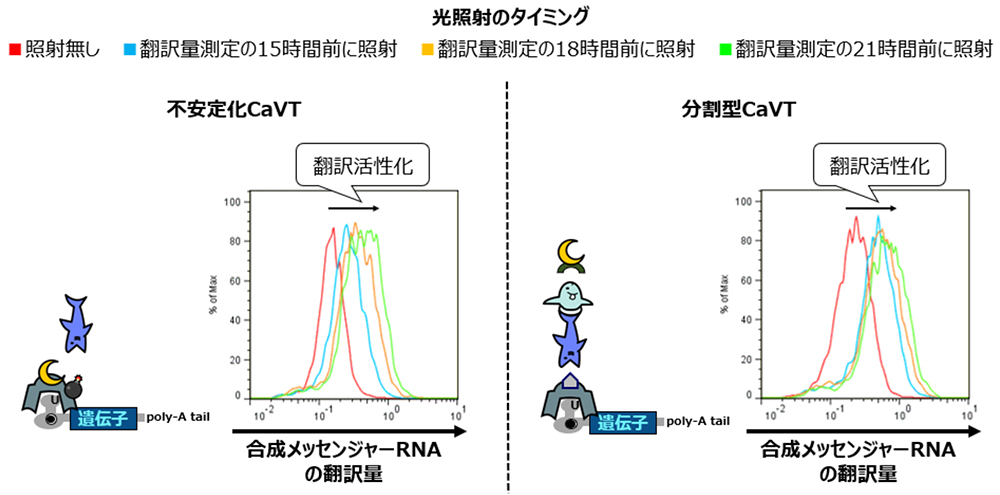
図5:不安定化CaVTと分割型CaVTそれぞれによる翻訳活性化の比較
このような差が生じた原因としては、これら二つのシステムにおける、光照射前に発現したCaVTタンパク質の挙動の違いが考えられます。不安定化CaVTを用いた翻訳活性化システムにおいては、光照射前に発現した不安定化CaVTタンパク質は分解されてなくなってしまうため、翻訳活性化に利用できるのは光照射より後に発現した不安定化CaVTタンパク質のみとなります。一方、分割型CaVTを用いた翻訳活性化システムでは光照射後に発現した各分割断片のタンパク質(MS2CP-eDHFRならびにHaloTag-VPg)だけでなく、光照射前に発現したこれらのタンパク質も光照射後には翻訳活性化に利用できます。
以上のような理由により、分割型CaVTでは光照射のタイミングを遅くした場合であっても迅速に翻訳活性化を開始できるため、不安定化CaVTほどには翻訳活性化効果が低下しなかったのではないかと推察されます。
4. まとめ
本研究では、分割型CaVTならびに不安定化CaVTと名づけた二種類の人工翻訳制御タンパク質を開発し、これらによる合成メッセンジャーRNAの光翻訳制御に成功しました。光による翻訳制御は部位特異的な遺伝子発現を可能にするため、疾患部位特異的な治療遺伝子発現により正常組織での副作用を抑えつつ疾患部位では高い効果を発揮するといった次世代型の遺伝子治療をはじめ、様々な医学・生物学的応用が期待されます。
<研究者のコメント>
修飾塩基を含む合成メッセンジャーRNAは新型コロナワクチンに用いられていることから近年注目を集めていますが、今後はワクチンに限らず様々な医療応用が広がっていくものと期待されます。今回開発した光翻訳制御技術は生体透過性が低い波長の光を使っていることもありすぐに治療に使えるようなものではありませんが、ここで示されたコンセプトを元に高い効果と低い副作用を両立するRNA医薬の開発を目指したいと思います。
5. 論文名と著者
- 論文名
Light-controllable RNA-protein devices for translational regulation of synthetic mRNAs in mammalian cells - ジャーナル名
Cell Chemical Biology - 著者
Hideyuki Nakanishi1,2, Tatsuyuki Yoshii3,4, Shunsuke Kawasaki1, Karin Hayashi1, Keita Tsutsui3, Choji Oki5, Shinya Tsukiji3,5, Hirohide Saito1 - 著者の所属機関
- 京都大学 iPS細胞研究所 (CiRA) 未来生命科学開拓部門
- 東京医科歯科大学 生体材料工学研究所 生体材料機能医学分野
- 名古屋工業大学 生命・応用化学専攻
- 科学技術振興機構 さきがけ
- 名古屋工業大学 共同ナノメディシン科学専攻
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会・文部科学省 科学研究費補助金「若手研究」
- 日本学術振興会・文部科学省 科学研究費補助金「基盤研究S」
- 日本学術振興会・文部科学省 科学研究費補助金「特別推進研究」
- 京都大学教育研究振興財団「研究活動推進助成」
- 内藤記念科学振興財団
- 科学技術振興機構「さきがけ」
- 日本学術振興会・文部科学省 科学研究費補助金「新学術領域研究(研究領域提案型)」
7. 用語説明
注1)修飾塩基
DNAやRNAの構成要素であるアデニンやシトシン、ウラシルといった塩基をメチル基などにより修飾したもの(哺乳類の場合、DNAのシトシン塩基の5位末端の水素(-H)がメチル基(-CH3)に置き換わるDNAのメチル化など)。5-メチルシトシンやシュードウラシル、N1-メチルシュードウラシルなどが挙げられる。修飾塩基の種類にもよるが、こうした修飾塩基を含む合成メッセンジャーRNAは、通常の塩基のみを含む合成メッセンジャーRNAの場合に引き起こされるような免疫応答を回避できることが知られている。
注2)合成メッセンジャーRNA
細胞内における遺伝子発現は、ゲノムDNA上にある遺伝子がまずメッセンジャー(伝令)RNAという分子にコピーされた後、そのメッセンジャーRNA上の情報をもとにタンパク質が作られるという経過をたどる。このメッセンジャーRNAを細胞内ではなく、試験管内で人工的に合成したものを「合成メッセンジャーRNA」と呼ぶ。合成メッセンジャーRNAを細胞内に入れると、通常のメッセンジャーRNAの場合と同様にタンパク質が作られる。
注3)翻訳
遺伝子発現の二つの段階のうち、メッセンジャーRNA上の情報からタンパク質が作られる段階を「翻訳」と呼ぶ。また、DNAからメッセンジャーRNAへと情報がコピーされる段階は「転写」と呼ばれる。
注4)光ケージ
他の分子と反応するのを妨げることで、当該分子を不活化するための保護基。光を照射するとこれが外れ、当該分子が他の分子と反応できるようになる。光ケージにより不活化された化合物を光ケージド化合物と呼ぶ(光ケージドTMPなど)。