癌・難病の新たな治療法へ道
2019-06-19 東京医科歯科大学,科学技術振興機構
ポイント
- 多くの疾患の治療標的分子として注目されているマイクロRNAに対する阻害薬である核酸医薬(アンチミア)を、研究グループが独自に開発した次世代核酸医薬である「ヘテロ2本鎖核酸(HDO)」技術を用いて発展させ、新規の分子構造のHDOアンチミアを開発しました。
- 2本鎖核酸であるHDOアンチミアを用いることにより、従来の1本鎖核酸であるアンチミアのマイクロRNAの抑制効果を、10倍以上も飛躍的に向上させることに成功しました。さらに研究グループはそのメカニズムとして、HDOアンチミア自身が独自に有する細胞内のマイクロRNA分解機構を見いだしました。
- HDOアンチミア技術によって、乳がん・大腸がんなどの多くの癌へのマイクロRNA阻害薬の開発が実現可能になるばかりでなく、アルツハイマー病などの神経難病、統合失調症などの精神疾患、心不全などの心血管疾患などへの広い応用が期待されます。
東京医科歯科大学 大学院医歯学総合研究科 脳神経病態学分野(神経内科)の横田 隆徳 教授、吉岡 耕太郎 特任助教らの研究グループは、大阪大学 大学院薬学研究科 生物有機化学分野などとの共同で、マイクロRNA注1)を標的とした従来の核酸医薬の効果を飛躍的に向上する新技術の開発に成功しました。この研究成果は、国際科学誌「Nucleic Acids Research」に、2019年6月19日(UTC時間)にオンライン版で発表されます。
この研究は科学技術振興機構(JST) 戦略的創造研究推進事業 CREST「新機能創出を目指した分子技術の構築」研究領域(研究総括:山本 尚 教授)における研究課題名「画期的な新規核酸医薬の分子技術の創出」(研究代表者:横田 隆徳 教授)などの支援のもとで行われました。
<研究の背景>
22塩基長前後の短いRNA種の1つであるマイクロRNAは、1マイクロRNAあたり100種以上のメッセンジャーRNAを抑制することで、さまざまな生命現象を調節しています。そして、マイクロRNAの発現や機能の異常は、癌や神経難病といったさまざまな疾患と関連していることが近年報告されています。そのため、癌を中心とした疾患の診断のためのバイオマーカーとしてのマイクロRNAはすでに臨床応用されているばかりでなく、治療標的分子として特に重要視されてきています。そのマイクロRNAを制御する最も有望な手法の1つが、マイクロRNAに特異的に結合し機能を抑制する核酸医薬(アンチミア)注2)です。アンチミアは、DNAやRNAといった天然の核酸分子に加えて、化学修飾をした非天然核酸分子を用いることでマイクロRNAへの認識や安定性を向上させることができ、次々と臨床試験が行われています。しかしながら、その一方で、課題として生体内での有効性が不十分である点があり、毒性も十分には解決されておらず、医療品としての承認認可に至っていません。
本研究グループは従来のメッセンジャーRNAを標的とした1本鎖核酸医薬の効果を大幅に向上できるDNA/RNAヘテロ2本鎖核酸(HDO)注3)を開発(2015年8月11日にプレスリリース)し、東京医科歯科大学発のバイオベンチャーである「レナセラピューティクス株式会社(レナ社)」が設立されました。最近、レナ社から日米の大手製薬企業に次々とヘテロ2本鎖核酸技術がライセンス(2018年12月26日プレスリリース)されています。そこで、研究グループはこれまでのメッセンジャーRNAを標的とした核酸医薬の経験を生かし、新しい種類のRNAであるマイクロRNAの制御能の向上を試みました。
<研究成果の概要>
C型肝炎を対象に臨床試験が行われたアンチミア(ミラベルセン®)と全く同一の1本鎖DNA核酸に対して、相補的なRNA鎖を結合したヘテロ2本鎖核酸(HDO)アンチミアを考案・合成しマウスに静脈注射したところ、HDOアンチミアは従来の1本鎖アンチミアの10倍以上の肝臓内マイクロRNA抑制効果を有することが判明しました。このマイクロRNA制御能の向上は、肝臓ばかりでなく腎臓・脾臓などの多くの臓器でも確認されました(図1)。加えて、1本鎖アンチミアで見られる腎臓の毒性が、HDOアンチミアでは回避されました。
このHDOアンチミアによるマイクロRNA制御のメカニズムを詳しく解析すると、細胞内での効果は大きく向上していることが明らかになりました。さらに興味深いことに、HDOアンチミアは従来の1本鎖アンチミアと異なるマイクロRNA制御メカニズムを有していました。つまり、1本鎖アンチミアは標的のマイクロRNAに直接結合し1対1で機能抑制をするだけであるのに対して、HDOアンチミアは結合するだけでなく、治療標的であるマイクロRNAを分解・消失させる作用も有していました(図2)。
<研究成果の意義>
マイクロRNAは重要な治療標的分子である一方で、実際の臨床応用への大きな課題の1つとして生体内で十分に制御が可能な技術は乏しいことがありました。今回のヘテロ2本鎖核酸技術により、生体内での非常に高効率なマイクロRNA制御が可能になり、製造コスト削減につながります。さらに、投与量を減らすことで副作用の回避も可能です。その結果、マイクロRNA制御核酸医薬の臨床開発が加速され、乳がん・大腸がんなどの多くの癌やアルツハイマー病などの神経難病の画期的な治療につながる可能性を秘めており、さらに心不全の症状改善や脳梗塞の後遺症軽減などの広い臨床応用が期待できます。
<参考図>
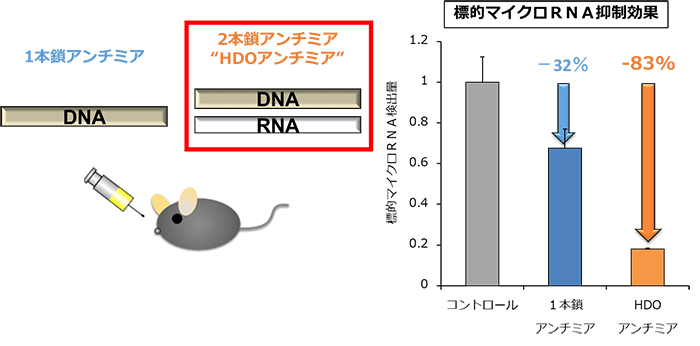
図1
ヘテロ2本鎖核酸技術を発展させた2本鎖アンチミア(HDOアンチミア)をマウスに静脈投与したところ、従来の1本鎖アンチミアの標的マイクロRNA抑制効果を飛躍的に向上させた。
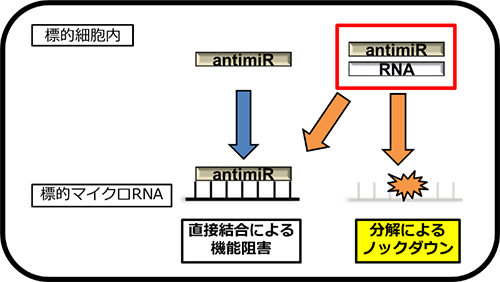
図2
1本鎖アンチミアは標的マイクロRNAに直接結合して機能を阻害するのに対して、2本鎖であるHDOアンチミアは標的マイクロRNA自体を分解することが可能となり、実際に標的のマイクロRNA自体が消失していることが確認され、細胞内メカニズムが決定的に異なる。
<用語解説>
- 注1)マイクロRNA
- 21~25塩基長のRNA(リボ核酸)。特定の遺伝子のメッセンジャーRNA(タンパク質をコードするRNA)を標的とし、その発現や翻訳(タンパク質合成)を阻害することによって遺伝子の発現を抑制することができる。
- 注2)核酸医薬(アンチミア)
- 核酸医薬は天然または非天然の核酸(オリゴヌクレオチド)を基本骨格として利用する医薬品であり、化学合成により製造された核酸分子が直接標的分子に作用する。既存の低分子医薬・抗体医薬では困難であった細胞内RNA分子を標的にすることが可能であり、次世代医薬品として注目されている。その核酸医薬の中でも、マイクロRNAの機能抑制を目的としたものを、特にアンチミアと呼ぶ。
- 注3)ヘテロ2本鎖核酸(HDO)
- 核酸医薬としての活性を有するDNA核酸分子(DNA鎖)に対して相補的なRNA鎖を結合させたDNA/RNAヘテロ2本鎖構造を有する、新規構造の核酸医薬技術。本研究グループが独自に開発し、一般的に核酸医薬の主流であるsiRNA(small interfering RNA)、アンチセンス核酸に続く、第3の核酸医薬技術として注目されている。
<論文タイトル>
“Highly efficient silencing of microRNA by heteroduplex oligonucleotides”
<お問い合わせ先>
<研究に関すること>
横田 隆徳(ヨコタ タカノリ)
東京医科歯科大学 大学院医歯学総合研究科 脳神経病態学分野
<JST事業に関すること>
中村 幹(ナカムラ ツヨシ)
科学技術振興機構 戦略研究推進部 グリーンイノベーショングループ
<報道担当>
東京医科歯科大学 総務部 総務秘書課 広報係
科学技術振興機構 広報課