2021-05-20 慶應義塾大学医学部,北里研究所,日本医療研究開発機構
慶應義塾大学医学部坂口光洋記念講座(オルガノイド医学)の佐藤俊朗教授、杉本真也助教、同内科学(呼吸器)教室の胡谷俊樹特任助教、安田浩之専任講師、北里大学大村智記念研究所(ウイルス感染制御学)の片山和彦教授らの共同研究グループは、新型コロナウイルスの主要な感染巣であるヒトの肺胞の細胞を、オルガノイド培養技術(注1)を用いることで効率的に増殖させる技術を開発し、新型コロナウイルス感染症(COVID-19)治療薬の効果判定を行う評価系を確立することに成功しました。
COVID-19は、2019年に中国武漢で発症が確認されて以来、全世界で猛威を奮っている新興感染症です。しかし、新型コロナウイルスの主要感染巣であり重症化に関与するヒトの正常な肺胞細胞は短期間の体外培養しか行えず、これらを用いた治療薬の効果判定を行うことができないという制限もあり、その治療薬の開発は困難な状況です。
今回、研究グループはヒト組織由来の肺胞細胞をオルガノイドを作成する技術により効率的かつ長期的に培養する方法を確立し、肺胞オルガノイドに新型コロナウイルスを感染させた後に治療候補薬を投与し、経時的なウイルス量の測定により、その治療効果を判定する評価系の構築に成功しました。
本研究で開発された方法は、ヒト正常肺胞細胞の培養方法の確立により、肺胞における新型コロナウイルスの感染状態を体外で再現し、治療薬の効果を直接的に確認することができる方法として、今後COVID-19をはじめとする、肺炎を起こすさまざまな呼吸器感染症の病態解明や治療薬開発に役立つことが期待されます。
この研究成果は、2021年5月19日(米国東部時間)に米科学誌『Cell Reports』のオンライン版に掲載されました。
研究の背景と概要
COVID-19は2019年に中国武漢での発症を皮切りに、日本を含む全世界において猛威を奮い、終息の目処は未だにたっていません。新たな抗ウイルス薬の開発がすすめられていますが、有望な薬剤の開発には至っていません。COVID-19の新規治療薬の開発が難しい要因の一つとして、新型コロナウイルスに対する抗ウイルス薬の効果を体外で判定する方法が確立されていないことが挙げられます。特に、新型コロナウイルスは肺炎による重度の呼吸不全を引き起こすため、酸素の交換を司る肺胞細胞における感染の評価が重要ですが、治療薬の効果判定に使われてきた細胞はアフリカミドリザルの腎臓やヒトの大腸に由来することが多く、ヒトの肺胞を用いた研究はありませんでした。これまでヒトの肺胞細胞を長期に培養する方法は確立されておらず、このことが治療薬の効果判定を新型コロナウイルスの直接の感染巣である肺胞を用いて評価する上での障壁となっていました。
ヒト組織由来の正常肺胞細胞は、シャーレの上で培養する際に、増殖に必要な因子を供給する線維芽細胞との共培養が必須とこれまで考えられていました。しかし、この方法では短期的な体外培養しか行うことができないことに加え、線維芽細胞がシャーレ上に含まれるため肺胞細胞特異的な機能評価を行うことが困難でした。本研究グループは、先行研究で開発したオルガノイド培養技術(Sato T et al. Nature 2009, Sato T et al. Gastroenterology 2011)を応用し、線維芽細胞を用いずに肺胞細胞を立体的なミニチュア臓器としてシャーレの上で効率的に培養することを試みました。さらに、この方法を用いて培養した肺胞細胞に新型コロナウイルスを感染させることで、COVID-19に対する治療薬の効果判定を行う評価系ができるのではないかと考え、本研究を行いました。
研究の成果と意義・今後の展開
ヒト肺胞細胞の線維芽細胞不要の効率的な培養法の確立
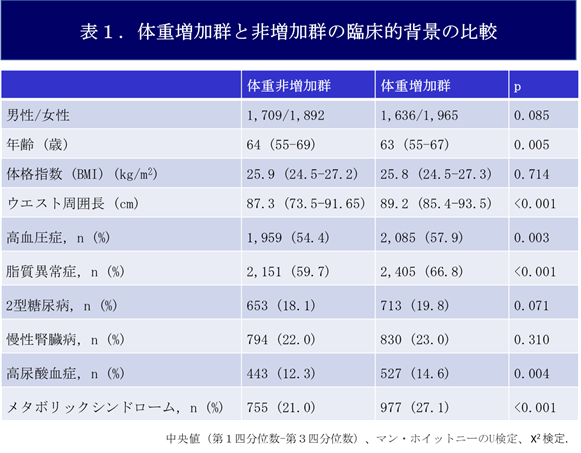
慶應義塾大学医学部の佐藤俊朗教授、杉本真也助教、胡谷俊樹特任助教らの研究グループは、患者肺組織に対して物理的破砕、酵素処理を行った後、蛍光活性化セルソーティング(FACS)という技術を用いてII型肺胞上皮を選択的に採取しました。これらを、オルガノイド培養技術を応用した特定の培養液で培養したところ、肺胞細胞の3次元培養を行うことに成功し、肺胞スフェロイド(注2)と命名しました(図1)。
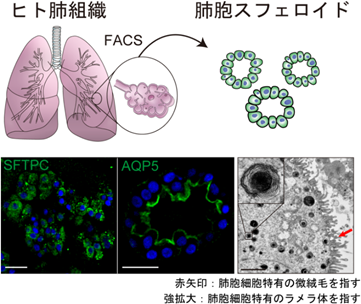
【図1】肺胞スフェロイドの免疫染色像と電子顕微鏡像ヒト肺組織から肺胞細胞をFACSで採取し(上)、肺胞特有のタンパク質(緑)を蛍光染色で確認した(青:細胞核)(左下・中央下)。電子顕微鏡で微絨毛とラメラ体の存在も確認した(右下)。
さらに、それぞれの構成因子を除いた培養液での検討を行うことにより、培養液組成の中の重要な因子の特定を試みました。その結果、肺胞細胞を培養するためにはWnt経路活性化因子およびERK/AKT経路活性化因子が必須であることを突き止めました。しかし、この方法では肺胞細胞の増殖速度は遅く、新型コロナウイルス感染症などの感染実験、治療薬評価を行うには細胞を増やすのに時間がかかる制約がありました。この問題を解決すべく、約10種類の増殖因子のスクリーニングを行った結果、NRG1という因子が肺胞の増殖に重要な役割を果たしており、これを培養液に添加することで約2~3倍の速さでの増殖が可能となることを突き止めました。
肺胞スフェロイドを用いた新型コロナウイルス感染と治療薬評価系の確立
さらに研究グループは、北里大学大村智記念研究所の片山和彦教授、芳賀慧特任助教、戸高玲子助手と共同で、肺胞細胞に対して新型コロナウイルスを直接感染させ、ウイルスが肺胞細胞(肺胞スフェロイド)に持続的に感染すること、ヒト体内での感染応答と同じインターフェロン反応がシャーレ上でも起こることを実証しました。最後にこの感染モデルを用いて、新型コロナウイルスに感染した肺胞細胞に対して治療薬を投与し、経時的にウイルス量を測定することで、治療効果を判定する方法を確立しました。この方法では、以前は効果が期待されながらも大規模臨床試験の結果効果が認められないという結論に至ったロピナビルではウイルスの増殖を抑えられなかった一方、現在では臨床現場でも用いられているレムデシビルが肺胞において抗ウイルス効果を発揮することを確認でき、実際のヒトの臨床を反映していることが明らかとなりました(図2)。
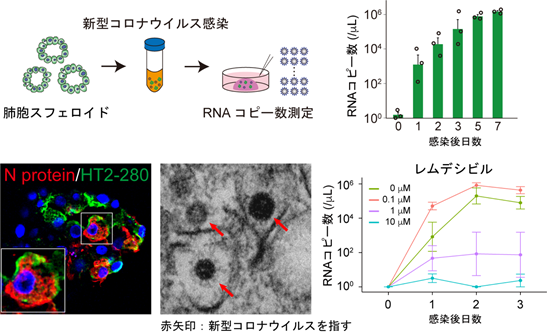
【図2】肺胞スフェロイドにおける新型コロナウイルス感染とレムデシビルの効果肺胞スフェロイドに新型コロナウイルスを感染させると(左上)、日を経るごとにウイルスが増殖した(右上)。肺胞細胞(緑)に新型コロナウイルス(赤)が感染していることを顕微鏡でも確認した(左下・中央下)。レムデシビルを加えることで、新型コロナウイルスの増殖が抑えられた(右下)。
以上より、本研究はヒト正常肺胞細胞の培養方法の確立により、肺胞における新型コロナウイルス感染状態を体外で再現し、治療薬の効果を直接的に確認することができる方法を開発したものであり、今後は新型コロナウイルスをはじめとする、肺炎を起こすさまざまな呼吸器感染症の病態解明や治療薬開発に役立つことが期待されます。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の創薬支援推進事業「新型コロナウイルス感染症(COVID-19)に対するワクチン開発」「新型コロナウイルス感染症の遺伝学的知見に基づいた分子ニードルCOVID-19粘膜免疫ワクチンの開発」、新興・再興感染症に対する革新的医薬品等開発推進研究事業「新型コロナウイルス感染症の重症化阻止を目指した医薬品・次世代型ワクチン開発に必要な遺伝学・免疫学・代謝学的基盤研究の推進」、次世代がん医療創生研究事業「肺癌オルガノイドライブラリー統合解析による癌の不均一性の解明と新規治療標的同定」、革新的がん医療実用化研究事業「肺癌オルガノイドを用いた治療後期肺癌の悪性度の本態解明」、JSPS科研費JP19K08610、COVID-19対策北里プロジェクトの支援によって行われました。
論文
- 英文タイトル
- Direct Derivation of Human Alveolospheres for SARS-CoV-2 Infection Modeling and Drug Screening
- タイトル和訳
- SARS-CoV-2感染モデリングと薬剤スクリーニングのためのヒト肺胞スフェアの直接導出
- 著者名
- 胡谷俊樹、杉本真也、芳賀慧、光石彬史、戸高(高井)玲子、藤井正幸、濱本純子、杉原快、菱田智之、浅村尚生、福永興壱、安田浩之、片山和彦、佐藤俊朗
- 掲載紙
- Cell Reports(オンライン版)
- DOI
- 10.1016/j.celrep.2021.109218
用語解説
- (注1)オルガノイド培養技術
- 従来の培養技術は細胞を二次元のシート状に培養する。オルガノイド培養技術は、細胞を増殖の足場となるジェルの上で増殖因子と呼ばれる細胞を育てるいくつかのスイッチとなるタンパク質を加えることにより、立体的な細胞塊を形成するように培養する。胃、小腸、大腸、膵臓、肝臓などのさまざまな組織の正常およびがん細胞を、生体内での構造を維持したまま培養することが可能である。
- (注2)スフェロイド
- 複数の細胞同士が集合・凝集化した球状の細胞集合体であり、肺胞細胞は慣例的にこのように呼ばれている。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部 坂口光洋記念講座(オルガノイド医学)
教授 佐藤 俊朗(さとう としろう)
北里大学大村智記念研究所 ウイルス感染制御学
教授 片山 和彦(かたやま かずひこ)
慶應義塾大学医学部 内科学(呼吸器)教室
専任講師 安田 浩之(やすだ ひろゆき)
本リリースの配信元
慶應義塾大学信濃町キャンパス総務課:山崎・飯塚
学校法人北里研究所
法人本部総務部広報課
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 創薬企画・評価課