より安全に、より多くの患者にクロザピン治療を行うために
2021-07-07 藤田医科大学
藤田医科大学の二宮光平助教、齋藤竹生講師、岩田仲生(なかお)教授、大阪医科薬科大学の金沢徹文教授、理化学研究所の莚田泰誠(むしろだ たいせい)チームリーダーらは、費用対効果分析を通じ、治療抵抗性統合失調症※1に用いられるクロザピンが誘発する無顆粒球症※2・顆粒球減少症※3のリスク遺伝子:HLA-B*59:01の遺伝子検査が有用であることを明らかにしました。本研究成果は、2021年7月7日付のNature Publishing Groupの一つである「Translational Psychiatry」に掲載されました。
本研究成果のポイント
- クロザピンは治療抵抗性統合失調症に唯一有効な薬剤であるにも関わらず無顆粒球症・顆粒球減少症といった重篤な副作用の危険性があるため、厳格なプロトコールで運用されている
- その煩雑性や、無顆粒球症・顆粒球減少症に対する厳しい中止基準のため、本来受けるべき、あるいは継続できるはずであるクロザピン治療の恩恵を受けられない患者が多かった
- 他方、クロザピン誘発性無顆粒球症・顆粒球減少症を引き起こすリスク遺伝子:HLA-B*59:01は日本人で同定されている
- 本リスク遺伝子の有無をクロザピン治療前に検査しておくことにより、リスクのある患者を事前に把握可能となり、それら患者に対してより手厚くフォローすることで、副作用による治療中止などを減少させ、結果的にクロザピンの恩恵を受けることができる患者が増えると予想される
- 今回HLA-B*59:01の遺伝子検査の有用性について費用対効果分析を実施したところ、効果(クロザピンを継続することにより得られる「生活の質(QOL)」の維持から換算)に対する費用の増加(HLA-B*59:01を同定するための遺伝子検査から換算)は一定程度の金額で収まる結果であった
- すなわち、本遺伝子検査は臨床上有用であることが分かり、早期の臨床応用が期待される
概要
クロザピンは、抗精神病薬でも改善が認められない治療抵抗性統合失調症に対する唯一有効な薬剤ですが、副作用として重篤なクロザピン誘発性無顆粒球症・顆粒球減少症が5%程度認められ、本邦でのクロザピンの使用率は低いことが問題視されていました。本研究の結果は今後、クロザピン治療における遺伝子検査の臨床への足掛かりとなる可能性があります。また、遺伝子検査を行い副作用のリスクを事前に把握することで、厳しく設定されていたクロザピンのモニタリングシステムの緩和も期待することができ、結果的にクロザピンの使用率の増加が期待されます。
研究の手法と成果の概要
「統合失調症」は、思春期以後に発症し、幻覚・妄想といった陽性症状、感情鈍麻・意欲の減退・社会的引きこもりなどの陰性症状、さらには認知機能障害などを特徴とする疾患です。本邦での統合失調症患者は70-80万人であり、その20-30%の患者が統合失調症の治療薬である一般の抗精神病薬で治療を行っても、症状の改善が少ない治療抵抗性統合失調症※1であると推定されています。クロザピンは、その治療抵抗性統合失調症において有用であるとして適応が認められている唯一の薬剤です。しかし無顆粒球症※2・顆粒球減少症※3という、場合によっては重篤にもなる副作用も持ち合わせており、その副作用を未然に防ぐために決められたスケジュールで採血を行い、厳しい中止基準を毎回クリアしなければクロザピンの内服の継続は許されません。また、一度でも基準に引っ掛かると、直ちに内服中止となり、以後再投与のハードルも高くなってしまうという側面もあります。本システムは、薬の副作用で死亡する患者を出さないための必要なシステムではありますが、非常に煩雑であることに加え、精神科医が処方するための心理的抑制がかかること、無顆粒球症・顆粒球減少症による処方中止など、本来受けるべき、あるいは継続できるはずであったクロザピンの恩恵を受けられない現状にあると言えます。
一方でより安全に使用できるように副作用に対する薬理遺伝学・薬理ゲノム学的研究※4がなされ、日本人を対象とした研究でHLA-B*59:01にクロザピンの重篤な副作用であるクロザピン誘発性無顆粒球症・顆粒球減少症と有意な関連があることを我々のグループは報告しています。本研究ではリスク遺伝子であるHLA-B*59:01の臨床的有用性に関し、費用対効果分析を用いて証明することを目的として実施しました。
その背景として、まず押さえておく必要があるのは、HLA-B*59:01の頻度が2-3%と高くはないこと、またクロザピン誘発性無顆粒球症・顆粒球減少症の発症頻度が全体で5.44%と比較的稀な副作用であるということです。これは、臨床応用のための指標である感度(副作用が発現した人において、検査で陽性と判断される割合)が24%と低いことや、陽性的中率(検査で陽性と判断されたものの中で、真に副作用を有する割合)が32.3%と低いことと関係し、「陽性であればクロザピンは使わない」といったようなスクリーニング検査として使用できないことにつながっています。もし検査が陽性となった患者全員に投与しないということになれば、本来ならばクロザピン誘発性無顆粒球症・顆粒球減少症の副作用を被ることなくクロザピン治療を継続できるはずの患者たちがクロザピンの恩恵を受けることができなくなってしまうことになります。もちろん、陽性となった患者群では約1/3がクロザピン誘発性無顆粒球症・顆粒球減少症が発症する可能性があることは事実であるため、投与を行う際に重点的に注意を払うべきハイリスク群であるという事前情報をもたらす検査としては使用可能であるともいえます。その情報(ハイリスク患者の同定)をもとにクロザピン誘発性無顆粒球症・顆粒球減少症を発症させないように、精神科医が細やかにクロザピンの処方を行うことで、クロザピンを継続して内服できる患者を増やせるのではないかと考えました。この「想定(無顆粒球症より軽症である顆粒球減少症の30%を未然に防ぐ)」は証明されているわけではありませんが、実臨床のもとでは十分可能であると思われます。本研究ではこの仮定のもと、実際の処方データなどを用いて費用対効果分析から遺伝子検査がどれだけ有用であるか検討しました。
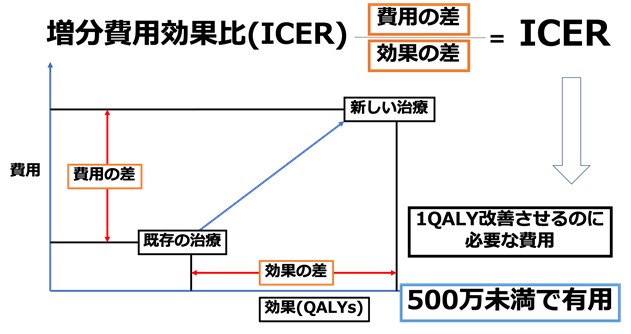 費用対効果分析とは新しい医療行為が既存医療行為と比べて一定の効果があると考えられる場合に、実際に追加費用と、治療効果を様々なシミュレーションモデルを用いて分析する手法です。追加費用に見合った効果があるかどうかを検討するために費用がいくらかかるか、効果がどれだけあるかをシミュレーションで具体的な数字にしていきます。
費用対効果分析とは新しい医療行為が既存医療行為と比べて一定の効果があると考えられる場合に、実際に追加費用と、治療効果を様々なシミュレーションモデルを用いて分析する手法です。追加費用に見合った効果があるかどうかを検討するために費用がいくらかかるか、効果がどれだけあるかをシミュレーションで具体的な数字にしていきます。
効果の指標としては、「生活の質(QOL)」を反映する質調整生存年(以下QALY:EQ-5Dという質問紙でスコア化された値である効用値を生存年数で重み付けした数値)があり、この「QALYを増加させる(すなわちQOLを増加させる)ためのコストはいくらか?」という観点から算出されます。費用対効果分析では、実際の保険点数などから算出された医療費とQALYの比率から算出される指標、増分費用効果比(以下ICER)を使用し評価しました。日本ではICERが約500万円以下であれば増加費用に見合った効果が新しい治療にあると評価されます(図1)。
本研究では、分析期間を10年とし(すなわち10年間クロザピン治療を継続したと仮定します)、現在行われているクロザピン治療の方法(従来治療群)と、遺伝子検査を行いクロザピン誘発性無顆粒球症・顆粒球減少症ハイリスク患者の事前情報を得た状態での治療方法(HLA事前検査群)をシミュレーションし、それぞれ費用と効果を算出しました。その結果として、費用の差は8,511円ほどHLA事前検査群が高いですが、10年あたりのQALYの差は0.00309ほどHLA事前検査群が高いという結果となりました。その差の比率から計算されるICERは2,753,295円であり、有用とされる閾値である5,000,000円を大きく下回ることが分かり、遺伝子検査が有用であることが分かりました。
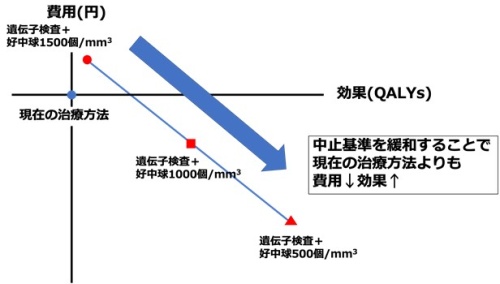 また無顆粒球症・顆粒球減少症のために中止する顆粒球の中止基準は、従来治療群では1,500個/mm3以下と定義されています。この基準を緩めることでも顆粒球減少症の絶対数を減少させることができ、精神科医の心理的抵抗を減弱させることが可能です。そこで、この基準値を1,000個/mm3、500個/mm3と、より緩い場合においてHLA事前検査が有用であるかどうかのシミュレーションを行ってみました。その結果、例えば中止基準が1,000個/mm3以下の場合の、現在用いられている「従来治療群(現在の治療方法)」比べて(青丸)、後者のHLA事前検査を実施する治療群の方が明確に費用対効果が高いことが判明しました(図2:効果も高く、費用も安い)。このことは、中止基準を緩和することでクロザピンの恩恵を受けることができる患者が増え、結果的に費用も少なくなることを反映していると考えられます。究極的に言えば、中止基準を500個/mm3以下にすることが最も費用対効果が良い方法だと言えます。
また無顆粒球症・顆粒球減少症のために中止する顆粒球の中止基準は、従来治療群では1,500個/mm3以下と定義されています。この基準を緩めることでも顆粒球減少症の絶対数を減少させることができ、精神科医の心理的抵抗を減弱させることが可能です。そこで、この基準値を1,000個/mm3、500個/mm3と、より緩い場合においてHLA事前検査が有用であるかどうかのシミュレーションを行ってみました。その結果、例えば中止基準が1,000個/mm3以下の場合の、現在用いられている「従来治療群(現在の治療方法)」比べて(青丸)、後者のHLA事前検査を実施する治療群の方が明確に費用対効果が高いことが判明しました(図2:効果も高く、費用も安い)。このことは、中止基準を緩和することでクロザピンの恩恵を受けることができる患者が増え、結果的に費用も少なくなることを反映していると考えられます。究極的に言えば、中止基準を500個/mm3以下にすることが最も費用対効果が良い方法だと言えます。
研究成果の意義
本結果は、遺伝子検査を事前に実施し、ハイリスク患者を把握することで無顆粒球症・顆粒球減少症の進展を一定程度防げることができるという前提ではありますが(臨床感覚では十分可能であると思われます)、費用の増加分に対して、今までクロザピンの内服を中止せざるを得なかった患者の多くがクロザピンを継続することで生まれるQOLの増加が十分であることを示しました。すなわち、本研究で仮定した遺伝子検査を臨床応用することは、安全性を確保しながらも、治療効果のある患者に適切にクロザピンを投与し続けるということが可能となり、効果的な手段であることを示しています。また、実臨床の中では、クロザピンを使用している間に、中止基準に引っ掛かってしまい、極めて高い治療効果を認めているのにもかかわらず、治療の中断、再投与もできなくなってしまう事例が多く存在していますが(その場合は病状が急激に悪化することがほとんどです)、遺伝子検査を施行することによって、その悲劇を減らすことができるメリットも考えられます。
2021年6月3日よりクロザピンの添付文書改訂により、採血の運用手順が一部緩和されました。クロザピンの処方増加に対し、この改訂は極めて重要ですが、さらに多くの患者にクロザピンの恩恵を感じてもらうためには、本研究で提示したように、遺伝子検査を実装することにより安全を担保しながら中止基準の緩和を検討していくことがクロザピンの処方増加のカギとなると考えます。
用語解説
※1 治療抵抗性統合失調症
「複数の抗精神病薬」を「十分な量」、「十分な期間」服用しても「改善が認められない」ことによって定義され、治療抵抗性統合失調症患者は約15-25万人程度と予測されます
※2 無顆粒球症
血液中の好中球数が500個/mm3未満となり、感染症に対する抵抗力が下がる重篤な病態です
※3 顆粒球減少症
血液中の好中球数が500個/mm3~1500個/mm3となった状態です
※4 薬理遺伝学・薬理ゲノム学的研究
薬の反応性や副作用と関連する遺伝子を、遺伝子配列の比較から突き止めようとする研究
文献情報
雑誌名
Translational Psychiatry
論文タイトル
Cost effectiveness of pharmacogenetic-guided clozapine administration based on risk of HLA variants in Japan and the UK
著者
二宮光平*、齋藤竹生*、池田匡志# (*共同第一著者、#責任著者)