2021-07-26 理化学研究所,北海道大学
理化学研究所(理研)生命医科学研究センターがんゲノム研究チームの大川裕貴研修生、中川英刀チームリーダー、北海道大学大学院医学研究院消化器外科学教室Ⅱの平野聡教授、中村透講師らの国際共同研究グループは、「胆道がん」のさまざまなゲノムデータを集約・解析し、約50%の症例についてゲノム異常に適合する治療薬がある可能性を示しました。
本研究成果は、今後胆道がんの「がんゲノム医療[1]」が拡大する可能性があることを示しており、難治性である胆道がんの薬物治療の臨床試験の進展やその予後改善に貢献するものと期待できます。
今回、国際共同研究グループは、219例の胆道がんのさまざまなゲノム解析により変異データを集約し、それらをアジア人最大規模のがんゲノム知識データベース[2]と照合することで、それぞれのゲノム異常に適合する治療薬を探索しました。その結果、74症例における22個の変異遺伝子について、適合する治療薬を同定することができました。最も多かったのは、PTEN遺伝子の変異に対するPI3K阻害剤[3]、CDKNA2遺伝子の変異に対するCDK阻害剤[4]であり、PIK3CA遺伝子の変異に対するPI3K阻害剤、ERBB2遺伝子の変異に対するHER2阻害剤[5]、FGFR1/2/3遺伝子の変異に対するFGFR阻害剤[6]の適合も同定されました。また、RNAのデータから腫瘍の免疫学的な解析も行い、免疫チェックポイント阻害剤[7]の効果が期待できる胆道がん群(35例)も同定しました。これらの結果を合わせると、約50%の症例において、何らかのゲノム情報と適合する治療薬が存在することが明らかになりました。
本研究は、科学雑誌『Oncotarget』(7月20日付)にオンライン掲載されました。
背景
胆道は、肝臓で産出された胆汁を十二指腸へ輸送する管のことで、途中に胆汁を濃縮し蓄える胆嚢があります。それらの上皮細胞から発生した悪性腫瘍が「胆道がん」であり、発生部位によって、肝内胆管がん、肝門部胆管がん、遠位胆管がん、そして胆嚢がんの四つに分類されます。これらのがんでは、発症リスクや悪性度、予後などの生物学的特性が異なり、治療法も違います。
胆道がんは世界的にみるとまれですが、日本やアジアにおいては発症頻度が高く、日本では、2017年には約2万2500人が発症し、約1万8000人が死亡している、6番目に死亡数の多いがん腫です注1)。長期生存が唯一期待できる治療法は外科的切除ですが、胆道がんは転移や浸潤能が非常に高く、周囲に重要な血管が多数存在する複雑な部位に発生するため、多くの場合根治的手術は困難です。日本肝胆膵外科学会の報告では、胆道がんの切除率は約70~95%とされていますが、これは大規模病院に限られたデータのため、実際にはこの数値よりも大幅に低いと想定されます。外科切除不能の症例や再発時に有効な化学療法や分子標的治療は少なく、5年生存率はわずか27%と極めて難治性のがんです注2)。
がんは「ゲノムの病気」と呼ばれ、近年ゲノム変異を標的とした分子標的治療薬が多数開発されています。2019年から日本においても、がん遺伝子パネル検査などで変異を同定し、その変異に適合した治療薬を投与する「がんゲノム医療」が始まりました。胆道がんにおいては、これまでKRAS遺伝子やTP53遺伝子の変異などさまざまなゲノム異常が発見されていますが、多くのゲノム異常については、それに適合する治療薬がありませんでした。
最近、胆道がんのIDH1遺伝子の変異に対してIDH1阻害剤[8]を、FGFR2融合遺伝子[9]に対してFGFR阻害剤を投与する臨床試験が国内外で行われており、薬剤治療が認可されている国もあります。また、免疫チェックポイント阻害剤を用いた治療がさまざまながん腫に対して行われていますが、胆道がんについては一部を除き、その有効性は証明されていません。
注1)国立がん研究センター がん情報サービス「2019年のがん統計」
注2)日本消化器病学会編『消化器難治癌シリーズ─胆道癌』
研究手法と成果
中川英刀チームリーダーらはこれまで、主に北海道大学病院で手術した219例の胆道がんの切除標本から取り出したDNAやRNAを用いて、ゲノム解析研究を行ってきました注3-4)。今回、それらのゲノム解析データ(全ゲノムシークエンス解析[10]、エクソーム解析[11]、ターゲットシークエンス解析[12]、RNAシークエンス解析[13])を再解析し、胆道がんのゲノム異常データを集約しました。解析症例の内訳は、肝内胆管がん66例、肝門部胆管がん63例、遠位胆管がん49例、胆嚢がんが41例で、半数以上がステージ3以上の進行がんです。
統合的ゲノム解析から、630個の(タンパク質をコードする)遺伝子の小さな変異(SNV/indel)[14]、1,027個のコピー数異常[15]、51個の融合遺伝子の情報が得られました。これらのゲノム異常データを、韓国サムソン病院におけるがんゲノム医療のデータを集約した、アジア人最大規模のがんゲノム知識データベースと照合し、変異と適合する治療薬を探索しました。
その結果、74症例の22個の変異遺伝子について、適合する治療薬の同定に成功しました(図1)。最も多かったのは、PTEN遺伝子のコピー数異常(欠失)に対するPI3K阻害剤(16例)、CDKNA2遺伝子の小さな変異またはコピー数異常(欠失)に対するCDK阻害剤(15例)でした。また多くの症例で、PIK3CA遺伝子の小さな変異またはコピー数異常(増幅)に対するPI3K阻害剤、ERBB2遺伝子の小さな変異またはコピー数異常(増幅)に対するHER2阻害剤の適合も見られました。さらに、FGFR1/2/3遺伝子の融合(構造異常)またはコピー数異常(増幅)が15例(肝内胆管がん9例、肝門部胆管がん1例、胆嚢がん3例、遠位胆管がん2例)で発見され、最近、FGFR2融合遺伝子陽性の肝内胆管がんで使用が承認されたFGFR阻害剤での治療が期待できます。
予後解析においては、PTEN遺伝子とCDKNA2遺伝子のゲノム異常がある胆道がんの予後は悪いことが示されたことから、PI3K阻害剤またはCDK阻害剤による治療が期待できます。
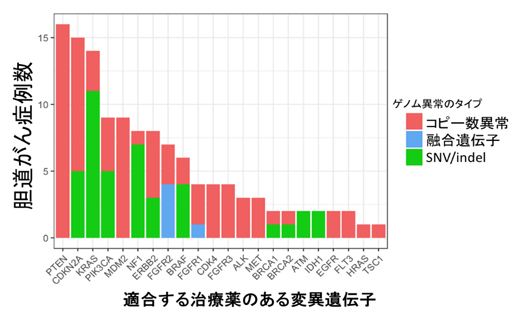
図1 胆道がんにおける薬剤治療の適合が期待される変異遺伝子の頻度
74症例の22個の変異遺伝子について、適合する治療薬が同定された。
次に、免疫チェックポイント阻害剤の反応性について、胆道がんのRNAシークエンス解析のデータから、PD-1/L1遺伝子の発現とがん組織内のT細胞関連遺伝子[16]の発現を解析しました。その結果、PD-1/L1遺伝子の発現が高く、かつT細胞関連遺伝子の発現も高い群(Tリンパ球ががん組織内に存在する群)に35例が分類されました(図2のT cell High 群)。これらの胆道がんの症例には、免疫チェックポイント阻害剤の効果が期待できると考えられます。
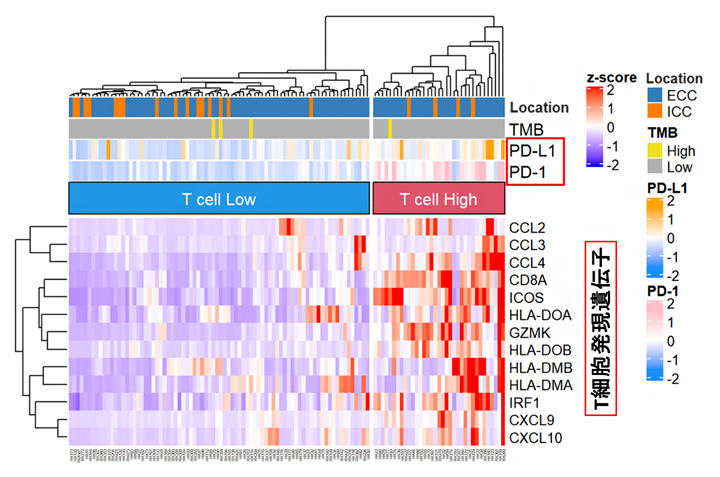
図2 RNA解析による胆道がんの免疫分類
PD-1/L1遺伝子の発現とT細胞関連遺伝子の発現状況に応じて、胆道がんを免疫分類した。赤い帯で示したT cell High 群では、免疫チェックポイント阻害剤の効果が期待できる。
以上の結果を合わせると、47.9%(105例/219例)の胆道がんの症例について、何らかのゲノム情報と適合する治療薬が存在することが明らかになりました。
注3)2018年2月16日プレスリリース「胆道がんの原因遺伝子変異と発生起源細胞を同定」
注4)2021年2月22日プレスリリース「胆のうがんのゲノム異常の解明」
今後の期待
胆道がんの予後は極めて悪く、現在使用できる治療薬は非常に限られています。本研究により、約50%の症例で胆道がんのゲノム変異に適合する治療薬が見つかりました。今後、胆道がんの検査には、がん遺伝子パネル検査や他のゲノム検査が積極的に導入され、変異に適合する分子標的薬または免疫チェックポイント阻害剤を用いたゲノム医療や臨床試験が進展するものと期待できます。
補足説明
1.がんゲノム医療
がん遺伝子パネル検査やがんゲノムプロファイリング検査により、主にがん組織から採取したDNAを用いて多数の遺伝子を同時に調べ、がんのゲノム異常を明らかにした上で、患者一人一人のがんゲノム異常に適した治療を行う医療。日本でも2019年より、がん遺伝子パネル検査が保険収載にて行えるようになった。しかし、ゲノム異常に適合した薬物治療に至るのはまだ全体の10~15%であり、治療薬の選択・投与システムの改善が求められている。
2.がんゲノム知識データベース
患者一人一人のがんゲノム解析から得られるDNA配列情報および診療情報を集約・保管し、それらを利活用してゲノム異常の解釈・臨床的意義付けを行うためのデータベース。日本では、保険診療で行われたがんゲノム医療のデータはがんゲノム情報管理センター(C-CAT)で集約され、がんゲノム知識データベースを構築している。韓国のサムソン病院では、既に10年近くがんゲノム医療を遂行し、膨大な数のがん治療の臨床試験やがんゲノム医療を行っている。本研究では、サムソン病院のゲノム医療プラットフォームCancer SCANと共同で、そこで集約されたアジア人最大規模のがんゲノム知識データベースを活用することで見つかった胆道がんのゲノム異常の解釈を行った。
3.PI3K阻害剤
PI3K(ホスファチジルイノシトール3-キナーゼ)の酵素機能を阻害する薬剤。PI3K /Akt /mTOR経路は、がんの代謝、成長、増殖、転移の制御に重要であり、腫瘍の血管新生やがん関連炎症などの腫瘍促進過程にも関与している。がんゲノム解析により、この経路上の複数の遺伝子(PTEN、PIK3CA、AKT1、TSC1/2など)に高頻度のゲノム異常が生じていることが示されており、さまざまながん腫に対してPI3K阻害剤の臨床試験が行われている。
4.CDK阻害剤
細胞周期を制御するCDK4/6(サイクリン依存性キナーゼ 4と6)の酵素機能を阻害し、細胞周期の進行を停止させる薬剤。乳がんにおいて治療が承認されている。CDK遺伝子のコピー数増幅や、CDKの抑制機能を持つCDKNA2遺伝子(p16遺伝子)の欠失や変異が治療薬の効果と関連するという報告がある。
5.HER2阻害剤
受容体型チロシンキナーゼ(上皮成長因子受容体)の一種であり、上皮細胞の増殖と分化に関わるHER2(ERBB2)の酵素機能を阻害する薬剤。HER2遺伝子(ERBB2遺伝子)の増幅や高発現が見られる乳がんや胃がんにおいて、HER2阻害剤または細胞外の部分に対する抗体薬の治療が行われる。
6.FGFR阻害剤
FGFR(線維芽細胞増殖因子受容体)は、細胞や組織の増殖や分化の過程において重要な役割を果たす膜貫通型の受容体型チロシンキナーゼであり、FGFR1~4の4種類がある。FGFR阻害剤はFGFR1~3のキナーゼ機能を阻害する薬剤。肝内胆管がんの5~10%ほどに、FGFR2遺伝子の融合(構造異常)が見られ、FGFR阻害剤の治療が承認されている。
7.免疫チェックポイント阻害剤
がん細胞を攻撃するTリンパ球に発現して、がんに対する免疫を抑制している免疫チェックポイント分子PD-1に対する抗体薬。がん細胞自体もTリンパ球の攻撃力を抑制するチェックポイント分子PD-L1を発現しており、PD-L1はPD-1へ信号を送り、Tリンパ球の機能を抑制する。PD-L1に対する抗体薬も承認されている。免疫チェックポイント阻害剤による治療は、肺がん、腎がん、胃がん、肝がんなど多くのがんで承認されている。胆道がんについては、数%を占めるマイクロサテライト不安定性(MSI)陽性の症例について、治療が承認されている。
8.IDH1阻害剤
IDH1(イソクエン酸デヒドロゲナーゼ1)遺伝子の変異は、がんを引き起こす2-ヒドロキシグルタル酸を蓄積させ、肝内胆管がんの20%程度に見られるともいわれている。IDH1阻害薬は、IDH1遺伝子変異を持つがん細胞に特異的に作用し、既にIDH1遺伝子変異を持つ急性骨髄性白血病に対して米国で承認されている。今回の日本人の解析では、2例の胆道がんにしか変異が確認されなかった。
9.融合遺伝子
数百~数百万塩基にわたって、ゲノム配列が大きく改変することゲノム構造異常という。構造異常によって、別々の遺伝子が融合して発現してくることがある。ALK遺伝子、BRAF遺伝子、FGFR遺伝子など、さまざまながん治療標的遺伝子の融合遺伝子が報告されている。
10.全ゲノムシークエンス解析
次世代シークエンサーを用いて個人(約30億塩基)やがんの全ゲノム情報を解読し、配列の違いや変化を同定するゲノム解析手法。タンパク質をコードするエクソン部分だけでなく、遺伝子の発現を制御するゲノム領域の変異やさまざまな構造異常(大きなゲノム配列異常)も検出可能である。
11.エクソーム解析
ゲノムの中のタンパク質に関する情報が書き込まれているエクソン部分(ゲノム全体の1~2%)のDNA配列を、次世代シークエンサーを用いて包括的に解析する方法。
12.ターゲットシークエンス解析
数十~数百のがん関連遺伝子について、次世代シークエンサーを用いて解析する方法。
13.RNAシークエンス解析
RNAからcDNAに変換してシークエンスを行い、遺伝子の発現や融合遺伝子の検出を行う。
14.小さな変異(SNV/indel)
一塩基~数塩基のゲノム配列の変化のこと。SNV(一塩基バリアント)は塩基配列中の一塩基変異を指す。indelは一塩基~数塩基の挿入または欠失変異を指す。
15.コピー数異常
正常のゲノムは2コピー(父方由来と母方由来)あるが、がんゲノムでは、一部のゲノム領域や染色体に欠失(1コピーまたは0コピー)や増幅(4コピー数以上)が起きる。一般的には、がん抑制遺伝子は欠失領域に、がん(化)遺伝子は増幅領域に位置している。
16.T細胞関連遺伝子
ここでは、がん細胞を直接攻撃する細胞障害性Tリンパ球に特異的に発現している遺伝子のことを指す。
国際共同研究グループ
理化学研究所 生命医科学研究センター がんゲノム研究チーム
研修生 大川 裕貴(おおかわ ゆうき)
チームリーダー 中川 英刀(なかがわ ひでわき)
北海道大学大学院 医学研究院 外科学分野 消化器外科学教室Ⅱ
教授 平野 聡(ひらの さとし)
講師 中村 透(なかむら とおる)
大学院生 江畑 信孝(えばた のぶたか)
韓国サムソンメディカルセンター ゲノム研究所/GENINUS
所長 パク・ウーヤン(Park Woong-Yang)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(A)「肝胆膵がんの多元的オミックス解析による分子機構の解明(研究代表者:中川英刀)」の助成を受けて行われました。
原論文情報
Yuki Okawa, Nobutaka Ebata, Nayoung KD Kim, Masashi Fujita, Kazuhiro Maejima, Shota Sasagawa, Toru Nakamura, Woong-Yang Park, Satoshi Hirano, and Hidewaki Nakagawa, “Actionability Evaluation of Biliary Tract Cancer by Genome Transcriptome Analysis and Asian Knowledgebase”, Oncotarget, 10.18632/oncotarget.28021
発表者
理化学研究所
生命医科学研究センター がんゲノム研究チーム
研修生 大川 裕貴(おおかわ ゆうき)
チームリーダー 中川 英刀(なかがわ ひでわき)
北海道大学大学院医学研究院 外科学分野 消化器外科学教室Ⅱ
教授 平野 聡(ひらの さとし)
講師 中村 透(なかむら とおる)
報道担当
理化学研究所 広報室 報道担当
北海道大学 総務企画部 広報課 広報・渉外担当