2021-10-19 金沢大学,東京医科大学,東京大学,九州大学,慶應義塾大学,日本医療研究開発機構
金沢大学がん進展制御研究所/新学術創成研究機構の後藤典子教授、東京医科大学分子病理学分野の黒田雅彦主任教授、東京大学医科学研究所の東條有伸教授(研究当時、現:東京大学名誉教授、東京医科歯科大学副理事・副学長)、東京大学特命教授・名誉教授の井上純一郎教授、国立がん研究センター造血器腫瘍研究分野の北林一生分野長、九州大学病態修復内科学の赤司浩一教授、慶應義塾大学医学部先端医科学研究所遺伝子制御研究部門の佐谷秀行教授らの共同研究グループは、乳がん発症に必須の超早期の微小環境を作り出すメカニズムを発見しました。
世界中の研究者の努力によりがんの病態が解明され、新たな治療法が次々と開発されているものの、一旦発症したがんを根治することは多くの場合困難です。そのため、多くのがん患者は再発転移により命を落とします。がんの発症を予防し、超早期に治療できれば、がんを根治して死亡数を激減させられると期待されます。しかし、乳がんをはじめ多くのがんにおいて、がん発症の超早期にがん細胞が増殖を開始する分子機構が不明であるため、根治できる予防法、超早期治療法の開発に至っておりません。
本研究では、乳がん発症の超早期に、間質細胞、免疫細胞などが集まる微小環境(がん細胞を取り囲むいわゆるニッチと呼ばれる場)が作り出される仕組みを分子レベルで明らかにしました。さらにこのがん発症の超早期微小環境がFRS2β(※1)という分子によって整えられることが、がん細胞が増殖を開始するために必須であることを示しました。
これらの知見は将来、がん予防、超早期がんの診断治療に活用され、がんの撲滅に寄与することが期待されます。
本研究成果は、2021年10月18日(米国東部標準時・夏時間)に米国科学アカデミー機関誌の『Proceedings of National Academy of Sciences, USA』のオンライン版に掲載されました。
研究の背景
「がん予防」は、最も重要で費用対効果に優れた長期的施策とされており、避けられるがんを防ぐことが重要であると考えられています。しかし多くのがんにおいて、前がん病変や超早期のがんが増殖を開始する分子機構が未だ不明のため、分子機構に根ざしたがん発症予防法の開発には至っておりません。
近年、がん組織は、幹細胞の性質を持つがん細胞(いわゆるがん幹細胞様細胞)が分化増殖を繰り返して構築されると考えられつつあります。がんの病態の始まりも、がん幹細胞様細胞が発生し増殖を開始することと考えられています。がん幹細胞様細胞は、周囲に集まった間質細胞、免疫細胞などが作る微小環境より産生されるサイトカインなどの影響を受けることが知られているものの、その実態は不明でした。
研究成果の概要
本研究グループは、乳がん細胞を取り巻く微小環境の実態を調べていく過程で、乳腺のごく少数の細胞に、細胞内シグナル分子FRS2βが発現していることを見出しました。
次に、乳腺特異的に細胞膜受容体型チロシンキナーゼHER2/ErbB2を過剰発現することで、乳がんを自然発症する乳がんモデルマウスMMTV-ErbB2を用いて、超早期がんの乳腺微小環境を調べました。その結果、FRS2βは細胞内の小胞上で、炎症性マスターレギュレーター転写因子NFκBを強く活性化することが分かりました。FRS2βによって活性化したNFκBは、炎症性サイトカインを産生、これらの炎症性サイトカインが細胞外へ放出されると、そこへ間質細胞や免疫細胞が引き寄せられることが分かりました。この状態の乳腺に乳がん幹細胞様細胞を移植すると、一ヶ月以内に大きい腫瘍塊ができあがりました。一方、FRS2βを欠失した乳腺に、乳がん幹細胞様細胞を移植しても、全く腫瘍ができてきませんでした(図)。このことから、がん幹細胞様細胞が増殖を開始するためには、FRS2βが乳腺細胞内でNFκBを活性化して超早期の微小環境を作ることが必要であることが分かりました。これらの結果から、乳がん発症には、FRS2βによって整えられる乳腺微小環境が極めて重要であることが明らかとなり、超早期微小環境の実態を紐解く成果が得られました。
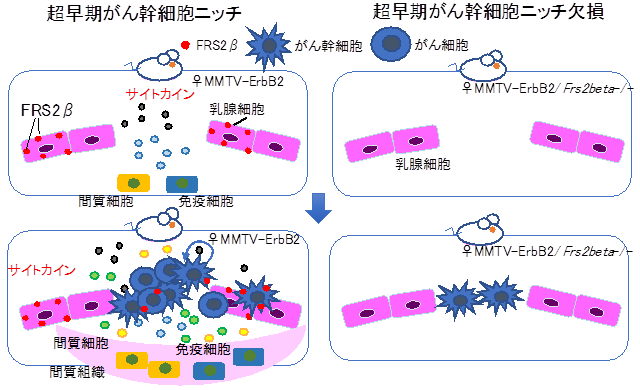
図 FRS2βが作り出す乳がん発症の超早期の微小環境乳がんマウスモデルMMTV-ErbB2の乳腺の超早期の微小環境に現れたがん幹細胞は増殖して腫瘍塊を作る(左)。一方、FRS2βを欠失したMMTV-ErbB2/Frs2β-/-乳腺は、超早期の微小環境が構成されず、がん幹細胞が現れても増殖しない(右)。
今後の展開
現在、乳がんの早期病変Ductal carcinoma in situ(DCIS)(※2)はマンモグラフィで見つけることができます。しかし、DCIS内のがん細胞が、その後増殖して悪性の浸潤がんになっていくかどうか見極めがつかないため、手術という侵襲性の高い治療法しか選択肢がなく、実臨床における問題となっています。このDCISを取り囲む微小環境内のFRS2β-NFκB軸の活性の強弱により、手術の必要性の有無を判断できる可能性があります。
本研究をさらに発展させることにより、乳がん発症前に整えられている乳腺微小環境を標的とする治療を行うことが可能になると考えられます。ひいては乳がんの発症予防、早期の治療が実現し、従来であれば乳がんにより命を落としていた人々が救われることが期待されます。
研究支援
本研究は、日本医療研究開発機構(AMED)2016-2018年革新的がん医療実用化研究事業、2018-2019年、2021-2022年次世代がん医療創生研究事業、文部科学省科学研究費などの支援のもとで行われました。
掲載論文
- 雑誌名
- Proceedings of National Academy of Sciences, USA
- 論文名
- The membrane-linked adaptor FRS2β fashions a cytokine-rich inflammatory microenvironment that promotes breast cancer carcinogenesis. (超早期乳がん発症を促進するサイトカイン豊富な微小環境は、細胞内アダプター FRS2βによって作り出される)
- 著者名
- Takeuchi Y, Kimura N, Murayama T, Machida Y, Iejima D, Nishimura T, Terashima M, Wang Y, Li M, Sakamoto R, Yamamoto M, Itano N, Inoue Y, Ito M, Yoshida N, Inoue J-I, Akashi K, Saya H, Fujita K, Kuroda M, Kitabayashi I, Voon D, Suzuki T, Tojo A, Gotoh N,
(竹内康人、木村奈津子、村山貴彦、町田雪乃、家島大輔、西村建徳、寺島農、Yuming Wang、Mengjiao Li、坂本怜子、山本瑞樹、板野直人、井上優介、伊藤正孝、吉田進昭、井上純一郎、赤司浩一、佐谷浩行、藤田浩司、黒田雅彦、北林一生、Dominic Voon、鈴木健之、東條有伸、後藤典子) - 掲載日時
- 2021年10月18日(米国東部標準時・夏時間)にオンライン版に掲載
用語解説
- (※1)FRS2β
- 細胞膜に結合している細胞内アダプター分子。受容体型チロシンキナーゼHER2/ErbB2に結合して、細胞内セリンスレオニンキナーゼERKを抑制することが知られていたが、機能については不明な点が多かった。
- (※2)Ductal carcinoma in situ(DCIS)
- 乳がんの最も早期の病変。乳管を囲む乳腺細胞の外にある基底膜を破壊して浸潤することなく、乳管内にがん細胞が限局して存在する病変。
本件に関するお問い合わせ先
研究内容に関すること
金沢大学がん進展制御研究所 教授
後藤典子(ごとう のりこ)
広報担当
金沢大学医薬保健系事務部薬学・がん研支援課企画総務係
岡田あゆみ(おかだ あゆみ)
東京医科大学 企画部広報・社会連携推進室
東京大学医科学研究所 国際学術連携室(広報)
清水麻子(しみず あさこ)
九州大学広報室
慶應義塾大学信濃町キャンパス総務課
山崎僚太(やまさき りょうた)
AMED事業に関すること
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課 革新的がん医療実用化研究事業
創薬事業部 医薬品研究開発課 次世代がん医療創生研究事業(P-CREATE)