2021-12-24 国立がん研究センター,名古屋大学,大阪大学,愛知医科大学,日本医療研究開発機構
発表のポイント
- 血液がんで使用される分子標的薬モガムリズマブ*1について、投与量を最適化することで、固形がんに対するがん免疫療法薬としての治療効果が得られる可能性が示唆されました。
- 殺細胞性抗がん剤や分子標的薬では、投与量が多いほど、腫瘍細胞を縮小する可能性が高いと考えられますが、免疫療法では投与量を減らし適正化することで腫瘍細胞が縮小する効果が得られる可能性が示されました。
- がん免疫療法での、標的細胞への作用を介した至適投与量を考える上で重要な知見となります。
- 新たな免疫療法の選択肢となることが期待され、今後、有効性や安全性を評価する臨床試験を計画します。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)研究所と大阪大学、名古屋大学、愛知医科大学などの研究チームは、血液がんの治療に使用される分子標的薬の抗CCR4*2モノクローナル抗体(モガムリズマブ)を、固形がん患者さんに対しては規定の投与量より減らし適正化することで、新たな免疫療法(併用療法)として治療の奏効が期待できることを見出しました。
これは、規定の投与量を減らし最適量としたモガムリズマブが、がんに対する免疫応答を抑制することでがん細胞の増殖を助ける制御性T細胞(Treg細胞)*3を選択的に除去しながら、腫瘍縮小をもたらすセントラルメモリーCD8陽性T細胞*4を維持したためと考えられます。
殺細胞性抗がん剤や分子標的薬では、投与量が多いほど腫瘍細胞を縮小する可能性が高いと考えられますが、本研究により抗CCR4モノクローナル抗体は、投与量を減らし適正化することで腫瘍を縮小させる効果を発揮できる可能性が明らかになり、今後のがん免疫療法の開発において薬剤投与量の最適化という視点の重要性が示されました。
免疫チェックポイント阻害剤に代表されるがん免疫療法は、一部の患者さんで著しい治療効果をもたらす一方、十分な治療効果を得られない患者さんも多く、近年、がん免疫療法薬や殺細胞性抗がん剤等との併用療法などが試みられていますが、併用療法によっても半数以上は治療効果が認められず、より効果的な免疫療法の開発が求められています。
本研究は、国立がん研究センター 研究所 腫瘍免疫研究分野 前田優香 ユニット長、西川博嘉 分野長(名古屋大学大学院医学系研究科 微生物・免疫学講座 分子細胞免疫学 教授併任)と、大阪大学大学院医学系研究科 臨床腫瘍免疫学 和田 尚 特任教授(常勤)、愛知医科大学医学部 腫瘍免疫寄附講座 上田龍三 教授らの研究チームで実施しました。
研究成果は、英国科学雑誌「Nature Communications」に日本時間2021年12月14日付けで掲載されました。
背景
本研究では、基礎研究の結果などから新たながん免疫療法の標的として注目されている制御性T細胞に着目しました。制御性T細胞は免疫応答を抑える機能を持ち、自己免疫疾患、炎症性疾患、アレルギー疾患などの過剰な免疫応答を抑制していますが、がん細胞はこの制御性T細胞を活性化することで免疫応答を抑制し、免疫細胞からの攻撃を回避していると考えられています。実際、悪性黒色腫や肺がんなどの多くのがんで、制御性T細胞が活性化していることが分かっています。しかし、制御性T細胞は、過剰な免疫応答を抑制し、免疫系を安定させる(免疫恒常性を維持する)重要な細胞でもあるため、がんに対する免疫応答を高めるために、免疫抑制機能のみを選択的に制御する必要があり、開発を困難にしていました。
本研究チームは先行研究で、がん組織に存在する制御性T細胞にはCCR4が高発現しており、CCR4に対する抗CCR4モノクローナル抗体(モガムリズマブ)を投与することで、制御性T細胞を選択的に除去できる可能性を報告していたことから、進行・再発固形がんを対象にモガムリズマブの安全性、薬物動態、制御性T細胞の除去効果を検討する第I相臨床試験を実施し、免疫モニタリングを行い、治療効果との関連を調べました。
モガムリズマブはCCR4を発現している成人T細胞白血病/リンパ腫(ATLL)などに対し「分子標的薬」としてすでに薬事承認され、日常診療で使用されています。
研究方法・成果
- 血液がんに使用されている投与量の抗CCR4モノクローナル抗体(モガムリズマブ)を固形がん患者さんに投与することにより、末梢血中の抗腫瘍効果を抑制する制御性T細胞を効率的に除去できることが分かりましたが、治療効果は限定的でした。
- モガムリズマブ投与により長期生存効果が得られた患者さんでは、抗腫瘍免疫応答により腫瘍縮小をもたらすセントラルメモリーCD8陽性T細胞が多く存在していました。
- 一方で、治療効果が得られなかった患者さんは、モガムリズマブの規定量(保険承認量と同等)の投与では制御性T細胞の除去と同時に、腫瘍縮小をもたらすセントラルメモリーCD8陽性T細胞も除去されていました。
- セントラルメモリーCD8陽性T細胞も制御性T細胞と同様に低いながらCCR4を発現していることを見出しました。
- モガムリズマブの投与量を減らし適正化することで制御性T細胞を選択的に除去しながら、セントラルメモリーCD8陽性T細胞を温存し治療効果が得られる可能性が示唆されました。
研究チームは、CCR4を標的とした制御性T細胞の除去効果を検討するため進行・再発固形がんを対象としたモガムリズマブの第I(Ia/b)相臨床試験(NCT01929486)を実施しました。
本試験の結果、モガムリズマブの投与により末梢血中の制御性T細胞が減少していることを確認しましたが、抗腫瘍効果は限定的でした。一方で、モガムリズマブ投与により長期生存が得られた患者では腫瘍縮小をもたらすセントラルメモリーCD8陽性T細胞が多く存在していることが明らかになりました。
そこで、制御性T細胞の除去効果と治療効果の解離の原因や、セントラルメモリーCD8陽性T細胞との関連を明らかにするため、第Ib相臨床試験に参加した進行性固形がん患者39名の末梢血検体を用いて抗体投与前後の網羅的な免疫モニタリング(マルチカラーフローサイトメトリー/マストサイトメトリー(CyTOF))*5を実施しました。その結果、第Ia相臨床試験と同様に末梢血中の制御性T細胞は効率的に除去されおり、さらにCD8陽性T細胞の一部も同時に除去されていることが明らかになりました(図1)。
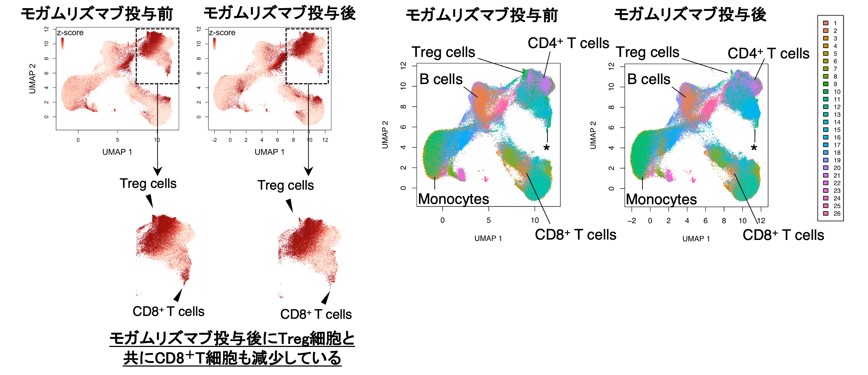
図1 モガムリズマブ投与前後の患者末梢血による網羅的な検討結果Treg細胞路同時にCD⁺T細胞も除去されていた
さらに詳細な制御性T細胞の変化についてマルチカラーフローサイトメトリーを用いて検討したところ、最も免疫抑制活性を有しCCR4を高発現している活性化型制御性T細胞が有意に除去されていました。また、マスサイトメトリーにより明らかになったCD8陽性T細胞の除去は、セントラルメモリーCD8陽性T細胞の減少であることが明らかになりました(図2)。セントラルメモリーCD8陽性T細胞は、近年臨床応用が進む免疫チェックポイント阻害剤治療や免疫細胞治療で腫瘍縮小をもたらす上で重要な働きがあることが明らかになっており、モガムリズマブの投与によりセントラルメモリーCD8陽性T細胞が予期せず除去されてしまったことが、治療効果が認められない原因であることが示唆されました(図2)。また、CCR4の発現を調べたところ、制御性T細胞と同様に、セントラルメモリーCD8陽性T細胞においても低いながらCCR4を発現していることを発見しました。
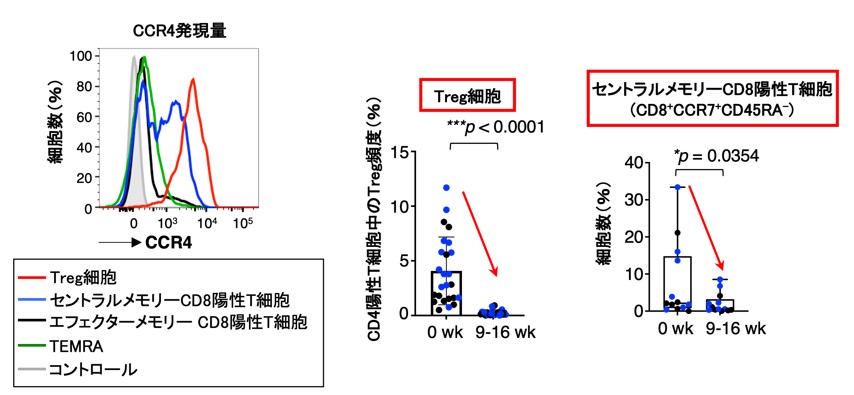
図2 抗体投与によるTreg細胞の除去と予期せぬセントラルメモリーCD8陽性T細胞の除去
次に、モガムリズマブの投与量の最適化について検討するため、過去の臨床試験で用いられた健康人の末梢血の薬物動態データに基づいて、生体内濃度を反映したモガムリズマブ濃度の抗体投与量の最適化を検討しました(図3)。
その結果、モガムリズマブをT細胞リンパ腫での臨床用量である10 µg/ml(=生体内濃度:1.0 mg/kg)で添加した場合、制御性T細胞とセントラルメモリーCD8陽性T細胞の両者が有意に除去されました。これに対し、1 µg/ml未満(生体内濃度:0.1 mg/kg未満)の場合では、セントラルメモリーCD8陽性T細胞に比較して、制御性T細胞が選択的に除去されました(図3)。これは、制御性T細胞のCCR4発現がセントラルメモリーCD8陽性T細胞に比べて高いため、選択的にモガムリズマブの標的となったと考えられました(図2)。
以上より、CCR4が発現しているセントラルメモリーCD8陽性T細胞の低下が、固形がん患者におけるモガムリズマブの限定的な臨床効果の一因である可能性が強く示唆されました。
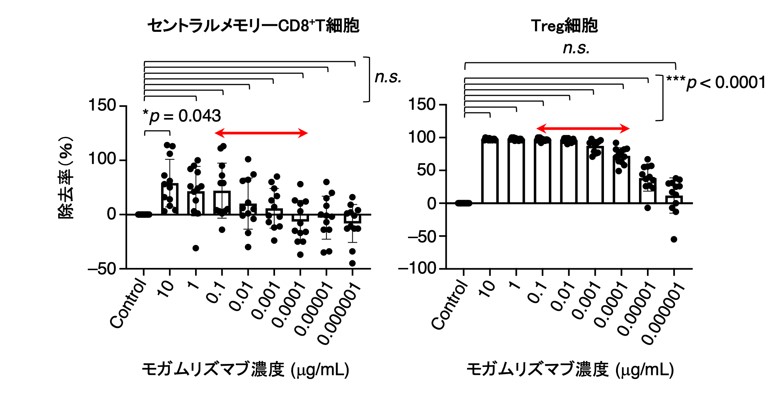
図3 抗体の原料によりセントラルメモリーCD8⁺T細胞の維持とTreg細胞の除去が両立できる可能性がある
モガムリズマブは脱フコース化することにより抗体依存性細胞傷害活性*6が増強されています(抗体のFc領域のオリゴ糖がフコース糖単位を持たないように改変され、通常の抗体に比べて抗体依存性細胞傷害活性が飛躍的に強くなるように設計された抗体)。そのため、ナチュラルキラー(NK)細胞*7機能が臨床効果に関与している可能性も考えられ、ナチュラルキラー細胞の活性化状態を検討したところ、長期生存が得られた患者ではナチュラルキラー細胞が疲弊状態にありました。これにより抗体依存性細胞傷害活性が低下することで、CCR4を高発現している制御性T細胞がセントラルメモリーCD8陽性T細胞に比べて選択的にモガムリズマブの標的となり、セントラルメモリーCD8陽性T細胞が温存され長期生存につながったと考えられました。
本研究の結果、モガムリズマブの投与量を減らすことにより、抗腫瘍免疫応答を抑制する制御性T細胞を選択的に除去しながら、腫瘍縮小をもたらすセントラルメモリーCD8陽性T細胞は維持することができ、治療の奏効につながる可能性が示唆されました。
展望
モガムリズマブは、成人T細胞白血病/リンパ腫(ATLL)および末梢性T細胞リンパ腫(PTCL)に対する「分子標的薬」として承認されています。本研究では固形がんに対してモガムリズマブを制御性T細胞標的治療= 「がん免疫療法」として使用するものでした。がん免疫療法として用いた場合、標的細胞の生体内の頻度が少ないことから「分子標的薬としての用量」は「がん免疫療法としては過剰量」であることが強く示唆されました。特に、分子標的薬としての用量を使用することにより制御性T細胞の減少と共にCCR4分子を低発現するセントラルメモリーCD8陽性T細胞も除去され、本来薬剤の持つがん免疫療法としてのポテンシャルを発揮することができず臨床効果も限定的でした。
本研究成果により、がん免疫療法としてのモガムリズマブの至適投与量を慎重に検討することの重要性を提言することができました。引き続き、臨床応用に向けて固形がんに対する大規模臨床試験の実施を目指します。「分子標的薬」として実績のある薬剤を「がん免疫療法」として適切・安全に使用するための治療法の開発は喫緊の課題であり、社会的意義の大きな研究成果になると考えられます。
発表論文
雑誌名
Nature Communications
タイトル
Depletion of central memory CD8+T cells might impede the antitumor therapeutic effect of Mogamulizumab
著者
Yuka Maeda, Hisashi Wada, Daisuke Sugiyama, Takuro Saito, Takumi Irie, Kota Itahashi, Kodai Minoura, Susumu Suzuki, Takashi Kojima, Kazuhiro Kakimi, Jun Nakajima, Takeru Funakoshi, Shinsuke Iida, Mikio Oka, Teppai Shimamura, Toshihiko Doi, Yuichiro Doki, Eiichi Nakayama, Ryuzo Ueda and Hiroyoshi Nishikawa
DOI
10.1038/s41467-021-27574-0
URL
https://www.nature.com/articles/s41467-021-27574-0
掲載日
2021年12月14日
主な研究費
・国立研究開発法人日本医療研究開発機構(AMED)
次世代がん医療創生研究事業
「がん細胞および免疫応答解析に基づくがん免疫療法効果予測診断法の確立」
「CD8陽性T細胞活性化特性に基づくがん免疫療法効果予測法の確立」
次世代治療・診断実現のための創薬基盤技術開発事業
「患者層別化マーカー探索技術の開発/がん免疫モニタリングによる患者層別化を行う基盤技術の開発」
・文部科学省
科学研究費助成事業 基盤研究(S)
「発がんの人種差と免疫応答の関わりの解明」
・国立がん研究センターがん研究開発費
28-A-7「先端的がん免疫モニタリング法開発体制に関する研究」
31-A-7「がん免疫療法抵抗性を解除する新規治療法の臨床展開に向けた開発研究」
・一部の解析については小野薬品工業株式会社から支援を受けました。
用語解説
*1 モガムリズマブ
ヒト化抗CCR4モノクローナル抗体。ATLLおよび末梢性T細胞リンパ腫(PTCL)細胞に発現しているCCR4分子を標的とする分子標的薬として臨床応用され、保険承認されている。
*2 CCR4
CCケモカイン受容体4。白血球、主にT細胞の表面に発現しているタンパク質で、免疫細胞の浸潤に関わる。成人T細胞白血病/リンパ腫(ATLL)などの造血器腫瘍の一部に高発現しているため、分子標的治療の標的となっている。
*3 制御性T細胞 (Regulatory T cell: Treg細胞)
免疫応答を抑制する細胞。自己免疫疾患やアレルギーなどを引き起こす過剰な免疫応答を抑制するが、がん免疫においては、がんを攻撃するエフェクターT細胞などの抗腫瘍免疫応答を抑制してしまう。
*4 セントラルメモリーCD8陽性T細胞
すでに抗原に暴露され、二次リンパ節に存在するリンパ球。抗原刺激により即座に活性化されると細胞傷害性T細胞などのエフェクターT細胞になり二次免疫応答の中心的な役割を果たす。免疫チェックポイント阻害剤や免疫細胞療法(CAR-T細胞療法)などのがん免疫療法で抗腫瘍免疫応答を担うことが近年明らかとなってきている。
*5 マルチカラーフローサイトメトリー/マストサイトメトリー(CyTOF)
従来の蛍光抗体を用いたフローサイトメトリー法とは異なり、金属でラベルされた抗体を用いて分子発現を測定する。細胞を1細胞レベルで解析をするフローサイトメトリーと、金属元素の質量に基づいて物質を高次元、高分解能で解析できるICP-TOF-MSを融合したマスサイトメトリー。理論上は100を超えるマーカーを同時に解析することが可能である。
*6 抗体依存性細胞傷害活性
ADCC(Antibody dependent cellular cytotoxicity)活性
標的となる細胞に抗体が結合すると、抗体のFc領域を認識するFc受容体を持つNK(ナチュラルキラー)細胞やマクロファージが抗体と結合している細胞を殺傷する作用のこと。
*7 ナチュラルキラー(NK)細胞
自然免疫応答に関わるリンパ球の一種であり、がん細胞や異常な細胞を見つけると速やかに攻撃をする。
問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター
研究所 腫瘍免疫研究分野/先端医療開発センター 免疫TR分野 西川博嘉
取材・報道関係からの問い合わせ
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室
国立大学法人東海国立大学機構名古屋大学 大学院医学系研究科総務課総務係
大阪大学大学院医学系研究科 広報室
愛知医科大学 医学部庶務課
AMED事業に関すること
日本医療研究開発機構 (AMED)
創薬事業部 医薬品研究開発課 次世代がん医療創生研究事業 (P-CREATE)