ウサギを用いた研究で、1つまたは複数の腸内寄生虫の同時感染がボルデテラ菌の排出を増加させ、その後の感染を増加させる可能性があることが示された。 A study in rabbits shows that co-infection with one or more gut parasites increases shedding of Bordetella bacterium and could increase onward transmission
2022-11-09 ペンシルベニア州立大学(PennState)
この研究は、共感染が動物個体間の病原体排出の重要な変動要因であり、病気の広がりやすさに影響を与える可能性があることを示唆している。この研究で用いられた種と同様の種がヒトに感染しており、この研究はウサギで行われたものですが、ヒトの集団に対して広範な意味をもっている。
研究チームは、2種類の腸内寄生虫が呼吸器系病原体であるBordetella bronchiseptica (B. bronchiseptica) の排菌に与える影響をウサギで調査しました。彼らは、4種類の感染症について研究した。B. bronchisepticaのみ、B. bronchisepticaと2種類の蠕虫のどちらか一方、およびB. bronchisepticaと両方の蠕虫の4種類の感染を調査した。まず、ウサギにシャーレを被せてコロニーの数を数え、感染タイプごとに排出される菌の数を測定した。また、それぞれのウサギについて、血液中の多くの免疫変数を定量化した。そして、4種類の感染に対するウサギの免疫反応と、それが細菌の排出の程度とタイミングにどのように影響するかをシミュレートする数学的モデルを開発した。
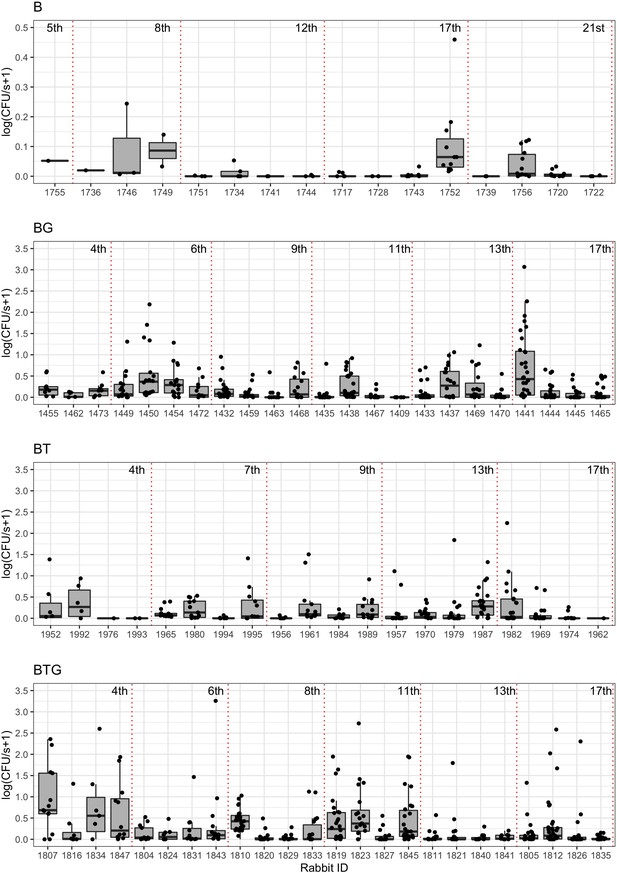
その結果、4種類の感染症によって、また感染症によって、細菌の排出量にかなりのばらつきがあることがわかった。常に大量の細菌を排出するウサギもいれば、排出量が少ないウサギや全く排出しないウサギもいた。3つの病原体をすべて保有しているウサギは、排菌量のばらつきが最も大きく、実際、蠕虫の存在は、排菌量の大きさと排菌頻度の両方においてばらつきを増加させた。このことから,蠕虫の共存は,その種類にかかわらず,B. bronchisepticaをより高い確率で伝播させることが示唆された.
研究チームは、B. bronchisepticaの排出が、気道の感染強度と宿主の免疫反応に影響されるかどうかを調べるため、動的モデルを構築した。各ウサギについて、実験的に得られた排菌データを、推定されたB. bronchisepticaの感染強度と関連する免疫反応に結びつけ、寄生虫がこの反応の強さと期間を変化させることを確認したのだ。このシミュレーションにより、共感染の宿主では細菌の排出がより高いレベルに達し、より長く続くこと、そしてこれらの変化が気道におけるB. bronchisepticaの著しい増殖と関連していることが確認された。好中球や抗体と呼ばれる免疫細胞の相対的な寄与の変化が、こうした感染動態や、感染の種類による菌排出のパターンの違いを説明できる可能性がある。しかし、大多数のウサギで観察された排菌の大きさの急激な変化は、今回調べた個体レベルでの感染の強さや関連する免疫反応では説明できず、気道の局所的なプロセスがより重要である可能性が示唆された。
<関連情報>
- https://www.psu.edu/news/research/story/gut-parasites-may-increase-onward-transmission-respiratory-bugs-rabbits/
- https://elifesciences.org/articles/70347
消化管内寄生虫によるBordetella bronchisepticaの排出量の増加と排出量の宿主差。 Gastrointestinal helminths increase Bordetella bronchiseptica shedding and host variation in supershedding
Nhat TD Nguyen,Ashutosh K Pathak,Isabella M Cattadori
eLife Published:Nov 8, 2022
DOI:https://doi.org/10.7554/eLife.70347
Abstract
Co-infected hosts, individuals that carry more than one infectious agent at any one time, have been suggested to facilitate pathogen transmission, including the emergence of supershedding events. However, how the host immune response mediates the interactions between co-infecting pathogens and how these affect the dynamics of shedding remains largely unclear. We used laboratory experiments and a modeling approach to examine temporal changes in the shedding of the respiratory bacterium Bordetella bronchiseptica in rabbits with one or two gastrointestinal helminth species. Experimental data showed that rabbits co-infected with one or both helminths shed significantly more B. bronchiseptica, by direct contact with an agar petri dish, than rabbits with bacteria alone. Co-infected hosts generated supershedding events of higher intensity and more frequently than hosts with no helminths. To explain this variation in shedding an infection-immune model was developed and fitted to rabbits of each group. Simulations suggested that differences in the magnitude and duration of shedding could be explained by the effect of the two helminths on the relative contribution of neutrophils and specific IgA and IgG to B. bronchiseptica neutralization in the respiratory tract. However, the interactions between infection and immune response at the scale of analysis that we used could not capture the rapid variation in the intensity of shedding of every rabbit. We suggest that fast and local changes at the level of respiratory tissue probably played a more important role. This study indicates that co-infected hosts are important source of variation in shedding, and provides a quantitative explanation into the role of helminths to the dynamics of respiratory bacterial infections.