2023-03-14 理化学研究所
理化学研究所(理研)生命医科学研究センター 応用ゲノム解析技術研究チームの安岡 有理 研究員は、脊椎動物の初期胚発生における高硫酸化ケラタン硫酸という糖鎖[1]の生合成に必須な働きを持つ遺伝子を発見しました。
本研究成果は、高硫酸化ケラタン硫酸が持つ生理的な作用や、難聴や椎間板変性症[2]などの疾患が発症する原理、脊椎動物固有の組織・器官の進化過程などの理解に向けた基盤になると期待できます。
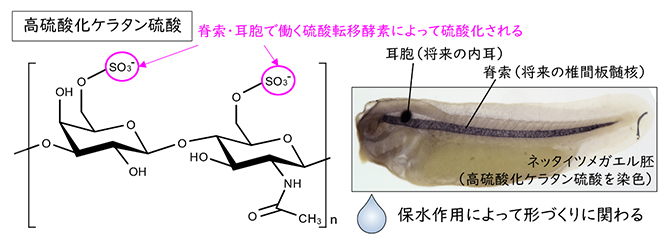
脊椎動物初期胚において、高硫酸化ケラタン硫酸が脊索(将来椎間板髄核[3]になる組織)と耳胞(将来内耳[4]になる組織)にだけ多く存在していることは古くから知られていました。しかし、その生合成経路を担う遺伝子についてはほとんど研究されてきませんでした。
今回、安岡研究員はネッタイツメガエル[5]の初期胚を用いた実験により、脊索および耳胞に特異的な高硫酸化ケラタン硫酸の生合成を担う硫酸転移酵素[6]遺伝子(chst1、chst3、chst5.1)を発見しました。これらの遺伝子は、保水作用のある高硫酸化ケラタン硫酸を細胞外で合成することで、耳胞や脊索という内部に水分を多く含む組織の形作りに関わっていると考えられます。さらに、脊索を持つ無脊椎動物であるナメクジウオ[7]の胚でも、同様の硫酸転移酵素が脊索で働いていることを見いだしました。これらの成果から、脊索や耳の進化過程と高硫酸化ケラタン硫酸の硫酸転移酵素遺伝子との密接な関わりが推察されます。
本研究は、科学雑誌『Frontiers in Cell and Developmental Biology』オンライン版(3月14日付:日本時間3月14日)に掲載されました。
組織特異的に発現する硫酸転移酵素によって生合成される高硫酸化ケラタン硫酸
背景
細胞の表面には、ヒアルロン酸やコンドロイチン硫酸に代表される糖鎖と呼ばれる構造が存在し、組織を支える役割や細胞間シグナル伝達の足場となる働きがあります。糖鎖の種類や量には細胞種ごとに特徴があるため、一部の糖鎖は細胞や組織を見分けるための目印(マーカー)として使われています。高硫酸化ケラタン硫酸はそのような糖鎖の一つで、ガラクトース6-硫酸とN-アセチルグルコサミン6-硫酸の繰り返し構造からなり、水と高い親和性を持ちます(図1)。
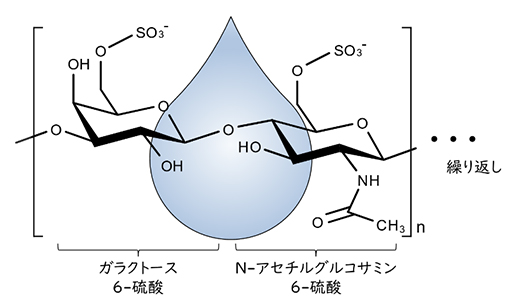
図1 高硫酸化ケラタン硫酸の構造
高硫酸化ケラタン硫酸は眼の角膜や軟骨、脳などに多く含まれ、組織を支える足場の一つとして働いています。角膜や骨ができる以前の初期胚においては、脊索と耳胞という二つの組織に高硫酸化ケラタン硫酸が局在しています(図2)。成体になっても、脊索と耳胞それぞれに由来する椎間板髄核と内耳には高硫酸化ケラタン硫酸の蓄積が見られます。
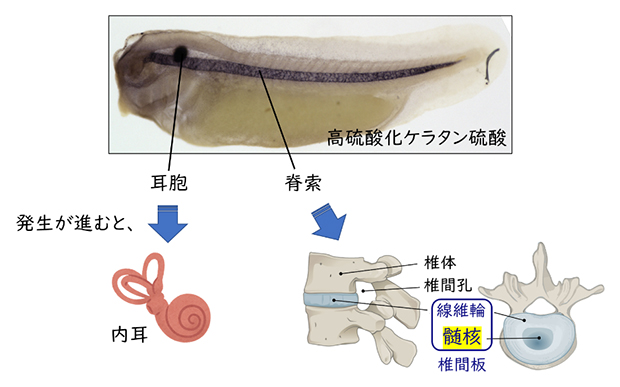
図2 高硫酸化ケラタン硫酸が蓄積した組織
(上)ネッタイツメガエル胚に局在する高硫酸化ケラタン硫酸を黒色で染色したもの。
(下)耳胞と脊索に由来するヒト成体組織。(右の図はIntervertebral disk ©Jmarchn(Wikimedia Commons)を日本語に翻訳して使用)
この高硫酸化ケラタン硫酸の局在パターンは古くから知られており、発生学実験ではしばしば脊索や耳胞のマーカー分子として利用されてきました。しかし、どのような遺伝子が働くことでこのような組織特異的なパターンが作られるのか、そのメカニズムは全く分かっていませんでした。そこで本研究では、脊椎動物の初期胚発生における高硫酸化ケラタン硫酸生合成経路に必須の遺伝子を突き止め、その生理的・進化的な意義を考えました。
研究手法と成果
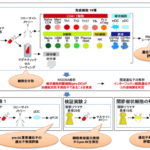
安岡研究員は、高硫酸化ケラタン硫酸の生合成経路に関わる遺伝子が、脊椎動物初期胚のいつどこで発現しているのかを、ネッタイツメガエルを実験に用いて調べました。その結果、硫酸転移酵素をコードする三つの遺伝子(chst1、chst3、chst5.1)について、chst1は主に耳胞、chst3は主に脊索、そしてchst5.1は耳胞と脊索の両方に強く限定されて働いていることが分かりました(図3左)。
次に、それぞれの遺伝子の機能を調べるため、アンチセンスモルフォリノオリゴ[8]やCRISPR-Cas9システム[9]を用いて、遺伝子の機能を阻害する実験を行いました。その結果、それぞれの遺伝子の発現場所に対応するように、chst1の機能阻害胚では耳胞、chst3の機能阻害胚では脊索、そしてchst5.1の機能阻害胚では耳胞と脊索両方の高硫酸化ケラタン硫酸が消失または減少しました(図3右)。そこで、高硫酸化ケラタン硫酸の欠損が体の形作りに与える影響を調べたところ、chst1の機能阻害胚では耳胞が小さくなることを発見しました。これらの結果から、組織特異的に発現する硫酸転移酵素が高硫酸化ケラタン硫酸を生合成し、組織が水分を保持するのを助けることで、体の正常な形作りに貢献していることが明らかになりました。
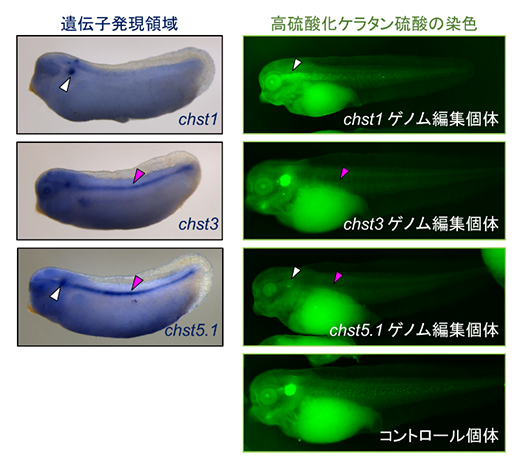
図3 硫酸転移酵素遺伝子の発現と機能
(左)chst1、chst3、chst5.1のネッタイツメガエル初期尾芽胚における発現領域。白矢尻は耳胞、マゼンタ矢尻は脊索を示す。
(右)chst1、chst3、chst5.1をCRISPR-Cas9によるゲノム編集で機能阻害した、ネッタイツメガエル初期幼生における高硫酸化ケラタン硫酸の分布(緑色)。矢尻の表記は左と同様。
さらに、硫酸転移酵素の脊索における発現の進化的起源を調べるため、脊索を持つ無脊椎動物であるナメクジウオの胚を用いた実験を行いました。その結果、脊椎動物の硫酸転移酵素に近い遺伝子の一つが、ナメクジウオでも脊索に局在して働いていることを見いだしました。このことは、硫酸転移酵素がヒトのはるか祖先から脊索の形成に関わってきたことを示唆しています。
一方、ナメクジウオに至るグループとの分岐後、脊椎動物の共通祖先は新たに耳という固有の器官を獲得しました。このとき、これまで脊索の形成に用いられていた硫酸転移酵素の一部が耳胞にも流用されたと考えられます。今回その発現と機能を明らかにしたchst1とchst3は、どちらもガラクトースの硫酸転移酵素をコードしており、元々一つだった遺伝子から脊椎動物の誕生時に重複してできたものだと考えられます。chst1とchst3が耳胞と脊索で機能を分担していること(図3)は、互いに独立した進化発生学的起源を持つ二つの組織だからこそ、別々の遺伝子を用いながら同じ高硫酸化ケラタン硫酸を合成できたのだと解釈できます(図4)。
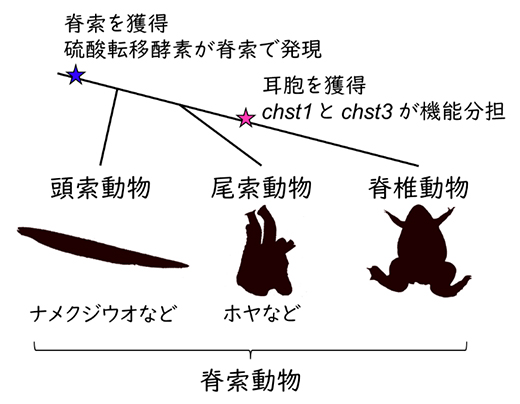
図4 脊索動物の系統関係と高硫酸化ケラタン硫酸に関する進化イベント
脊索を持つ動物(=脊索動物)は、ナメクジウオなどを含む頭索動物、ホヤなどを含む尾索動物、我々ヒトを含む脊椎動物の三つのグループに分かれる。硫酸転移酵素は、脊索動物共通祖先が生まれたときから脊索で働いていたと考えられる。さらに脊椎動物が耳胞を獲得すると、chst1とchst3が耳胞と脊索で機能分担するようになったと想定される。
今後の期待
「細胞表面の糖鎖マーカーはなぜマーカーたり得るのか?」という素朴な疑問から出発した本研究は、組織ごとに異なる硫酸転移酵素を利用しながら高硫酸化ケラタン硫酸を生合成する仕組みを明らかにしました。今回発見した硫酸転移酵素の機能を調節することで、今後は高硫酸化ケラタン硫酸の新たな生理活性の解明につながると期待できます。
今回同定された硫酸転移酵素がなぜ脊索と耳胞に限局して発現するのか、その制御メカニズムはまだ分かっていませんが、それぞれの組織の発生・分化に関わる因子によって発現制御されていると考えられます。今後の研究で硫酸転移酵素の具体的な発現制御機構を明らかにできれば、特定の組織が特定の糖鎖を合成する仕組みをより深く理解できるはずです。そしてそこに、脊椎動物の進化の鍵があるかもしれません。
ヒトの疾患との関連性においても、CHST3遺伝子の椎間板髄核における発現減少が椎間板変性症の原因の一つとなることが既に報告されています注1)。内耳についても、CHST1遺伝子と難聴の関係性などが今後の研究で明らかになるかもしれません。
注1)2013年10月9日プレスリリース「腰椎椎間板変性症(LDD)発症に関する遺伝子「CHST3」を発見」
補足説明
1.糖鎖
グルコース、ガラクトース、N-アセチルグルコサミンなどの糖がグリコシド結合によって鎖状につながった化合物。細胞表面でタンパク質に結合したものをプロテオグリカンと呼ぶ。
2.椎間板変性症
脊椎骨の間にある椎間板が損傷・変形する疾患の総称で、腰痛症や椎間板ヘルニアを引き起こす。
3.椎間板髄核
椎間板の中心に存在する細胞の塊。水分を多く含み、クッションのような役割を持つ。
4.内耳
耳の最も内側の構造で、聴覚や平衡覚を受容し、神経を介して脳へ伝える役割を持つ。ヒトの場合、蝸牛・前庭・三半規管から成る。
5.ネッタイツメガエル
中央アフリカに生息する体長3~5cmほどの小型のカエル。受精卵が得やすく飼育も容易なので、モデル動物として広く実験に用いられている。学名Xenopus tropicalis。
6.硫酸転移酵素
特定の糖鎖の特定の位置を硫酸化する酵素の総称。遺伝子名に使われているChstはCarbohydrate Sulfotransferase(炭水化物硫酸転移酵素)の略号。
7.ナメクジウオ
頭索動物に分類される動物で、ホヤなどの尾索動物よりも先に脊椎動物と分岐した脊索動物であり、脊索動物の共通祖先を推測するために広く研究に用いられている。
8.アンチセンスモルフォリノオリゴ
標的となるRNAに結合し、翻訳やスプライシングを抑制することで、特定の遺伝子の機能を阻害する合成オリゴヌクレオチド。本研究では、顕微鏡下でカエル胚に注入して使用した。
9.CRISPR-Cas9システム
Cas9タンパク質とガイドRNA(gRNA)の複合体によって、任意のゲノム配列を切断できるゲノム編集ツール。通常、切断された箇所には変異が入り、遺伝子機能を低下させる。本研究では、Cas9-gRNA複合体を顕微鏡下でカエル胚に注入して使用した。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「細胞運動非依存的な脊索の自律的形態形成メカニズムの解明(研究代表者:安岡有理)」「シロアゴガエルatp8遺伝子から紐解くミトコンドリアゲノム進化の機能的背景(研究代表者:安岡有理)」、同新学術領域研究(研究領域提案型)「ネッタイツメガエル胚発生における遺伝子制御ネットワークの揺らぎと進化(研究代表者:安岡有理)」による助成を受け、ナショナルバイオリソースプロジェクト(NBRP)「ツメガエル・イモリ(代表機関:広島大学両生類研究センター)」を利用して行われました。
原論文情報
Yuuri Yasuoka, “Tissue-specific expression of carbohydrate sulfotransferases drives keratan sulfate biosynthesis in the notochord and otic vesicles of Xenopus embryos”, Frontiers in Cell and Developmental Biology, 10.3389/fcell.2023.957805
発表者
理化学研究所
生命医科学研究センター 応用ゲノム解析技術研究チーム
研究員 安岡 有理(ヤスオカ ユウリ)
報道担当
理化学研究所 広報室 報道担当