2023-05-17 ワシントン大学セントルイス校
◆研究チームは、洗練されたシングルセルのシーケンシング技術を使用して、ラボで作られた幹細胞由来のベータ細胞が、自然のベータ細胞よりも未熟でインスリンの生成能力が低い理由を解明しました。
◆幹細胞由来のベータ細胞は、グルコースに対してインスリンを不十分に生成し、他の細胞型に近い遺伝子プロファイルを持ちます。しかし、研究チームは、クロマチンと呼ばれる物質に関する異常がベータ細胞の未熟さに関与していることを発見しました。この知見は、クロマチンを調節することで幹細胞由来のベータ細胞の質と数量を改善する可能性があることを示唆しています。
◆さらに、マウスへの移植実験では、自然な環境に置かれた幹細胞由来のベータ細胞は数か月後に問題が改善されることが示されました。これらの成果は、将来の糖尿病治療における幹細胞由来の治療法の開発に向けた一歩となる可能性があります。
<関連情報>
- https://source.wustl.edu/2023/05/findings-may-lead-to-improved-insulin-secreting-cells-derived-from-stem-cells/
- https://www.nature.com/articles/s41556-023-01150-8
ヒト幹細胞由来膵島の単核マルチオミクスにより、系統指定の不備を特定 Single-nucleus multi-omics of human stem cell-derived islets identifies deficiencies in lineage specification
Punn Augsornworawat,Nathaniel J. Hogrebe,Matthew Ishahak,Mason D. Schmidt,Erica Marquez,Marlie M. Maestas,Daniel A. Veronese-Paniagua,Sarah E. Gale,Julia R. Miller,Leonardo Velazco-Cruz & Jeffrey R. Millman
Nature Cell Biology Published:15 May 2023
DOI:https://doi.org/10.1038/s41556-023-01150-8
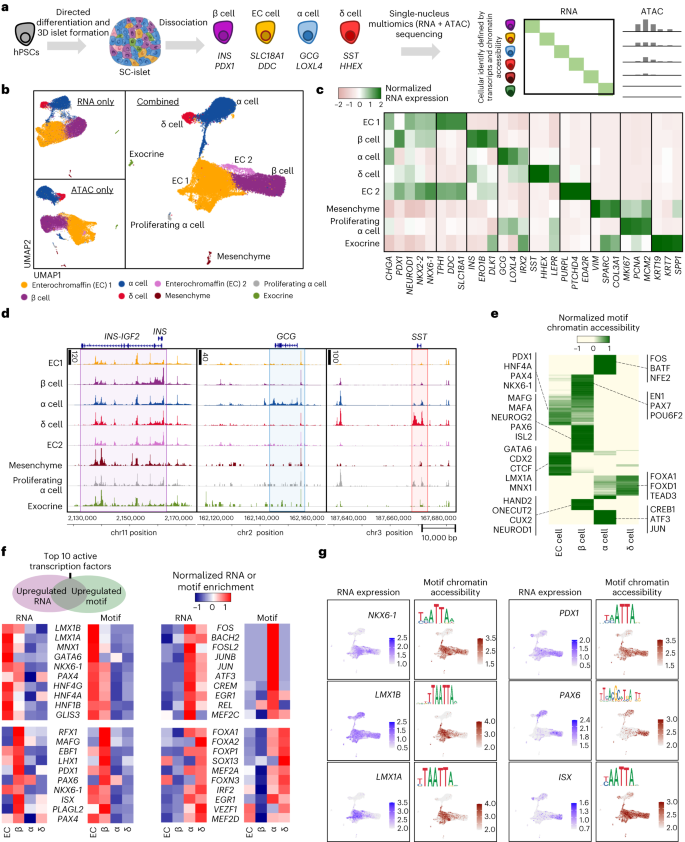
Abstract
Insulin-producing β cells created from human pluripotent stem cells have potential as a therapy for insulin-dependent diabetes, but human pluripotent stem cell-derived islets (SC-islets) still differ from their in vivo counterparts. To better understand the state of cell types within SC-islets and identify lineage specification deficiencies, we used single-nucleus multi-omic sequencing to analyse chromatin accessibility and transcriptional profiles of SC-islets and primary human islets. Here we provide an analysis that enabled the derivation of gene lists and activity for identifying each SC-islet cell type compared with primary islets. Within SC-islets, we found that the difference between β cells and awry enterochromaffin-like cells is a gradient of cell states rather than a stark difference in identity. Furthermore, transplantation of SC-islets in vivo improved cellular identities overtime, while long-term in vitro culture did not. Collectively, our results highlight the importance of chromatin and transcriptional landscapes during islet cell specification and maturation.


