2024-03-11 京都大学iPS細胞研究所
ポイント
- Activin Aによる軟骨分化誘導に酸化的リン酸化の活性化が必要であることを明らかにした。
- 酸化的リン酸化阻害剤は骨化の起源となる細胞における酸化的リン酸化を抑制することで異所性骨化を抑制した。
- 酸化的リン酸化がFOPに対する新しい治療標的となり得ることを示す結果であると考えられる。
1. 要旨
戸口田淳也特定拠点教授(CiRA基盤技術研究部門)は金永輝助教(京都大学医生物学研究所)、孫麗萍大学院生(京都大学医生物学研究所)らとの共同研究により、難治性遺伝性疾患である進行性骨化性線維異形成症(Fibrodysplasia Ossificans Progressiva、FOP)における異所性骨化に酸化的リン酸化(Oxidative Phosphorylation、OXPHOS)注1が深く関与しており、酸化的リン酸化の抑制が新しい治療法に繋がることを明らかにしました。
これまでに戸口田研究室では池谷真准教授(CiRA臨床応用研究部門)との共同研究として、FOP患者さん由来のiPS細胞から誘導した間葉系幹細胞(Mesenchymal stem cell、MSC)注2を活用した研究を行い、Activin A注3がmTORC1注4を活性化することでMSCを軟骨細胞に分化させ、異所性骨化を引き起こすことを明らかにしました(CiRAニュース 2017年8月1日)。しかし活性化されたmTORC1の下流で、どのようなシグナルが異所性骨化に関与しているのかは不明でした。
そこでActivin Aによる軟骨分化の過程におけるMSCの遺伝子発現を解析したところ、mTORC1シグナルと共に酸化的リン酸化シグナルが活性化していることが判明しました。同時にα-KG等のTCAサイクルの代謝産物が増加しており、ATP産生量も増加していることから、機能的にも酸化的リン酸化が活性化されていることが確認されました。そして酸化的リン酸化阻害剤によりMSCの軟骨分化が抑制されることから、Activin Aによる軟骨分化誘導に酸化的リン酸化の活性化が必要であることが判明しました。更にFOPモデルマウスを用いたin vivoの実験により、異所性骨化の過程で局所において酸化的リン酸化が活性化されており、酸化的リン酸化阻害剤により異所性骨化が抑制されました。この過程の詳細な解析により、酸化的リン酸化阻害剤はFibro/Adipogenic Progenitor(FAP)注5と呼ばれる骨化の起源となる細胞における酸化的リン酸化を抑制することで異所性骨化を抑制することが明らかになりました。これらの結果はFOPにおける異所性骨化の発生機構の理解に貢献することに加えて、酸化的リン酸化がFOPに対する新しい治療標的となり得ることを示す結果であると考えられます。
この研究成果は、2024年2月16日(金)に「Life Science Alliance」にオンライン掲載されました。
2. 研究の背景
FOPは骨格筋、腱、靱帯などの軟部組織の中に骨組織が形成され、四肢体幹の運動が著しく障害される疾患です。原因遺伝子は骨形成因子(Bone Morphogenic Protein、BMP)注6の受容体であるACVR1遺伝子注7です。戸口田研究室では池谷真准教授との共同研究によって、FOP患者さん由来のiPS細胞から誘導したMSCを活用した研究によって異所性骨化を引き起こす物質としてActivin Aを同定し、Activin Aが変異ACVR1受容体を介してmTORC1を活性化し、MSCを軟骨細胞に分化させ、異所性骨化を誘導すること、そしてmTORC1阻害剤であるラパマイシンが異所性骨化を抑制することを明らかにし、その結果を元にラパマイシンを用いた医師主導治験が実施されました(CiRAニュース 2017年8月1日)。しかし、mTORC1の活性化がどのようにしてMSCを軟骨に分化させるのかは不明でした。
3. 研究結果
患者さん由来MSC(FOP-MSC)とACVR1遺伝子を修復したMSC(resFOP-MSC)をActivin Aにより軟骨分化を誘導し、その過程での遺伝子発現を比較しました。mTORC1シグナルと共に酸化的リン酸化シグナルに関わる遺伝子が活性化し(図1A)、α-KG等のTCAサイクルの代謝産物が増加していました(図1B)。
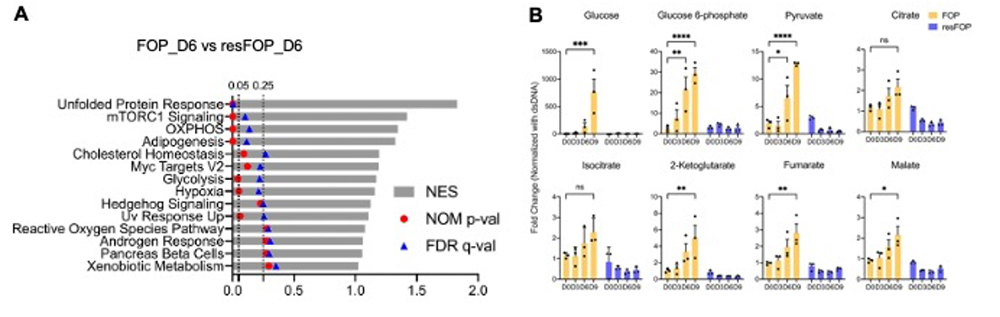
図1. FOP-MSCの軟骨分化過程における活性化シグナルの解析
A:Gene Set Enrichment Analysesの結果同定されたGene set
B:TCA cycle代謝物の変動.
更に酸素消費速度(Oxygen Consumption Rate、OCR)注8の測定ではATP産生量が増加しており(図2A)、ミトコンドリア合成に関連する遺伝子(NRF1, TFAM, T OMM20)の発現も亢進し(図2B)、ミトコンドリアDNA量も増加していました(図2C)。これらのミトコンドリアの活性化はmTORC1阻害剤であるラパマイシンで阻害されることから(図2D)、軟骨分化の過程でmTORC1からのシグナルにより酸化的リン酸化が活性化されていることが確認されました。
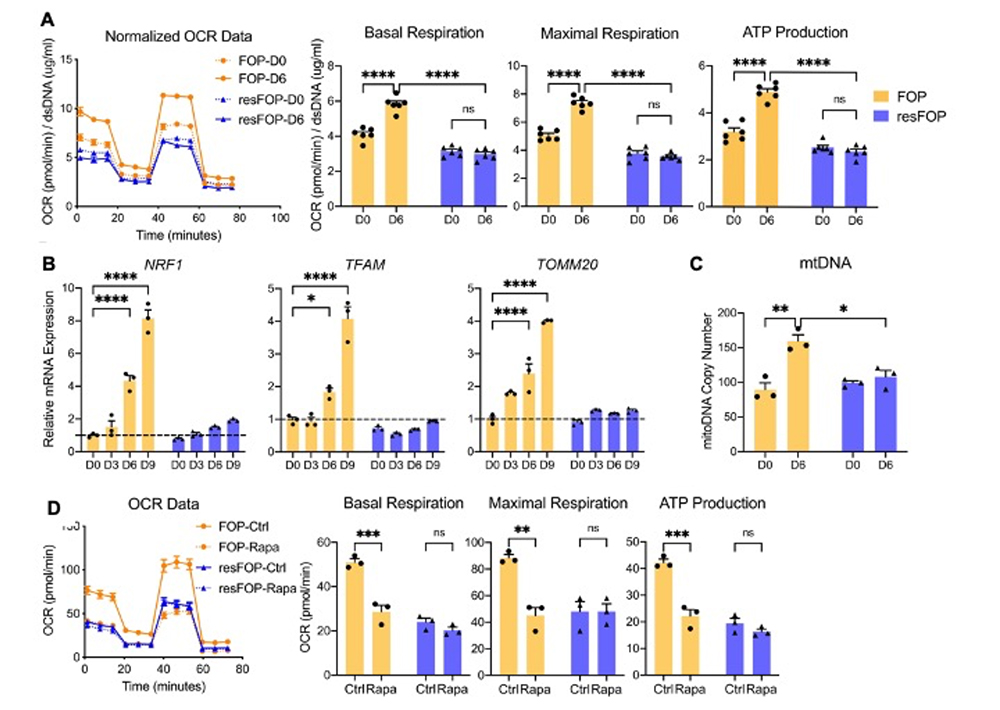
図2. FOP-MSCの軟骨分化過程における酸化的リン酸化の活性化
A:軟骨分化過程でのOCR解析
B:ミトコンドリア生合成関連遺伝子の発現
C:ミトコンドリアDNAの定量
D:ラパマイシンによる酸化的リン酸化の阻害
そこで酸化的リン酸化の軟骨分化への関与を解析するために、酸化的リン酸化阻害剤(IACS-010759、以下IACS)注9を軟骨分化実験に添加したところ、2次元(図3A)及び3次元(図3B)の誘導実験のいずれにおいても軟骨分化が抑制され、Activin Aによる軟骨分化誘導に酸化的リン酸化の活性化が必要であることが判明しました。
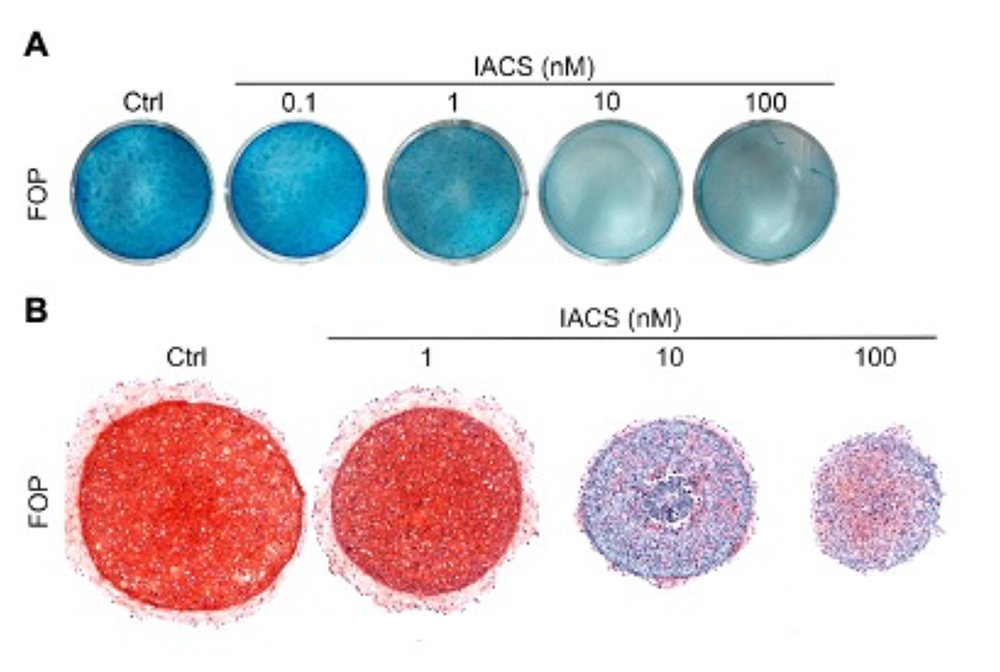 図3. IACSによるFOP-MSCの軟骨分化阻害
図3. IACSによるFOP-MSCの軟骨分化阻害
A:2次元培培養でのAlcian Blue染色
B:3次元培養でのSafranin O染色
次にヒト変異ACVR1遺伝子を導入したFOPモデルマウスを用いて、外傷による異所性骨化誘導実験を行い、IACSのin vivoでの効果が検討されました。その結果、in vitroの結果と一致して、酸化的リン酸化阻害剤により初期の軟骨分化の過程が阻害されることが遺伝子発現解析(図4A)及び組織学的解析(図4B)により確認されました。そしてその結果、後期の異所性骨化が抑制されることが判明しました(図4C及びD)。
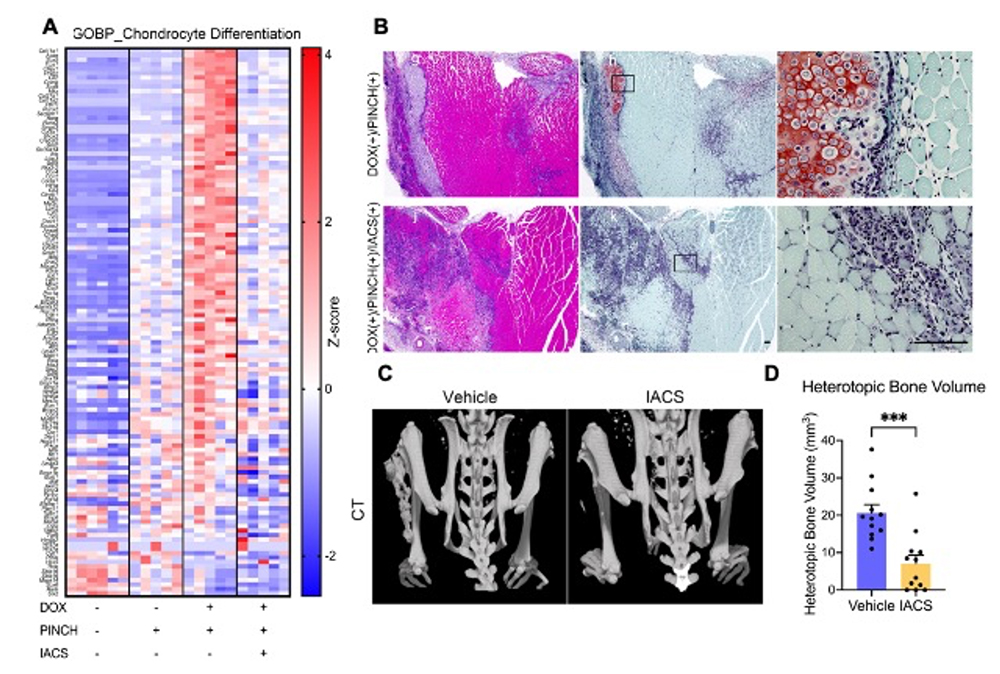 図4. FOPモデルマウスによる外傷誘導性異所性骨化に対するIACSの抑制効果
図4. FOPモデルマウスによる外傷誘導性異所性骨化に対するIACSの抑制効果
A:誘導7日目の遺伝子発現解析
B:誘導7日目の組織解析
C:誘導21日目のCT像
D:異所性骨の定量解析
FOPにおける異所性骨化の起源細胞としてPDGFRα陽性のFibro/adipogenic progenitor(FAP)細胞が提唱されています。Activin AによるMSCの軟骨分化誘導過程において、PDGFRαの発現は分化初期で亢進し、軟骨細胞マーカーであるSOX9の発現が亢進するに伴い低下しますが、IACSの添加により発現の亢進は阻害されました(図5A)。このin vitroの結果と一致して、in vivoでの異所性骨化形成過程においても、IACSによりFAP関連遺伝子の発現が阻害され(図5B)、組織学的解析でも、外傷によって誘導されたミトコンドリアの活性化を示すTOMM20陽性かつPDGFRα陽性の細胞(図5C)がIACSにより阻害されることが示され(図5D)、IACSは異所性骨化の起源細胞であるFAPの酸化的リン酸化を抑制することで、軟骨分化そして異所性骨化を抑制することが明らかになりました。
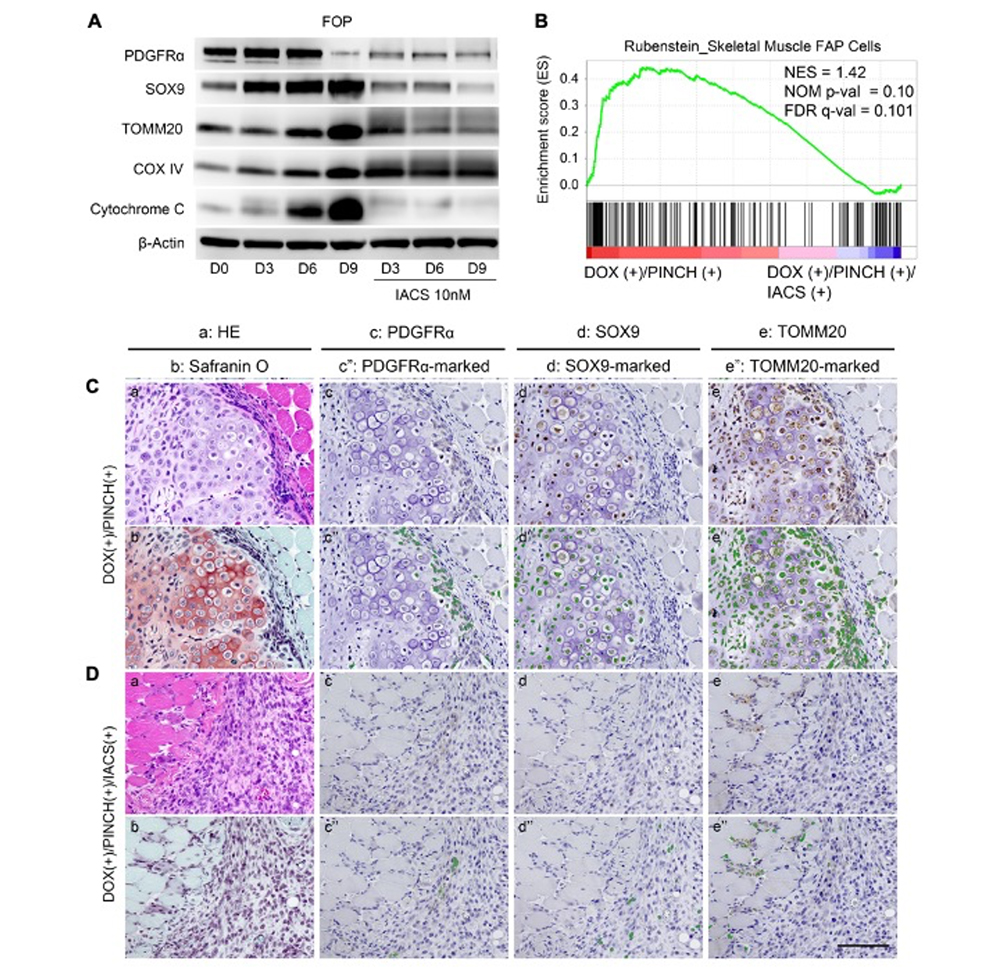
図5. IACSによるFAPの活性化抑制
A:MSC軟骨分化過程でのタンパク発現解析
B-D:FOPモデルマウスでの異所性骨化誘導7日目における遺伝子発現解析
(B)及び組織学的解析(C及びD)
これらの結果はFOPにおける異所性骨化の発生機構の理解に貢献することに加えて、酸化的リン酸化がFOPに対する新しい治療標的となり得ることを示すものであると考えられます。
4. まとめ
今回の実験で使用した酸化的リン酸化阻害剤は、抗がん剤としての臨床応用が検討されている薬剤でありFOP患者さんに対する長期間の服用は困難と考えられますが、フレアアップ時での短期間の使用等により、異所性骨化の初期の段階を抑制する治療薬としての有用性はあると考えられます。今後は他の候補治療薬との併用などの応用も考慮して開発が進められることが期待されます。
5. 論文名と著者
- 論文名
Oxidative phosphorylation is a pivotal therapeutic target of fibrodysplasia ossificans progressiva - ジャーナル名
Life Science Alliance - 著者
Liping Sun1, Yonghui Jin1*, Megumi Nishio2, Makoto Watanabe3, Takeshi Kamakura1,
Sanae Nagata2, Masayuki Fukuda1, Hirotsugu Maekawa2, Shunsuke Kawai2, Takuya Yamamoto2,4,5,
Junya Toguchida1,2*
*責任著者 - 著者の所属機関
- 京都大学医生物学研究所
- 京都大学iPS細胞研究所
- 島津製作所ライフサイエンス研究所
- 京都大学ヒト生物学高等研究拠点
- 理化学研究所革新知能統合研究センター
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- AMED疾患特異的iPS細胞の利活用促進・難病研究加速プログラム
難治性骨軟骨疾患に対する革新的iPS創薬技術の開発と応用(22bm0804006h0006) - 日本学術振興会科学研究費助成事業
進行性骨化性線維異形成症の治療法開発に向けた病態解析(JP18H02928) - iPS細胞研究基金
7. 用語説明
注1)酸化的リン酸化
電子伝達系に共役して起こる一連のリン酸化(ATP合成)反応。 細胞内で起こる呼吸に関連した現象で、高エネルギー化合物のATPを産生する回路の一つ。
注2)間葉系幹細胞
骨・軟骨・脂肪細胞などといった間葉系の細胞に分化する能力を持った間質細胞。
注3)Activin A
トランスフォーミング増殖因子β(Transforming Growth Factor β、TGF-β)スーパーファミリーに属するタンパク質で、細胞増殖や分化など多くの活性作用を持つ。
注4)mTORC1(mechanistic target of rapamycin complex 1)
栄養素・エネルギー・酸化還元状態のセンサーとして機能し、タンパク質合成を制御するタンパク質複合体
注5)FAP(Fibro/Adipogenic Progenitor)
骨格筋組織内に存在して、骨格筋の線維化及び脂肪組織化の起源となる細胞でPDGFRα陽性の細胞。
注6)骨形成因子(Bone Morphogenic Protein、BMP)
TGF-βスーパーファミリーに属する、骨及び軟骨の分化を誘導、促進するタンパク質。
注7)ACVR1/ALK2
BMPの受容体を構成するタンパク質で、BMPと結合することで下流の分子を活性化する。
注8)酸素消費速度(Oxygen Consumption Rate、OCR)
酸素は主としてミトコンドリアでの酸化的リン酸化でATPが産生される過程で消費されることから、ミトコンドリアの活性の指標として使用されている。
注9)IACS -010759
ミトコンドリアのNADH-キノン酸化還元酵素(呼吸鎖複合体-I)に対する阻害剤。

