2024-06-20 基礎生物学研究所
オートファジーは真核生物におけるストレス応答における生体物質の分解およびアミノ酸や脂質などのリサイクリングに重要な役割を担っています。オートファゴソームの形成と成熟には、多数の因子が関わっていることが知られており、成熟の最終段階にESCRT(エスコート)複合体が関与していることが示唆されてきました。ESCRT構成因子は、細胞膜と相互作用する繊維状の重合体を形成し、オートファゴソーム膜を閉じる役割を果たしていることが知られています。しかしながら、ESCRTがオートファゴソームに誘導される分子機構には未知の部分が多いのが現状です。基礎生物学研究所 分子細胞学研究部門の磯野江利香客員教授(コンスタンツ大学 教授)らの研究グループは、モデル植物であるシロイヌナズナを用いて、塩ストレス下におけるオートファゴソーム成熟過程の制御因子としてCaLB1を同定しました。塩ストレスによってCaLB1遺伝子の発現が誘導され、CaLB1タンパク質がオートファゴソームへのESCRT複合体の誘導を促進することで、オートファゴソームの効率的な成熟を担っていることを見出しました。この成果は2024年6月19日にNature Communicationsに掲載されました。
【研究の背景】
すべての生物にとって、生育環境への適応は生存に必須のメカニズムです。例えば、高濃度の塩ストレス条件下では、機能不全のタンパク質凝集体や細胞内小器官が蓄積し細胞の恒常性を損なうことが知られていますが、細胞の機能維持にはこれらの不要な分子や膜構造体を、オートファジーを含む選択的分解経路によって細胞から速やかに取り除くことが重要です。二重膜構造をとるオートファゴソームは選択的または非選択的に細胞内分子を隔離し、除去・分解するために液胞に輸送します。オートファゴソーム成熟の最終段階ではオートファゴソーム膜が閉じられる必要がありますが、この過程にはESCRT複合体が関与していることが示唆されています。ESCRTは膜の修復、切断、封鎖を仲介する繊維状の重合体を形成することが知られており、ESCRTの膜構造への時空間的制御は膜のリモデリングを必要とする多くの細胞および生理学的プロセスにとって鍵となります。しかしながら、ESCRTがどのようにしてオートファゴソーム膜に誘導されるかについては解明が待たれていました。
【研究の成果】
本研究では、カルシウム依存性の脂質結合タンパク質CaLB1が、ESCRT構成因子であるALIXの相互作用分子であることを発見しました。CaLB1は塩ストレス下において発現が誘導されることがわかり、また、ゲノム編集によってCaLB1の機能を欠損させたcalb1植物体は、野生型と比べて塩ストレス感受性が高くなることを見出しました(図1)。
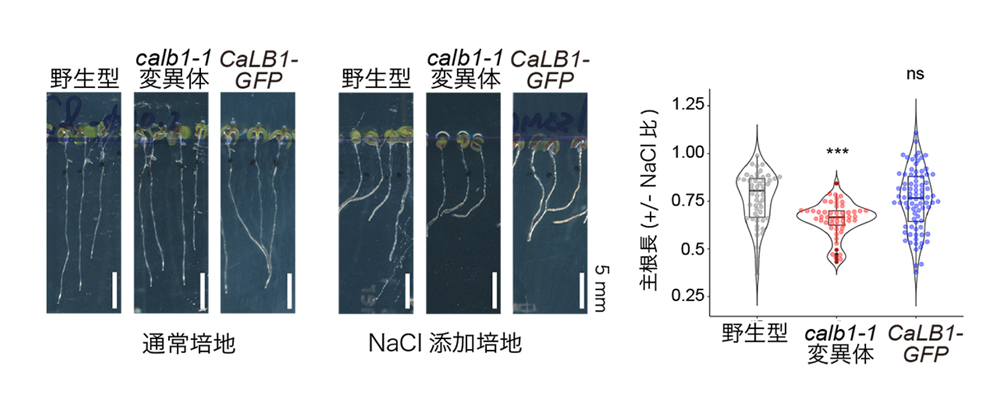 図1.calb1変異体では塩ストレス感受性が高くなる
図1.calb1変異体では塩ストレス感受性が高くなる
通常培地で7日間、あるいは播種後3日目に100 mMのNaClを含む培地に移した野生型、calb1-1変異体、およびCaLB1-GFPを発現させた形質転換体。NaCl添加培地での主根長と通常培地での主根長の比を右側に示す。野生型もcalb1-1機能欠損変異体も塩ストレスにより根が通常よりも短くなるが、calb1-1機能欠損変異体では野生型やCaLB1-GFP形質転換体に比べてより短くなり、塩ストレス感受性が高くなっていた。
またCaLB1はオートファゴソーム膜に存在するリン酸化脂質であるPI(3)Pおよびオートファジー膜の構成因子ATG8と相互作用し、ALIXとともにオートファゴソーム上の限られた領域に局在することを示しました(図2)。
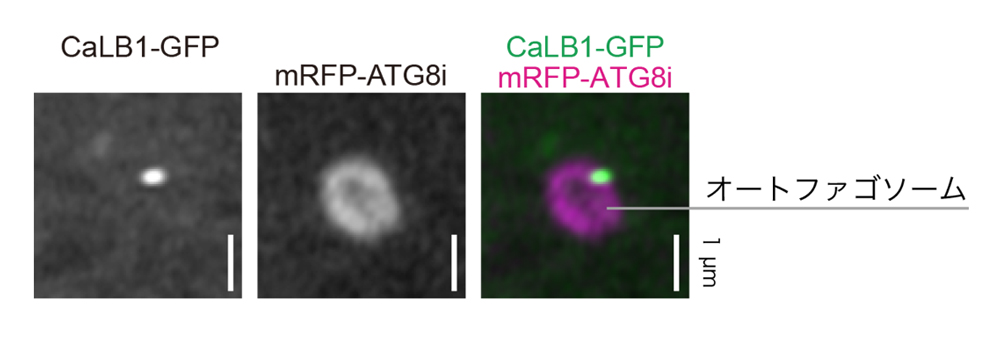 図2.CaLB1はオートファゴソーム上の特定の領域に局在する。
図2.CaLB1はオートファゴソーム上の特定の領域に局在する。
GFPを融合したCaLB1(CaLB1-GFP)を用いてCaLB1の所在を調べると、CaLB1は塩ストレスにより誘導されたオートファゴソーム膜上に点状の局在を示すことが明らかとなった(オートファゴソームはmRFP-ATG8i融合タンパク質を用いて可視化)。
さらに、CaLB1とALIXはともに天然変性領域を持ち、塩ストレス下においてオートファゴソーム膜上で分子凝縮体を形成することも明らかにしました。calb1変異体はオートファゴームの成熟と分解に遅延を示すことから、CaLB1依存的なESCRTタンパク質の凝集とオートファゴソーム膜への誘導がオートファジーの制御において重要な役割を果たしていることが示唆されました(図3)。
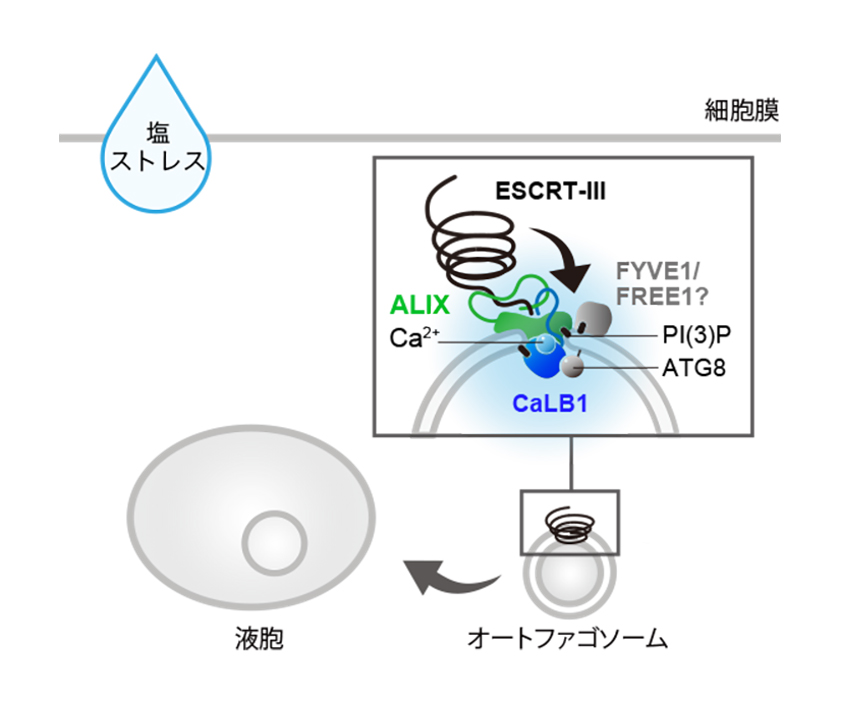 図3. CaLB1は塩ストレス下で誘導されたオートファゴソームの成熟に重要である。
図3. CaLB1は塩ストレス下で誘導されたオートファゴソームの成熟に重要である。
塩ストレス応答により誘導されたオートファゴソーム上では、CaLB1とESCRTタンパク質ALIXの相分離による凝縮体形成が起こる。これによりESCRT重合体との接触面が増え、より効率的にESCRTのポジショニングが行われオートファゴソーム膜が閉じられると推測される。
【今後の展望】
本研究ではエンドソーム上でのESCRT機能の解析に比べて焦点が当てられてこなかったオートファゴソーム膜へのESCRT誘導と膜切断の分子機構の一端を解明しました。この制御機構が塩ストレス以外のオートファジー誘導条件でも機能しているのか、あるいは別の因子が関与しているのかは今後の解析が待たれます。また1分子同士の相互作用と超えた凝集体の形成がESCRTの誘導に関わっていることは他の細胞内膜構造体でも知られており、ESCRTの誘導と凝集を促す共通の分子機構である可能性が示唆されました。植物の細胞内輸送における分子凝縮体の機能については、まだまだ知見が少ないですが、相分離による分子凝縮体の形成は生体分子のさらなる制御機構であり、幅広い細胞内現象に関与していることが予測されます。本研究で明らかとなったオートファゴソームの成熟過程は今後、さまざまなストレス下におけるオートファジーの過程を解明する足掛かりになることが期待されます。またオートファジーを含むストレス適応のさまざまな分子機構を理解し応用することで、よりストレス耐性を持つ植物の作出に寄与できる可能性が期待されます。
【発表雑誌】
雑誌名 Nature Communications
掲載日 2024年6月19日
論文タイトル:Arabidopsis CaLB1 undergoes phase separation with the ESCRT protein ALIX and modulates autophagosome maturation
著者:Niccolò Mosesso1, Niharika Savant Lerner1,2, Tobias Bläske1, Felix Groh1, Shane Maguire2,3, Marie Laura Niedermeier1,2, Eliane Landwehr2,3, Karin Vogel1, Konstanze Meergans1, Marie-Kristin Nagel1, Malte Drescher2,3, Florian Stengel1,2, Karin Hauser2,3, and Erika Isono1,2,4 *
1コンスタンツ大学生物学科 2コンスタンツ大学大学院ケミカルバイオロジー専攻 3コンスタンツ大学化学科 4基礎生物学研究所分子細胞学研究部門 *責任著者
DOI:https://doi.org/10.1038/s41467-024-49485-6
【本研究に関するお問い合わせ先】
基礎生物学研究所 分子細胞学研究部門
客員教授 磯野江利香
【報道担当】
基礎生物学研究所 広報室
図: © N. Mosesso et al.; https://doi.org/10.1038/s41467-024-49485-6; ライセンス: CC BY 4.0 より改変