2018-12-12 東京医科歯科大学,日本医療研究開発機構
ポイント
- 炎症性腸疾患(潰瘍性大腸炎・クローン病)は消化管に原因不明の炎症と腸上皮の傷害(潰瘍)が生じる「難病」です。
- 本研究では炎症性腸疾患の腸上皮で炎症応答を司るTNF-aと腸上皮の再生を司るNotchシグナルが協調して特定遺伝子群の発現を調節する機構を発見しました。
- TNF-aとNotchシグナルが協調して転写レベルで発現を調節する新規遺伝子としてUBD遺伝子を同定しました。
- 炎症性腸疾患の患者腸上皮におけるUBD蛋白は、高い活動性に応じ発現が増加する一方、治療薬である抗TNF-a抗体の効果により速やかに発現が減少することを明らかにしました。
- 炎症性腸疾患における抗TNF-a抗体療法の早期治療効果予測への応用が期待できます。
東京医科歯科大学・再生医療研究センター(岡本隆一教授)および大学院医歯学総合研究科消化器病態学分野(渡辺守教授(副学長・理事)、河本亜美大学院生ら)の研究グループは、炎症性腸疾患の腸上皮における炎症・再生を司るシグナルが協調して発現を制御する遺伝子として新たにUBD遺伝子を同定するだけでなく、患者腸上皮における同遺伝子の発現が疾患の活動性や抗TNF-a抗体療法の治療効果に応じて速やかに増減することを発見しました。この研究は文部科学省科学研究費補助金ならびに日本医療研究開発機構難治性疾患実用化研究事業「炎症性腸疾患における食関連リスク因子に関する研究」の支援で実施され、その研究成果は、国際科学誌Journal of Crohn’s and Colitis (ジャーナル・オブ・クローンズ・アンド・コライティス)に、2018年12月12日午前9時(英国時間)にオンライン版で発表されます。
研究の背景
炎症性腸疾患(潰瘍性大腸炎・クローン病)は消化管に原因不明の炎症と腸上皮の傷害(潰瘍)が生じる「難病」です。これまでの研究により、この病気の原因には免疫を担当する細胞、腸内細菌などに加えて「腸上皮」が密接に関わり、「腸上皮」が本来持つ機能や炎症への応答が大事な役割を担っていることが分かっています。また、「腸上皮」が適切な再生を全うすることが治療を行う上で極めて重要であることも分かっています。しかし炎症応答を司る代表的な*1サイトカインである*2TNF-aと腸上皮の再生を司る*3Notchシグナルがどのような関わりをもって病的な環境における腸上皮の機能を制御しているのか、についてはこれまで不明でした。また、難治性の炎症性腸疾患では抗TNF-a抗体が治療に使われますが、同治療が有効であるか否かを治療開始早期に予測し得る有用な指標(目安)についても、解明・開発が求められていました。
研究成果の概要
研究グループはNotchシグナルの活性化が人為的に制御できるヒト腸上皮細胞株を用いた解析系を作成し、これにTNF-aを添加した際の応答を解析したところ、TNF-a下流の*4NF-kBシグナル(炎症シグナル)とNotchシグナル(再生シグナル)とが協調して相互に強め合う機構が存在することを発見しました(図1)。またヒト腸上皮において両シグナルの協調により制御される遺伝子群を*5マイクロアレイ法により網羅的に検索したところ、最も発現が誘導される(亢進する)遺伝子として*6ユビキチン様蛋白をコードするUbiquitinD(UBD)遺伝子を同定し、同遺伝子が転写レベルで制御される事を示しました。さらにヒト腸上皮細胞株や患者由来の「*7腸上皮オルガノイド」を用いた解析により、UBD蛋白がヒト腸上皮細胞内で恒常的に*8ユビキチン-プロテアソーム系による分解を受け、このため極めて半減期の短い性質を保ち、抗TNF-a抗体やNotch阻害薬により速やかな発現低下が誘導されることを明らかとしました。実際、炎症性腸疾患患者の腸粘膜では、活動性の炎症に伴い腸上皮におけるUBD発現が亢進している一方、抗TNF-a抗体治療が有効であった潰瘍性大腸炎患者の腸粘膜組織では腸上皮におけるUBDの発現が早期より減少していました(図2)。これらの結果から、炎症性腸疾患患者の腸上皮におけるUBDの発現が抗TNF-a抗体治療の効果を予測する指標となり得る可能性が考えられました。
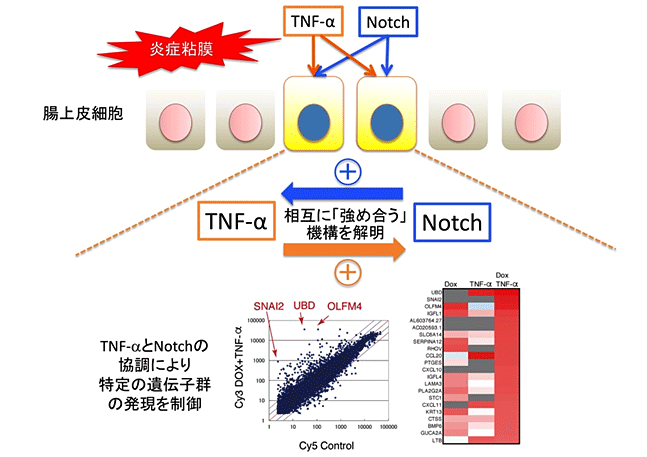
図1 腸上皮におけるTNF-aとNotchの協調による遺伝子発現制御
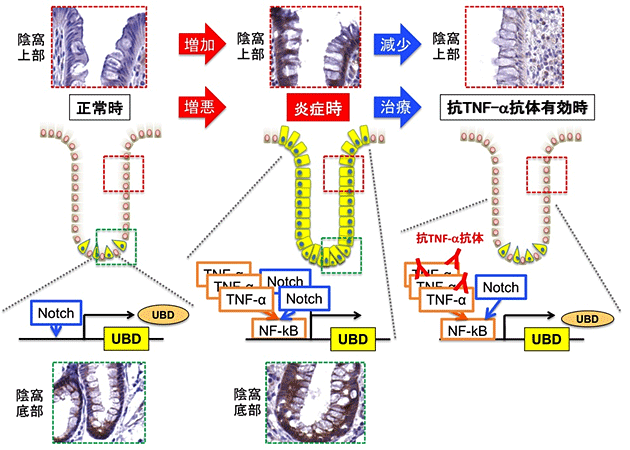
図2 炎症性腸疾患患者におけるUBDの発現変化
研究成果の意義
これまで炎症応答と再生応答が同時に進行する炎症性腸疾患患者の腸上皮内において、どのように異なる応答間の統合もしくは協調が行われ、病態を形成しているのか、その詳細は明らかではありませんでした。研究グループは炎症応答を司る主要なサイトカインであるTNF-aと再生応答を司る主要な分子シグナル系であるNotchシグナルが腸上皮細胞内で相互に協調して遺伝子発現を調節することを初めて明らかとしました。また、同機構により転写調節を受ける代表的な遺伝子としてUBDを同定するだけでなく、炎症性腸疾患の活動性に伴い腸上皮での発現が誘導されること、抗TNF-a抗体治療の効果に伴い速やかに発現が低下することを明らかにしました。本研究成果は炎症性腸疾患の疾患活動性に伴い鋭敏に発現が変動する新規遺伝子を明らかにしたものであり、特に抗TNF-a抗体の有効性を客観的に予測・判定する新たな病理学的指標として活用することにより、同治療の効果を早期かつ正確に予測可能となることが期待できます。
用語解説
- *1サイトカイン
- 免疫を司る細胞等から放出されるタンパク質で、自身を含むさまざまな細胞に生理作用を発揮し、細胞間情報伝達・細胞間相互作用を担う。
- *2TNF-a
- 腫瘍壊死因子(TNF)と称され、生体内で炎症が起きた際に多く産生されるサイトカインの一つ。炎症性腸疾患の病態に深い関わりがあることが知られている。
- *3Notchシグナル
- 細胞表面のNotch受容体により活性化される細胞内情報伝達機構の一つ。腸上皮の増殖・分化・再生を司る主たる分子機構として知られている。
- *4NF-kBシグナル
- TNF-aの刺激を受けた細胞内で活性化する分子シグナル経路。NF-kBは複数蛋白の複合体から成り、細胞内でさまざまな遺伝子の転写調節因子として機能する。
- *5DNAマイクロアレイ法
- 数万以上の遺伝子の発現について網羅的に比較・解析する手法。基板上に高密度に固定された遺伝子特異的配列を持つDNA分子を利用する。
- *6ユビキチン様蛋白
- 翻訳後修飾に関わるユビキチン分子と似た構造をもつ蛋白の総称。標的となる蛋白に結合することにより、蛋白の分解・機能の変換等に関与しているとされる。
- *7腸上皮オルガノイド
- 体外で腸上皮幹細胞を培養した際に構成され、単層上皮で中空構造を持つ3次元構造体。構成細胞は基底膜側が外側を向いた極性を有し、生体内の「腸陰窩」に類似した構造を形成し得ることから、「ミニ腸」と称される。
- *8ユビキチン-プロテアソーム系
- ユビキチンで標識された蛋白を認識し、酵素複合体から成る「プロテアソーム」によりこれを分解する細胞内機構。細胞周期制御や細胞内情報伝達等に関わることが知られている。
論文情報
- 掲載誌:Journal of Crohn’s and Colitis
- 論文タイトル:Ubiquitin D is Upregulated by Synergy of Notch Signalling and TNF-α in the Inflamed Intestinal Epithelia of IBD Patients
問い合わせ先
研究に関すること
東京医科歯科大学統合研究機構
再生医療研究センター 岡本 隆一(おかもと りゅういち)
東京医科歯科大学大学院医歯学総合研究科
消化器病態学分野 河本 亜美 (かわもと あみ)
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
戦略推進部 難病研究課