2026-02-05 兵庫県立大学
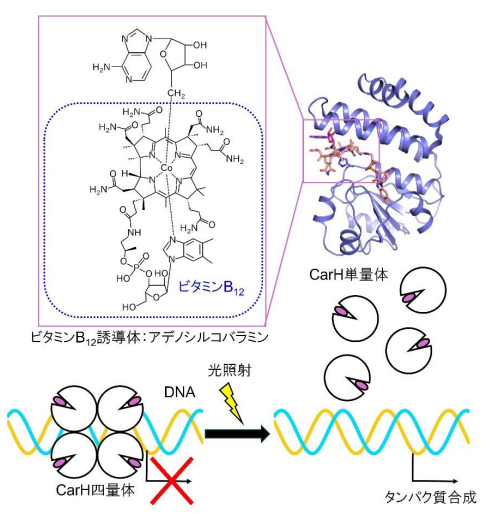
図 1 CarH の構造と機能。CarH は光を感知するためにビタミン B12 を利用している。 CarH が光を受けると四量体から単量体へと構造が変化し、DNA に結合できなくなる。
<関連情報>
- https://www.u-hyogo.ac.jp/news/pressrelease/20260205press.html
- https://www.u-hyogo.ac.jp/20260205press.pdf
- https://www.nature.com/articles/s41586-025-10074-2
動的構造解析によるビタミン B12光受容体タンパク質の活性化機構の解明 Integrated structural dynamics uncover a new B12 photoreceptor activation mode
Ronald Rios-Santacruz,Harshwardhan Poddar,Kevin Pounot,Derren J. Heyes,Nicolas Coquelle,Megan J. Mackintosh,Linus O. Johannissen,Sara Schianchi,Laura N. Jeffreys,Elke De Zitter,Rory Munro,Martin Appleby,Danny Axford,Emma V. Beale,Matthew J. Cliff,María C. Dávila-Miliani,Sylvain Engilberge,Guillaume Gotthard,Kyprianos Hadjidemetriou,Samantha J. O. Hardman,Sam Horrell,Jochen S. Hub,Kotone Ishihara,Sofia Jaho,… Giorgio Schirò
Nature Published:04 February 2026
DOI:https://doi.org/10.1038/s41586-025-10074-2
Abstract
Photoreceptor proteins regulate fundamental biological processes such as vision, photosynthesis and circadian rhythms1. A large photoreceptor subfamily uses vitamin B12 derivatives for light sensing2, contrasting with the well-established mode of action of these organometallic derivatives in thermally activated enzymatic reactions3. The exact molecular mechanism of B12 photoreception and how this differs from the thermal pathways remains unknown. Here we provide a detailed description of photoactivation in the prototypical B12 photoreceptor CarH4,5 from nanoseconds to seconds, combining time-resolved and temperature-resolved structural and spectroscopic methods with quantum chemical calculations. Building on the crystal structures of the initial tetrameric dark and final monomeric light-activated states5, our structural snapshots of key intermediates in the truncated B12-binding domain illustrate how photocleavage of a cobalt–carbon (Co–C) bond within the B12 chromophore adenosylcobalamin triggers a series of structural changes that propagate throughout CarH. Breakage of the photolabile Co–C5′ bond leads to the formation of a previously unknown adduct that links the C4′ position of the adenosyl moiety to the Co ion and can subsequently be cleaved thermally over longer timescales to allow release of the adenosyl group, ultimately causing tetramer dissociation4,5. This adduct, which differentiates CarH from thermally activated B12 enzymes, steers the photoactivation pathway and acts as the molecular bridge between photochemical and photobiological timescales. The biological relevance of our study is corroborated by kinetic data on full-length CarH in the presence of DNA. Our results offer a spatiotemporal understanding of CarH photoactivation and pave the way for designing B12-dependent photoreceptors for optogenetic applications.