ATG12結合系の共有結合から非共有結合への進化
2019-03-26 東京大学,科学技術振興機構
ポイント
- オートファジーを起こすためには、ATGたんぱく質群のうち、ATG12とATG5が共有結合によって連結しなければならないことが知られていました。
- 今回マラリア原虫やトキソプラズマのような寄生虫、一部の酵母では、ATG12とATG5が非共有結合によって結合していることを発見し、高度に保存されているオートファジー遺伝子も進化の過程で大きく変化し得ることを明らかにしました。
- 共有結合によるたんぱく質の連結は、たんぱく質のユビキチン化などにおいて広く見られますが、本研究成果は、共有結合性複合体の一部は、より単純な非共有結合性複合体へと進化し得ることを示しました。
たんぱく質がその機能を発揮するためには、さまざまな分子の共有結合注1)による修飾を受けることがあります。その1つがたんぱく質同士の共有結合で、たんぱく質のユビキチン化注2)などで広く見られます。細胞内の主要分解系として知られるオートファジー注3)において重要な役割をつかさどるオートファゴソームという膜構造体は、多数のATGたんぱく質群によって作られますが、その中のATG12とATG5も共有結合によって連結して働いています(図1、図2)。これは酵母や動植物などを含む、全ての生物で共通であると考えられてきました。
今回、東京大学 大学院医学系研究科の水島 昇 教授らの研究グループは、中国農業科学院 ハルビン獣医研究所のHonglin Jia(ホンリン・ジア) 准教授、京都大学 大学院農学研究科の阪井 康能 教授、微生物化学研究会の野田 展生 部長、長崎大学 大学院熱帯医学・グローバルヘルス研究科の北 潔 教授らのグループと共同で、マラリア原虫やトキソプラズマのような寄生虫や一部の酵母では、ATG12とATG5が非共有結合注4)による複合体として機能していることを発見しました。本研究成果は、高度に保存されているオートファジー遺伝子も進化の過程で大きく変化していることを示すとともに、結合が強い共有結合性のたんぱく質複合体の一部が、結合が弱い非共有結合性のたんぱく質複合体へと縮小進化し得ることを示しました。
本研究成果は、2019年3月25日(英国時間)に「Nature Structural and Molecular Biology」オンライン版で公開されました。
本研究は科学技術振興機構(JST) 戦略的創造研究推進事業 総括実施型研究(ERATO)「細胞内分解ダイナミクスプロジェクト」(研究総括:水島 昇)および日本学術振興会 新学術領域研究「オートファジーの集学的研究」(領域代表:水島 昇)の計画研究「オートファジーの生理・病態生理学的意義とその分子基盤」として行われました。
(1)研究の背景
オートファジーは、細胞内の主要な分解系であり、飢餓時の栄養のリサイクルや細胞内の構成成分の品質の維持に重要な役割を果たします。オートファジーでは、オートファゴソームという特殊な膜構造体が細胞内のたんぱく質や細胞小器官を取り囲み、リソソームと呼ばれる細胞小器官と融合し、リソソームに含まれる多数の分解酵素によって最終的に分解に至ります(図1)。オートファゴソームの形成には数多くのATGたんぱく質群が必要であり、その多くは2016年のノーベル医学・生理学賞を受賞した大隅 良典 博士(現所属:東京工業大学 栄誉教授)らのグループなどにより同定されてきました。その1つであるATG12たんぱく質が機能するためは、ATG5という別のたんぱく質と共有結合する必要があることが1998年にサッカロミセス酵母(Saccharomyces cerevisiae、出芽酵母の一種)で明らかになりました(図2)。このATG12共有結合システムは、オートファジーとは別の選択的たんぱく質分解機構で用いられる「ユビキチン化」と類似しており、たんぱく質同士の共有結合による修飾という概念の拡大にも貢献しました。
その後の研究から、オートファジーの中にさらにもう1つ類似した共有結合システムがあることも分かりました。それはATG8というATG12と似たたんぱく質が、リン脂質の1種類であるホスファチジルエタノールアミン(PE)と共有結合するというものです(図2)。ATG8はほとんどの生物ではオートファゴソームの膜に、マラリア原虫などではアピコプラスト膜注5)に存在しています。さらに、ATG12とATG5の共有結合体(ATG12-ATG5複合体)は、ATG8とリン脂質の共有結合を促進するという、2つのシステムの関係も明らかとなりました(図2、+の矢印の経路)。ATG12とATG8の2つの共有結合システムは、サッカロミセス酵母だけではなく、動物や植物などで調べられた全ての生物におけるオートファゴソーム形成に必要なことが分かり、これまでの20年間にわたって、オートファジーの中心的な分子機構であると考えられてきました。
(2)研究の内容
本研究では、まずマラリア原虫やトキソプラズマのような寄生虫でのATG12共有結合システムの存在を調べました。その結果、ATG12とATG5の共有結合に必要な酵素であるATGたんぱく質群の1つであるATG10の遺伝子がゲノムに存在しないことや、ATG5との共有結合に必要なATG12の末端のグリシン残基が欠損していることが分かりました(図2)。実際に、これらの寄生虫ではATG12とATG5は共有結合できないことも判明しました。しかし、動植物やサッカロミセス酵母と異なり、ATG12とATG5は、結合が弱い非共有結合による単純な複合体を形成しており、それがATG8とリン脂質の結合を促進していることが明らかとなりました(図3)。つまり、マラリア原虫やトキソプラズマなどの寄生虫には共有結合性のATG12-ATG5複合体を形成するための「ATG12結合システム」がないことが分かりました。これまで調べられていた生物では、ATG8とリン脂質の結合の促進には、共有結合性のATG12-ATG5複合体が必要と考えられてきましたが、非共有結合性の複合体でも、ATG8とリン脂質の結合を促進できることを示しています。
さらに、マラリア原虫やトキソプラズマなどの寄生虫だけではなく、いくつかの真菌でもこのようなATG12結合システムの共有結合から非共有結合への進化が起こっていることも分かりました(図4)。実際の実験によっても、コマガタエラ酵母(Komagataella phaffii)、なかでも異種たんぱく質生産に用いられているメタノール資化性酵母(旧名Pichia pastoris)では非共有結合性のATG12-ATG5複合体がオートファジーに必要であることが明らかになりました。
本研究成果は、高度に保存されているオートファジー遺伝子も進化の過程で変化していることを示しました。また、ユビキチン化などに代表される共有結合性たんぱく質複合体の一部は、より単純な非共有結合性たんぱく質複合体へと進化し得ることを示しました。最終的なATG12の結合相手はATG5だけなので、そのために特異的な酵素やエネルギーを必要とする共有結合系を維持するよりは、エネルギーを必要としない単純な非共有結合を可能とする結合面を形成する方が生存に有利であったと考えられます。
(3) 社会的意義
マラリアやトキソプラズマ症はまだ世界で多くの感染者がいます。特に、薬剤耐性のマラリアは深刻な問題になっています。ATG12やATG8結合システムはマラリア原虫やトキソプラズマの必須小器官であるアピコプラストの合成に必要であるため、今回の非共有結合性のATG12-ATG5複合体の発見は、マラリアやトキソプラズマ症の制御のための新しいターゲットとなり得る可能性があります。また、非共有結合性のATG12-ATG5複合体が発見されたコマガタエラ酵母は、人工的なたんぱく質生産系として用いられているため、その効率向上に向けた有用情報を提供するものと期待されます。
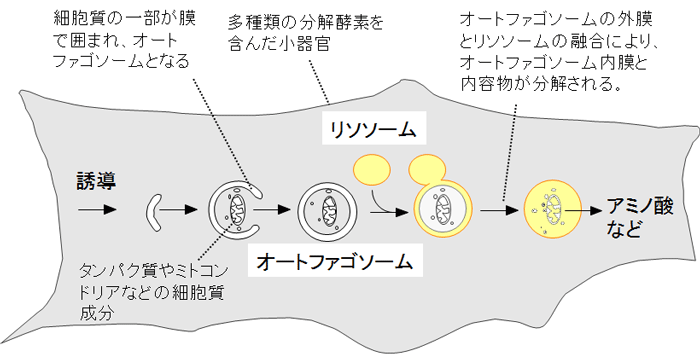
図1 オートファジーの仕組み
オートファジーが誘導されると、オートファゴソームが細胞質成分を取り囲みながら形成される。続いてオートファゴソームはリソソームと融合し、オートファゴソームで囲んだ細胞質成分が分解される。細胞質成分の分解により生じたアミノ酸などの分解産物は再利用される。
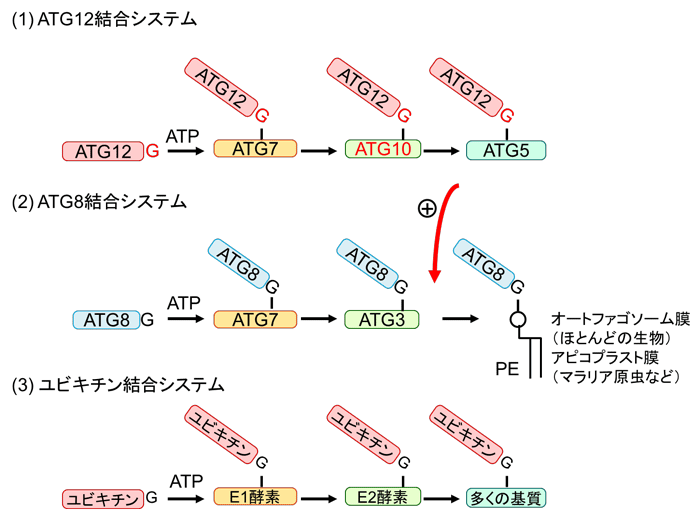
図2 共有結合によるたんぱく質同士の結合システムの例(ATG12結合システム、ATG8結合システムおよびユビキチン結合システム)
(1)共有結合によるATG12結合システム。ユビキチン類似たんぱく質であるATG12の末端のグリシン(G)が酵素ATG7によってエネルギー(ATP)依存的に活性化され、次に酵素ATG10に受け渡され、最終的にATG5に共有結合する。マラリア原虫などでは、ATG12の末端グリシンやATG10が欠損している。
(2)ATG8結合システム。ユビキチン類似たんぱく質であるATG8も同様に2つの酵素(ATG7とATG3)の働きと、ATG12-ATG5共有結合体の働きによって(+の矢印)リン脂質であるホスファチジルエタノールアミン(PE)と共有結合する。ATG8はほとんどの生物ではオートファゴソーム膜に、マラリア原虫などではアピコプラスト膜に存在する。
(3)ユビキチン結合システム。ユビキチンの末端のグリシン(G)がE1酵素によってエネルギー依存的に活性化され、次にE2酵素に受け渡され、多くの基質に共有結合する。ATG12とATG8のシステムはこのユビキチン化とよく似ている。
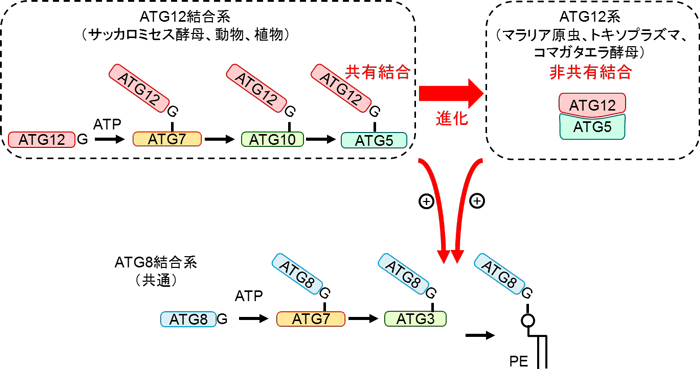
図3 ATG12結合の共有結合から非共有結合への進化
サッカロミセス酵母、動物、植物などで見られるエネルギー(ATP)を必要とするATG12共有結合システムは、エネルギーを必要とせず単純な非共有結合性のたんぱく質複合体形成へと進化している。ATG8のリン脂質修飾を促進するという機能はどちらのシステムも持っている。
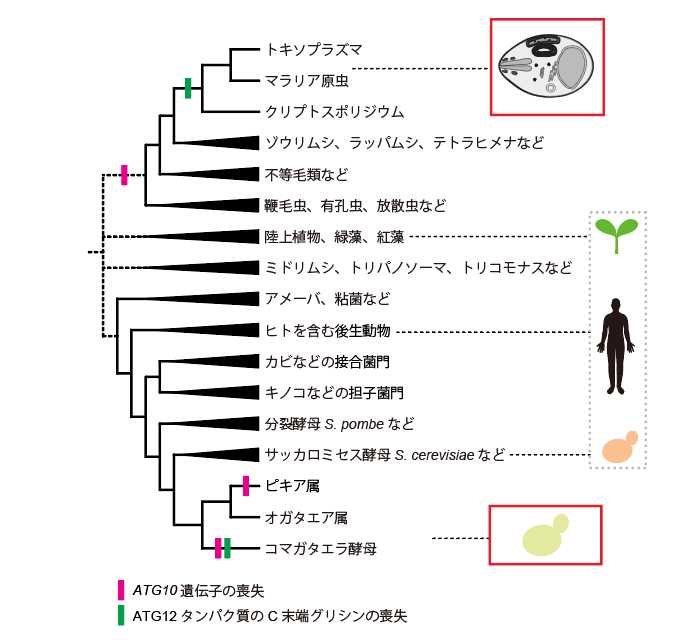
図4 主要な真核生物におけるATG12結合システムの進化の概略
ATG12とATG5の共有結合があることがこれまで分かっていた、サッカロミセス酵母、ヒトを含む動物、植物(破線四角)と、今回明らかになった、ATG12とATG5の結合が非共有結合になったもの(実線四角)をハイライトした。
- 注1)共有結合
- 原子と原子の間で電子対を共有することで形成される強力な化学結合。分子の中での原子の結合は基本的に共有結合であり、直線で表されることが多い(例:水分子の酸素と水素の結合、1本のDNA中の塩基と塩基の結合、たんぱく質中のアミノ酸の結合など)。分子と分子が共有結合することもある。共有結合を形成するには大きなエネルギーが必要である。熱や薬剤によって乖離しないほど、結合が強い。
- 注2)ユビキチン化
- ユビキチンは76個のアミノ酸からなる進化的に高度に保存されたたんぱく質である。ユビキチンは、エネルギー依存的な酵素反応によって他のたんぱく質に共有結合することができ、この反応をユビキチン化という(図2)。4つ以上のユビキチンが結合すると、それが分解の標識となって、ユビキチン化されたたんぱく質はプロテアソームによって分解される。分解誘導がユビキチンの最も重要な機能であるが、ユビキチンには他の働きがあることも分かっている。
- 注3)オートファジー
- 細胞の主要な分解機能の1つ。オートファゴソームが細胞質成分(細胞質ゾルやミトコンドリアなどの細胞内小器官)を取り囲み、リソソーム(分解酵素を格納している細胞内小器官)と融合することで分解する仕組み(図1)。その生理的機能としては、飢餓への適応や細胞内の恒常性維持などが知られており、近年では特に神経変性疾患などとの関連が注目されている。大隅 良典 博士のグループなどによるこれまでの研究で、数多くのATGたんぱく質群がオートファゴソームの形成に関わっていることが明らかにされてきた。
- 注4)非共有結合
- 電子対の共有を伴わない結合で、分子と分子の結合は一般に非共有結合である(例:水分子と水分子の結合、2本のDNA間の結合、一般的なたんぱく質同士の結合など)。イオン間相互作用、水素結合、ファンデルワールス力による結合などによる。静電的な結合であるため、エネルギーを必要としない。共有結合と比較すると結合は弱い。
- 注5)アピコプラスト膜
- マラリア原虫やトキソプラズマなどのアピコンプレクサ類に属する原虫に特有の小器官で、生存に必要である。葉緑体が起源であると考えられるが、光合成はしない。これらの原虫では、ATG8結合系はアピコプラストの合成や分配に必要であると考えられている。オートファゴソームとアピコプラストには直接の関係がなく、なぜ両者に共通の仕組みが使われているかは不明である。
- タイトル
- “Evolution from covalent conjugation to non-covalent interaction in the ubiquitin-like ATG12 system”
- 著者
- Yu Pang, Hayashi Yamamoto, Hirokazu Sakamoto, Masahide Oku, Joe Kimanthi Mutungi, Mayurbhai Himatbhai Sahani, Yoshitaka Kurikawa, Kiyoshi Kita, Nobuo N. Noda, Yasuyoshi Sakai, Honglin Jia, and Noboru Mizushima
- DOI
- 10.1038/s41594-019-0204-3
水島 昇(ミズシマ ノボル)
東京大学 大学院医学系研究科 分子細胞生物学専攻 分子生物学分野 教授
内田 信裕(ウチダ ノブヒロ)
科学技術振興機構 研究プロジェクト推進部
東京大学 大学院医学系研究科 総務係
科学技術振興機構 広報課