多能性幹細胞から全能性の謎に迫る
2019-08-09 理化学研究所,大阪医科大学
理化学研究所(理研)生命機能科学研究センター網膜再生医療研究開発プロジェクトのコーディ・カイム基礎科学特別研究員、大阪医科大学薬理学教室の友田紀一郎講師らの共同研究グループ※は、マウスの多能性[1]幹細胞を初期化[2]した後に分化させることで、着床可能な胚盤胞[3]様の構造を誘導することに成功しました。
本研究成果は、受精卵などごく限られた細胞にのみ備わる分化全能性[1]や、哺乳類の発生に必須な着床に関わる分子機構の解明に貢献すると期待できます。
哺乳類の受精卵が卵割を繰り返すと、胚盤胞と呼ばれる袋状の構造が作られます。胚盤胞では、将来胎盤となる栄養外胚葉と体となる内部細胞塊の2種類が分化し、着床に向けた準備が進められます。内部細胞塊は「多能性」の幹細胞ですが、受精卵の特徴である「全能性」を持たないため、胚盤胞より発生の進んだ細胞から胚盤胞そのものを作ることはこれまで成功していませんでした。
今回、共同研究グループは、マウスの多能性幹細胞の培養条件を操作することで、自律的に立体を形成し、着床する能力を持つ胚盤胞様の構造(誘導性胚盤胞様嚢胞、iBLC)を誘導することに成功しました。iBLCは栄養外胚葉や胚盤胞のマーカー遺伝子を発現し、またiBLCを形成する前駆体の細胞では、全能性に関わる遺伝子の活性化が観察されました。この実験系は、受精卵から胚盤胞の分化、着床にいたる生命機能の解明のための有用なモデルになると考えられます。
本研究は、米国の科学雑誌『Stem Cell Reports』オンライン版(8月8日付け:日本時間8月9日)に掲載されます。
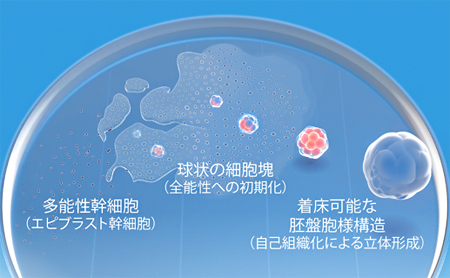
図 多能性幹細胞を培養し、立体的な胚盤胞の分化を再現する
※共同研究グループ
理化学研究所 生命機能科学研究センター
網膜再生医療研究開発プロジェクト
基礎科学特別研究員 コーディ・カイム(Cody Kime)
プロジェクトリーダー(研究当時) 髙橋 政代(たかはし まさよ)
(現客員主管研究員)
生体モデル開発ユニット
ユニットリーダー 清成 寛(きよなり ひろし)
大阪医科大学
薬理学教室
講師 友田 紀一郎(ともだ きいちろう)
教授 朝日 通雄(あさひ みちお)
内科学II教室
技術補助員 光林 永子(こうばやし えいこ)
金沢医科大学 総合医学研究所 生命科学研究領域
准教授 大塚 哲(おおつか さとし)
京都大学 iPS細胞研究所
所長・教授 山中 伸弥(やまなか しんや)
(米国グラッドストーン研究所 上席研究員)
※研究支援
本研究の一部は、日本学術振興会(JSPS)科学研究費補助金基盤研究C「ヒト細胞におけるX染色体制御機構の解明(研究代表者:友田紀一郎)」、鈴木謙三記念医科学応用研究財団助成「医療応用、工業化を目指したヒトiPS細胞の質を向上させる初期化技術の開発(研究代表者:友田紀一郎)」、大阪医科大学研究拠点育成奨励助成「再生医療実用化のための創薬及び臓器再建を目指した包括的研究(研究代表者:朝日通雄)」による支援を受けて行われました。
背景
哺乳類の受精卵が細胞分裂(卵割)を繰り返し、明瞭に分化した胚構造として最初に現れるのが胚盤胞です。胚盤胞は、卵割によって生じた空間を覆う細胞層と、その内部にある細胞集団から成り、前者を栄養外胚葉、後者を内部細胞塊と呼びます。胚盤胞が着床すると、栄養外胚葉からは胎盤などの胚外組織が形成されます。内部細胞塊は、エピブラスト[4]という未分化な状態を経て増殖、分化し、胚体へと発生します。着床前の内部細胞塊と着床後のエピブラストは、体の全ての細胞を作り出す能力である「多能性」を持つ幹細胞(多能性幹細胞)です。
一方、受精卵と初期の卵割(マウスでは4~8細胞期まで)で生じる細胞は、胚体と胚外組織のいずれにも分化できる「全能性」を持ち、通常は胚体外組織に分化できない多能性幹細胞とは区別されます。これまで、多能性幹細胞からさまざまな細胞や組織を分化させる研究が進められてきましたが、機能的な胚盤胞の形成に成功した例はありませんでした。
共同研究グループは、受精卵の全能性や胚盤胞の着床など哺乳類の発生に必須である生命現象を解明するための実験系として、多能性幹細胞から胚盤胞を誘導する手法の開発に取り組みました。
研究手法と成果
共同研究グループはこれまで、マウスの着床後のエピブラストから樹立した多能性幹細胞(エピブラスト幹細胞[4]、mEpiSC)が、特定の培養条件下で着床前の内部細胞塊の状態に初期化する過程で注1)、胚盤胞に似た半球状の構造を形成することを見いだしていました。
本研究ではこの培養条件をさらに工夫し、BMP4[5]などの増殖因子や、SMAD2/3[6]細胞内シグナル伝達因子の阻害剤などを、2段階に分けて培養液に添加することで、胚盤胞により近い袋状の構造が7日目までに出現することを確認しました(図1)。この構造は、薬剤添加後5.5日目に培養液中に小さな球状の細胞塊として浮遊し始めたものが、自律的に成長・変形したものでした。共同研究グループは、mEpiSCから誘導されたこの構造を、「誘導性胚盤胞様嚢胞」を意味するiBLC(induced blastocyst-like cyst)と名付けました。
注1)Kime, C., Sakaki-Yumoto, M., Goodrich, L., Hayashi, Y., Sami, S., Derynck, R., Asahi, M., Panning, B., Yamanaka, S., and Tomoda, K. (2016). Autotaxin-mediated lipid signaling intersects with LIF and BMP signaling to promote the naive pluripotency transcription factor program. Proc. Natl. Acad. Sci. 113, 12478–12483.
iBLCの誘導を引き起こす分子機構を調べるため、mEpiSCからiBLCが形成されるまでの間に、全能性や細胞分化に関わる遺伝子の発現がどのように変化するかを観察しました。その結果、マウス2細胞期の全能性を示すMERVLレポーター遺伝子[7]はmEpiSCでは発現せず、誘導開始5~6日目に活性化し、その後発現が弱くなることが分かりました(図2左)。また、生殖細胞系列や初期胚で機能するPrdm14[8]遺伝子は、mEpiSCでは極めて低い発現しか見られませんでしたが、iBLCでは発現が誘導されていました。
そこで、Prdm14遺伝子の機能をshRNA法[9]で阻害する実験を行ったところ、mEpiSCと誘導5日目までの細胞には目立った影響は観察されませんでしたが、誘導開始6日目でiBLCの前駆体(iBLC-PC)の細胞が退縮し、iBLCは形成されなくなりました(図2右)。これらの結果から、iBLCの誘導にはPrdm14遺伝子の機能が必要であり、その際には2細胞期と同様に全能性に関わる遺伝子の活性化が生じていることが示されました。
次に、iBLCが本来の胚盤胞の機能をどれだけ再現しているかを調べました。胚盤胞を構成する内部細胞塊と栄養外胚葉は、それぞれ異なる遺伝子を発現します。これらの遺伝子発現を胚盤胞とiBLCで比較したところ、サンプルごとの発現量の差が大きく、発生段階や誘導の程度に幅があることが考えられました。
しかし、全体的な傾向として卵割期で発現が誘導される遺伝子群は胚盤胞と同等の、それ以降で活性化する遺伝子群は胚盤胞より低い発現量でした。
一方、胚盤胞の分化に伴い細胞内局在を変えることが知られている転写因子YAP[10]は、iBLCの外側の細胞では核内に局在し、内側の細胞では核外に移行していました。これは、胚盤胞の栄養外胚葉と内部細胞塊で観察される細胞内局在とそれぞれ一致しており、YAPタンパク質はiBLCでも胚盤胞と同様の核移行制御を受けていることが示唆されました(図3)。
最後に、iBLCが着床し、個体へと発生する能力を持っているかを、偽妊娠マウスの子宮内移植により確認しました。移植による脱落膜[11]の誘導率は、胚盤胞に比べて低いものの、iBLCでのみ観察され、mEpiSCの凝集体や胚様体(EB)[12]では皆無でした(図4)。また、この脱落膜を組織観察すると、正常な脱落膜と同様の血管構造や赤血球が見られたことから、母体からの血液が供給されていることが分かりました。着床したiBLCは通常の胚盤胞と同様に増殖および分化の兆しを見せるものの、その後正常な細胞形態を失って収縮し、胎児吸収と似た状態となって個体へと発生することはありませんでした。
今後の期待
多能性幹細胞から胚盤胞を誘導する試みは、これまで少数報告されていました。しかしこれらは、40日以上の長期間培養を経て出現した着床能力の不明なものや、栄養外胚葉と内部細胞塊それぞれに由来する2種類の幹細胞(ES細胞と胎盤幹細胞)を特定の比で混ぜ共培養して得られたものなど、実際の発生過程との差異が課題でした。
これらに対してiBLCは、1種類の多能性幹細胞に由来します。さらに、全能性を持った状態に初期化された細胞から胚盤胞様の構造が自律的に形成され、着床する能力までを獲得していることから、iBLCは哺乳類の初期発生に特徴的なこれらの現象を研究する有用なモデルとしての利用が期待できます。
今後、iBLC-PCからiBLCを誘導する培養条件をさらに検討することで、胚盤胞により近いiBLCの誘導を実現し、全能性幹細胞の分化から、着床後の個体発生の再現を目指します。また全能性を与える培養条件を改良していくことにより、再生医療などで利用される多能性幹細胞の質を向上させることが可能になるかもしれません。
原論文情報
Cody Kime, Hiroshi Kiyonari, Satoshi Ohtsuka, Eiko Kohbayashi, Michio Asahi, Shinya Yamanaka, Masayo Takahashi, and Kiichiro Tomoda, “Induced 2C Expression and Implantation-Competent Blastocyst-Like Cysts from Primed Pluripotent Stem Cells”, Stem Cell Reports, 10.1016/j.stemcr.2019.07.011
発表者
理化学研究所
生命機能科学研究センター 網膜再生医療研究開発プロジェクト
基礎科学特別研究員 コーディ・カイム(Cody Kime)
大阪医科大学 薬理学教室
講師 友田 紀一郎(ともだ きいちろう)
お問い合わせ先
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
報道担当
理化学研究所 広報室 報道担当
学校法人大阪医科薬科大学 法人広報室
補足説明
-
- 多能性、全能性
- 多能性とは、体を構成するさまざまな細胞に分化する能力のこと。多能性を保持したまま増殖する能力を兼ね備えた細胞は多能性幹細胞と呼ばれ、胚盤胞の内部細胞塊に由来する胚性幹細胞(ES細胞)や、分化した細胞のリプログラミングにより得られる人工多能性幹細胞(iPS細胞)などがある。これに対し、体を作る能力と、胎盤系の体外組織を作る能力を同時に持つ性質を全能性と呼び、哺乳類では受精卵と初期の割球などごく限られた細胞に備わっている。
-
- 初期化
- 細胞の分化状態は、DNAの修飾やDNA結合タンパク質の働きで「記憶」されていると考えられ、この記憶を消すことで細胞を分化前の状態に戻すことを初期化、あるいはリプログラミングと呼ぶ。
-
- 胚盤胞
- 受精卵が数回の卵割を経て桑実胚となった後、卵割腔が出現した着床前の胚を指す。中空のボール状の構造をとり、胎児の体を作る内部細胞塊と、将来胎盤へ分化する1層の外側の細胞群(栄養外胚葉)に分かれている。
-
- エピブラスト、エピブラスト幹細胞(mEpiSC)
- エピブラストは、胚盤胞が着床した後、内部細胞塊から発達する細胞層のこと。エピブラストから、将来の外胚葉、中胚葉、内胚葉が分化する。ES細胞が内部細胞塊から樹立されるのに対し、エピブラストから樹立した多能性幹細胞をエピブラスト幹細胞と呼ぶ。mEpiSCはmouse epiblast stem cellsの略。
-
- BMP4
- 細胞の増殖や分化を刺激する分泌因子の一つ。骨形成タンパク質(Bone Morphogenetic Protein)として見つかったことからこの名が付けられた。
-
- SMAD2/3
- 分泌因子の刺激を細胞内に伝えるシグナル伝達因子の一つ。SMADは、BMPやアクチビンなどTGF-βスーパーファミリーに属する分泌因子が結合する受容体タンパク質の下流で働く因子であり、このうちSMAD2/3はアクチビンやTGF-βで活性化される。
-
- MERVLのレポーター遺伝子
- MERVLは、哺乳類進化の過程で感染したレトロウイルスに由来するゲノム中の配列の一つで、2細胞期のマウス胚で発現する。MERVL遺伝子を蛍光タンパク質遺伝子との融合させることで、細胞の全能性を蛍光でモニターするレポーター遺伝子として利用できる。
-
- Prdm14
- 初期の資源生殖細胞で発現する遺伝子。Prdm14遺伝子を欠損したマウスは、雄、雌ともに生殖細胞が全く作られなくなる。
-
- shRNA法
- 任意の遺伝子の機能を阻害する実験手法。配列特異的にRNAが分解されるRNA干渉という現象を利用したもの。shRNAは切断されて短い二本鎖RNAとなり、標的遺伝子の発現を長期的に抑制する。
-
- YAP
- 転写因子と結合して遺伝子発現を制御する転写共役因子の一つ。YAPは核内で機能するが、リン酸化されると核外に移行する。
-
- 脱落膜
- 胚盤胞が着床すると子宮内膜が肥大・増殖し、その一部は母体側の胎盤を形成する。出産後に子宮から剥がれ落ちるため、脱落膜の名が付けられた。
-
- 胚様体(EB)
- ES細胞やiPS細胞を浮遊培養して得られる、球状の細胞塊。3つの胚葉(外胚葉、中胚葉、内胚葉)から分化したさまざまな細胞を含む。EBはembryoid bodyの略。

図1 エピブラスト幹細胞(mEpiSC)から誘導された胚盤胞様の構造(iBLC)
エピブラスト幹細胞に薬剤を添加し誘導を開始すると、5.5日目にiBLCの前駆体となる細胞塊(iBLC-PC)が浮遊し始める。これを単離して、iBLCに成長させた。
左)エピブラスト幹細胞から分化した胚盤胞様の立体構造。その外形から品質を判断し、黄色矢印で示すものを以降の実験に選択し、青矢印は除外した。スケールバーは200マイクロメートル(μm、1μmは100万分の1メートル)。
右)iBLC-PCからiBLCへの経過観察。球状の構造が、外側を包む細胞層と内側の細胞塊に分化していく様子が分かる。スケールバーは100μm。
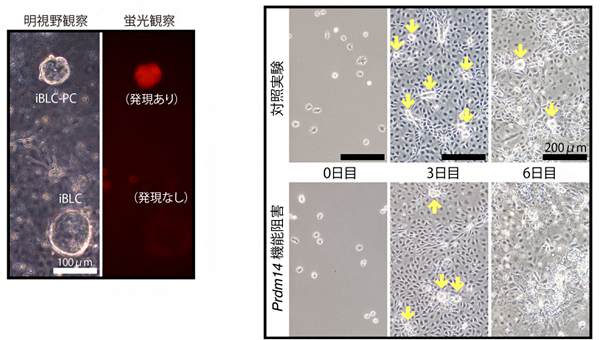
図2 iBLCの形成に関わる遺伝子発現
左) iBLCとその前駆体(iBLC-PC)を明視野と蛍光像で観察した。マウス2細胞期の全能性を示すMERVLレポーター遺伝子の発現(赤)は、iBLC-PCのみで見られた。スケールバーは100μm。
右) Prdm14遺伝子の機能阻害実験。下段の誘導開始0日のmEpiSCや3日目の細胞は。上段の対照と違いが見られないが、6日目ではiBLC-PC(黄色矢印)の形成が抑制された。スケールバーは200μm。
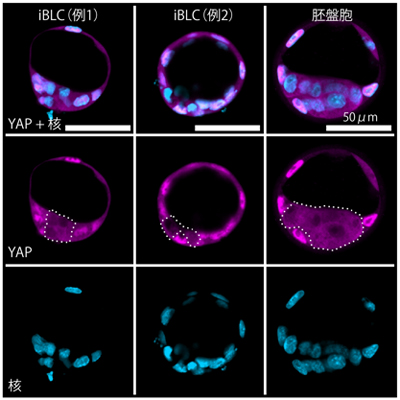
図3 iBLCでの転写因子YAPの細胞内局在
iBLCと胚盤胞(BC)において、転写因子YAPの細胞内局在を蛍光観察した。核を青色、YAPタンパク質をマゼンタで示す。スケールバーは50μm。
右)胚盤胞では、YAPタンパク質は栄養外胚葉で強い核局在を示し、内部細胞塊では細胞質に移行した。
左、中央)iBLCでも同様に、YAPタンパク質は外側の細胞層で強い核局在を示し、内側の細胞では細胞質に移行していた。点線はYAPタンパク質が核外移行している領域を示す。
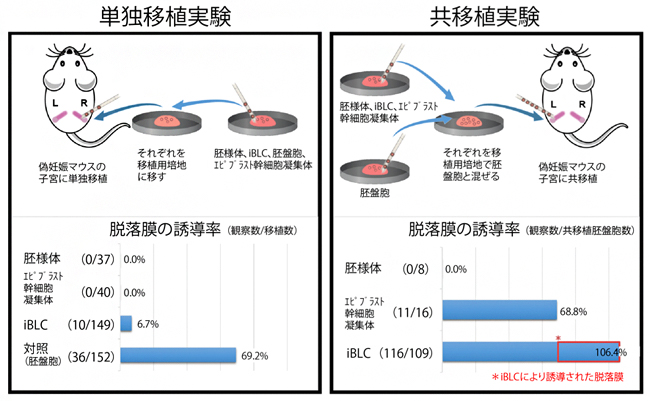
図4 iBLCは着床する能力を持つ
iBLCおよび、対照実験として胚様体、エピブラスト幹細胞の凝集体、胚盤胞を偽妊娠マウスの子宮に移植した。
左)それぞれを単独で移植した場合。胚様体とエピブラスト幹細胞による脱落膜の形成例は皆無だったが、胚盤胞の69.2%に対しiBLCは6.7%の頻度で脱落膜の誘導が観察された。
右)着床率を向上させる効果のある胚盤胞との共移植実験。この実験では、共移植された胚盤胞からも脱落膜が誘導される。エピブラスト幹細胞と胚盤胞の共移植は、胚盤胞単独の場合(69.2%)に比べて成功頻度はほぼ変わらなかったが(68.8%)、iBLCと胚盤胞の共移植では、胚盤胞単独の場合と比べて大幅な上昇がみられた(106.4%)。