RET融合遺伝子上に生じるアロステリック効果を持つ二次変異
2018-02-14 国立がん研究センター,京都大学,東京大学,理化学研究所,日本医療研究開発機構
本研究成果のポイント
- 薬剤結合部位と離れた位置に生じた遺伝子変異が薬剤への耐性獲得の原因となる。
- 薬剤耐性は、遺伝子変異を引き金とするアロステリック(タンパク質構造を協調的に変化させる)効果によって引き起こされ、酵素活性の上昇と薬剤結合の低下をもたらす。
- アロステリック効果は、スーパーコンピュータ「京」等を用いた分子動力学シミュレーションで推定できる。
- 本研究の手法は、がんゲノムに見られる意義不明変異の解明に役立つ可能性がある。
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区、略称:国がん)の研究所(所長: 間野博行)ゲノム生物学研究分野、中奥敬史研究員、河野隆志分野長、東病院(院長:大津 敦)呼吸器内科、後藤功一科長らは、国立大学法人京都大学、国立大学法人東京大学、国立研究開発法人理化学研究所、英国クリック研究所と共同で、分子標的治療薬・バンデタニブによって治療されたRET融合遺伝子陽性の肺がん患者さんのがん試料の機能ゲノム解析を行い、新しい薬剤耐性メカニズムを発見しました。本研究結果は米国学術雑誌Nature Communicationsに2月12日付けで発表されました。
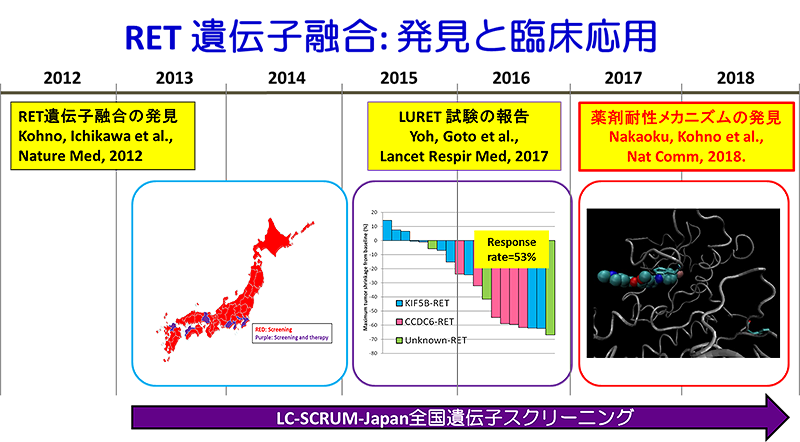
RET遺伝子融合は、2012年国立がん研究センター河野隆志分野長らにより新しい肺がん治療標的分子として発見され(注1)、全国遺伝子診断ネットワーク「LC-SCRUM-Japan」(注2)に基づいて同定された陽性例を対象とした医師主導治験(LURET試験)により、分子標的治療薬・バンデタニブの治療効果が報告されています(注3)。
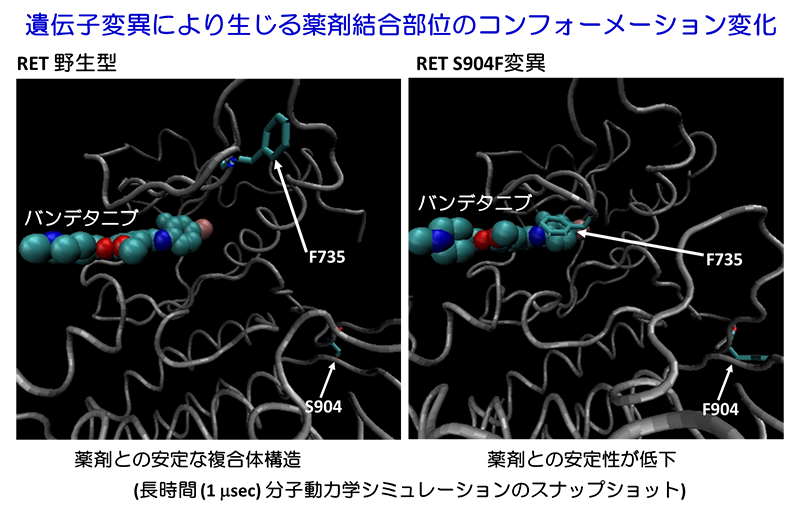
今回の研究では、バンデタニブが奏効し、後に耐性化したRET遺伝子融合陽性の肺がんのRET遺伝子上に生じた二次変異について、X線構造解析、スーパーコンピュータ「京」等を用いた分子動力学シミュレーション(注4)などを組み合わせた機能ゲノム解析を行うことで、これまでとは異なる新しい薬剤耐性機構を発見しました。
研究概要
日本におけるがん死因の第1位は肺がんです。現在、日本で年間に約11万人が肺がんを発症し、約7万人が肺がんで死亡しています。肺がんの約85%を占める非小細胞肺がんにおいては、約2/3の患者さんが手術不能の進行がんとして発見され、遺伝子異常にもとづく分子標的治療が有力な治療手段の一つとなっています。しかしながら、がん細胞が獲得する分子標的治療薬への耐性の獲得が、治療効果の大きな障壁となります。
薬剤耐性は、EGFR遺伝子変異肺がんにおける二次変異(T790M変異)など、薬剤や酵素の基質であるアデノシン3リン酸の結合部位に生じる変異が主な原因として知られています。今回の研究では、バンデタニブ治療に耐性となる前と後の患者さんの肺がんのゲノムDNAについて、次世代シークエンサーを用いた遺伝子パネル検査(NCCオンコパネル検査:注5)を行うことで、RET融合タンパク質の薬剤の結合部位から離れた位置に存在する活性化ループ上に耐性化をもたらす二次変異を発見しました。
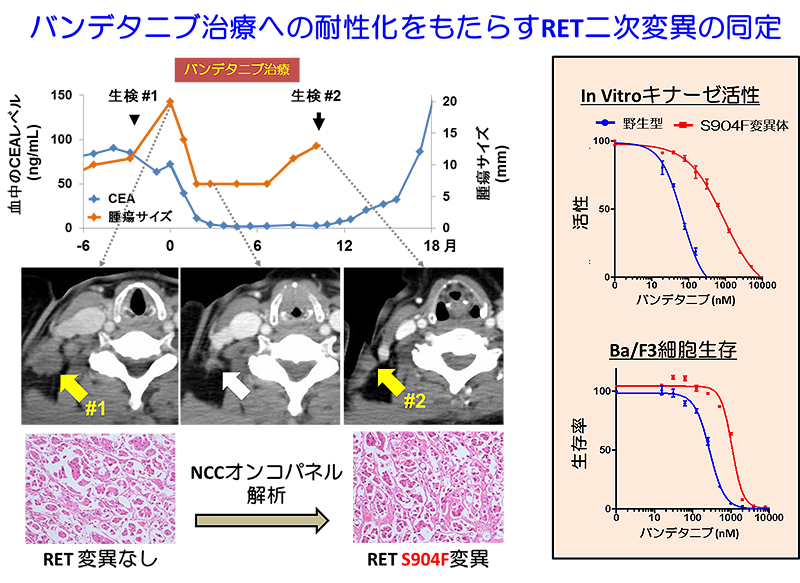
X線構造解析、スーパーコンピュータ「京」等を用いた分子動力学シミュレーションなど、複合的な解析を行ったところ、この変異は、遠隔的にRETタンパク質の薬剤や基質であるアデノシン3リン酸の結合部位となる領域の3次元構造を変化させる効果を持つことが示されました。このアロステリック効果により、変異タンパク質では、酵素活性の上昇と薬剤結合の低下が生じ、薬剤に耐性となると考えられます。
今後の展望
今回の発見により、薬剤の結合部位から離れた位置に存在するアロステリック効果を持つ遺伝子変異が、分子標的薬剤に対する耐性の原因となることが明らかになりました。
がんのゲノム医療やゲノム研究が進むにつれて、がん細胞のゲノムには、多くの遺伝子変異が生じていることが明らかになっています。しかしながら、それらの多くは、がん化や治療に関する意義がわからないVUS(variants of unknown significance: 意義不明変異)です。今回の研究に用いた手法は、これら意義不明変異を解明し、治療の方針決定の手助けになると期待されます。
共同研究者
本研究は、以下の施設を含む、多くの研究グループによる取り組みの成果です。
また、LC-SCRUM-Japanの遺伝子スクリーニングやバイオバンク等への試料提供にご協力・ご賛同してくださった患者・家族の皆様へも深く御礼を申し上げます。引き続き、生体試料を用いた研究に対するご理解とご支援をお願いいたします。
- 国立がん研究センター
研究所 中奥敬史研究員、河野隆志分野長など
東病院 後藤功一科長、仁保誠治医長など
先端医療開発センター 土原一哉分野長など - 京都大学大学院医学研究科および理化学研究所生命システム研究センター
奥野恭史教授、荒木望嗣准教授 - 東京大学大学院工学系研究科・医科学研究所
津本浩平教授、長門石曉特任准教授 - 英国クリック研究所
Neil McDonald教授など - LC-SCRUM-Japan
- 日本医療研究開発機構
発表論文
雑誌名
Nature Communications, 2018, on line publication.
タイトル
A secondary RET mutation in the activation loop conferring resistance to vandetanib
著者
Takashi Nakaoku, Takashi Kohno*, Mitsugu Araki, Seiji Niho, Rakhee Chauhan, Phillip P. Knowles, Katsuya Tsuchihara, Shingo Matsumoto, Yoko Shimada, Sachiyo Mimaki, Genichiro Ishii, Hitoshi Ichikawa, Satoru Nagatoishi, Kouhei Tsumoto, Yasushi Okuno, Kiyotaka Yoh, Neil Q. McDonald, Koichi Goto.(*責任著者)
DOI
10.1038/s41467-018-02994-7
URL
https://www.nature.com/articles/s41467-018-02994-7
参考論文
論文1
KIF5B-RET fusions in lung adenocarcinoma.
Kohno T*, Ichikawa H, Totoki Y, Yasuda K, Hiramoto M, Nammo T, Sakamoto H, Tsuta K, Furuta K, Shimada Y, Iwakawa R, Ogiwara H, Oike T, Enari M, Schetter AJ, Okayama H, Haugen A, Skaug V, Chiku S, Yamanaka I, Arai Y, Watanabe S, Sekine I, Ogawa S, Harris CC, Tsuda H, Yoshida T, Yokota J, Shibata T. (*責任著者)
Nat Med. 2012 Feb 12;18(3):375-7. doi: 10.1038/nm.2644.
論文2
Vandetanib in patients with previously treated RET-rearranged advanced non-small-cell lung cancer (LURET): an open-label, multicentre phase 2 trial.
Yoh K, Seto T, Satouchi M, Nishio M, Yamamoto N, Murakami H, Nogami N, Matsumoto S, Kohno T, Tsuta K, Tsuchihara K, Ishii G, Nomura S, Sato A, Ohtsu A, Ohe Y, Goto K*.(*責任著者)
Lancet Respir Med. 2017 Jan;5(1):42-50. doi: 10.1016/S2213-2600(16)30322-8.
用語解説
注1 RET融合遺伝子
RET融合遺伝子は、2012年3月に日米韓の3ヵ国から同時期に報告された遺伝子異常で、うち1編は国立がん研究センター研究所ゲノム生物学研究分野の河野隆志分野長のグループによるものです。当センターでは、RET融合遺伝子の発見から1年未満という短期間でRET肺がんに対するバンデタニブの臨床試験を開始しました。(論文1)
注2 LC-SCRUM-Japan
2013年に開始した肺がんの遺伝子スクリーニングネットワーク。2015年に消化器がんの遺伝子スクリーニングネットワーク「GI-SCREEN」と統合し、SCRUM-Japanとなりました。遺伝子異常の大規模なスクリーニングにより、希少頻度の遺伝子異常をもつがん患者さんを発見し、遺伝子解析の結果に基づいた有効な治療薬を患者さんへ届けること、複数の遺伝子異常が同時に検出できるマルチ診断薬を臨床応用することを目指しています。
注3 LURET試験
RET融合陽性肺がんの患者さんを対象としたRET阻害薬・バンデタニブの医師主導治験です。遺伝子スクリーニングネットワーク「LC-SCRUM-Japan」において、2013年2月~2015年3月に1,536名の進行非小細胞肺がん患者さんに対して遺伝子検査を行い、34名のRET融合陽性肺がんを特定しました。このうち参加規準を満たした19名の患者さんが治験へ登録され、分子標的治療薬・バンデタニブの投与を受けました。バンデタニブの治療を受けたRET肺がんの患者さんの約半数に、がんの明らかな縮小が認められ、バンデタニブの治療効果が証明されました。(論文2)
注4 分子動力学シミュレーション
分子標的治療薬は、病気の原因となるタンパク質に結合して、そのタンパク質の機能を抑えることで薬効を発揮します。タンパク質や分子標的治療薬剤となる化合物は、それぞれ水中で柔軟に運動する中で、両者の間の絶妙な相互作用のバランスによって結合の仕方や強さが決まります。分子動力学シミュレーションは、対象分子の動的振る舞いを原子レベルで予測する手法です。スーパーコンピュータ「京」などを使用して、タンパク質変異体に結合した薬剤の動きを精密にシミュレーションすることによって、変異によるタンパク質の活性や薬剤の効き方を高精度に推定することができます。
注5 次世代シークエンサーを用いた遺伝子パネル検査
NCCオンコパネル検査と呼ばれる次世代シークエンサーを用いて、がん細胞における114個の遺伝子の変異を調べる遺伝子検査が国立がん研究センターで開発されています。
今回の研究では、薬剤耐性の診断に、この検査が有用であることが示されました。
報道関係からのお問い合わせ先
国立研究開発法人国立がん研究センター
研究所ゲノム生物学研究分野 分野長 河野隆志
企画戦略局 広報企画室
国立大学法人 京都大学
広報課国際広報室
国立大学法人 東京大学
工学部・大学院工学系研究科 広報室
国立研究開発法人 理化学研究所
広報室 報道担当