タンパク質の動きを制御する新たな薬づくりへ
2019-10-04 国立大学法人東京大学大学院薬学系研究科,次世代天然物化学技術研究組合,国立研究開発法人日本医療研究開発機構
病原細菌の多剤耐性は、発展途上国だけでなく、先進国においても医療における大きな問題です。多剤耐性機構においては、多様な構造および広い範囲の分子量を持つ薬剤に高親和性で結合する多剤結合転写因子(注1)が、薬剤を細胞の外に排出する多剤耐性トランスポーター(注2)の発現を制御します。黄色ブドウ球菌においては、多剤結合転写因子QacRがその役割を果たしますが、QacRが薬剤によって異なるレベルで多剤耐性トランスポーターの発現を制御する仕組みは明らかではありませんでした。
東京大学大学院・薬学系研究科および次世代天然物化学技術研究組合の嶋田一夫 教授と産業技術総合研究所・創薬分子プロファイリング研究センターの竹内恒 研究チーム長のグループは、核磁気共鳴法(NMR法、注3)を用いて、QacRが溶液中で多剤耐性トランスポーターqacA遺伝子の転写・発現を亢進する活性構造と抑制する不活性構造との間をミリ秒で行き来する構造平衡下にあること、また、QacRが薬剤結合時に活性構造を取る割合により、転写活性が決定することを明らかにしました。薬剤がQacRの構造平衡を制御する際には、薬剤の分子の大きさ(分子量)が大きいほど、構造平衡を大きく傾け、活性構造の割合が増えていました。本研究は、多剤耐性機構を不活性化する薬剤の設計について合理的な指針を与えると同時に、タンパク質の持つ運動性を積極的に制御し活用する際には、中分子を始めとするより大きな分子を設計するのが適切であるとの示唆を与えるもので、新たな薬づくりへの応用が期待されます。
研究開発のポイント
- 黄色ブドウ球菌の多剤耐性機構の“要”である多剤結合転写因子QacRが、多様な構造および広い範囲の分子量を持つ薬剤を認識し、多剤耐性トランスポーターの発現を制御する仕組みを解明した。
- 溶液中でQacRは活性・不活性構造を行き来する構造平衡下にあり、薬剤が結合した際に活性構造を取る割合に応じて、様々なレベルで転写活性が増強することを明らかにした。
- 多剤耐性機構を不活化する薬剤設計の指針を与えるとともに、タンパク質の構造平衡を介して活性を制御する際に、化合物の分子の大きさが重要であることが示唆された。
研究概要
多剤結合転写因子は、多様な構造および広い範囲の分子量を持つ薬剤に高親和性で結合し、薬剤を細菌の外に排出する多剤耐性トランスポーターの発現量を増大させて薬の効きを悪くします。このように多剤結合転写因子と多剤耐性トランスポーターから構成される多剤耐性機構は、病原細菌などでその存在が良く知られているとともに、ヒトのがん細胞においても見られ、抗がん剤を効きにくくするなど医療上の問題が生じています。
多剤耐性機構を不活性化する薬剤を合理的に設計するためには、その制御の要である多剤結合転写因子が多様な化合物に結合して、多剤耐性トランスポーターの発現量を増大させる分子機構を調べることが必要です。病原細菌の一種である黄色ブドウ球菌においては、多剤結合転写因子QacRが多剤耐性トランスポーターQacAの発現を制御することで、多剤耐性機構をコントロールしていますが、QacRが化合物によって異なるレベルでQacAの発現を制御する仕組みは明らかではありませんでした(図1)。
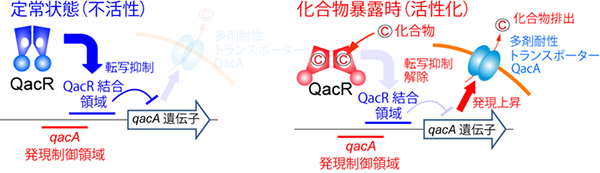
図1 黄色ブドウ球菌の多剤耐性制御の模式図
(左)化合物のない定常状態では、多剤結合転写因子QacRが多剤耐性トランスポーターQacAの転写制御領域付近に結合し、その発現を抑制している。
(右)化合物暴露時には、QacRが化合物と結合することで構造変化し、転写抑制が解除される結果、QacAの発現が増大し、化合物の排出が促進される。
東京大学大学院・薬学系研究科および次世代天然物化学技術研究組合の嶋田一夫 教授と産業技術総合研究所・創薬分子プロファイリング研究センターの竹内恒 研究チーム長のグループは、異なるレベルで活性化を引き起こす6種の化合物と結合した状態のQacRおよび化合物に結合していない状態のQacRについて、溶液中での構造を核磁気共鳴(NMR)法により解析しました。その結果、QacRがすべての状態で、活性・不活性構造をミリ秒で行き来する構造平衡にあること、転写活性は化合物に結合した際にQacRが活性構造を取る割合により決まることを明らかにしました(図2のA、B)。その際、結合する化合物分子の大きさ(分子量)が大きいほどQacRの構造平衡が大きく傾き、活性構造の割合が増えていました(図2のC)。
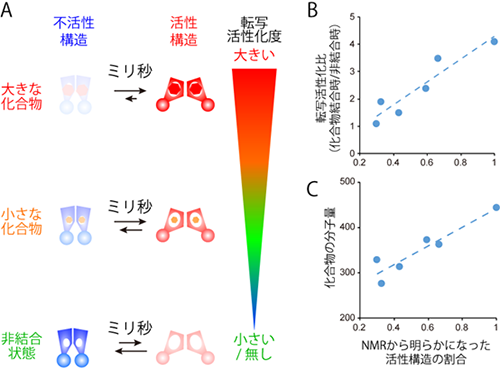
図2 本研究で明らかとなったQacRの多剤耐性制御機構
(A) 化合物の大きさに応じたQacRの転写制御の模式図
(B, C)NMRで明らかとなった化合物結合時の活性構造の割合に対して (B)転写活性比および(C)化合物の分子量が相関する。この結果は、大きな化合物に結合するほど、QacRが構造平衡において活性構造をとる割合が大きくなり、転写活性化比も大きくなることを示している。
以上の結果は、結合の強い小さな化合物を設計することで、黄色ブドウ球菌の多剤耐性機構を不活化できることを示しています。一方で、タンパク質の構造平衡を積極的に利用して薬効を発揮させるためには、構造変化を起こした状態を永く保てるだけの分子量が必要であることを示唆しており、そのような新たな薬づくりを行っていくにあたって、中分子など比較的大きな化合物分子を合理的に設計する技術の重要性を示すものとしても注目されます。
なお、本研究の詳細は、2019年9月17日(米国時間9月16日)に米国の科学誌Proceedings of the National Academy of Sciences of the United States of America誌に掲載されました。
注釈
- (注1)多剤結合転写因子
- 多剤耐性機構の制御において中心的な役割を果たす転写因子であり、様々な薬剤に結合することで、その下流にある多剤耐性トランスポーターの発現をコントロールする。同様の活性を持つ転写因子は原核生物からヒトを始めとする高等動物まで広く存在が知られている。
- (注2)多剤耐性トランスポーター
- 多剤耐性機構において実際に薬剤を排出する機能を担うタンパク質であり、ABCトランスポーター型、プロトン対抗輸送型、ナトリウム対抗輸送型などいくつかの種類が知られている。
- (注3)核磁気共鳴(NMR)法
- 水溶液に溶けたタンパク質などを、強力な磁場の中におくことで生じる「原子の共鳴現象」を観測することで、溶液中のタンパク質などの分子の構造や運動性の性質を原子レベルで調べることができる分光法。タンパク質試料を水溶液のままで解析できるため、製薬だけでなく、食品、材料、化学などさまざまな分野で活用されている。
特記事項
※この研究は、日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業」(革新的中分子創薬技術の開発)の支援によって行われました。
論文情報
- 雑誌名:
- Proceedings of the National Academy of Sciences of the United States of America
(2019年9月16日オンライン版) - 論文タイトル:
- Conformational equilibrium defines the variable induction of the multidrug-binding transcriptional repressor QacR
- 著者:
- Koh Takeuchi*, Misaki Imai, and Ichio Shimada*
- DOI番号:
- 10.1073/pnas.1906129116
お問い合わせ先
内容に関するお問い合わせ
国立大学法人東京大学大学院薬学系研究科 薬科学専攻
教授 嶋田 一夫(しまだ いちお)
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
戦略推進部 医薬品研究課
次世代治療・診断実現のための創薬基盤技術開発事業担当