2020-02-05 東京大学
1. 発表者:
畑 昌宏(東京大学大学院医学系研究科消化器内科学 医学博士課程 4 年生/医師)
木下 裕人(研究当時:東京大学大学院医学系研究科・医学部附属病院消化器内科 助教)
早河 翼(東京大学大学院医学系研究科・医学部附属病院消化器内科 助教)
小池 和彦(東京大学大学院医学系研究科・医学部附属病院消化器内科教授)
2. 発表のポイント:
◆独自のマウスモデルを開発し、胃の前がん病変である化生性変化の発生メカニズムとその起源細胞を明らかにしました。
◆これまで胃の化生性変化は分化細胞の一つである主細胞が脱分化して生じると考えられていましたが、実際には元々存在する幹細胞や前駆細胞が化生性細胞の起源であることが分かりました。これまでの仮説を大幅に覆す結果であり、更にその分子学的機序まで解明しました。
◆これまでの定説を覆したことで、当該研究領域に極めて大きな影響を与えることになり、過去の多くの研究の解釈に見直しが必要になると考えられます。一方で、胃がん発生機序についてより正確な情報が得られたことで、今後の胃がん研究のターニングポイントとなると考えられます。
3.発表概要:
ヘリコバクター・ピロリ菌の感染などによる慢性胃炎は、正常の胃粘膜を障害し腸上皮化生(注1)と呼ばれる前がん病変を胃内に生み出し、終的に胃がんを引き起こすものと考えられています。これまでの報告では、前がん病変である化生性細胞は、正常の胃粘膜に存在し消化酵素などを分泌する主細胞(注2)と呼ばれる特定の細胞群が、ピロリ菌などの炎症刺激によって脱分化(注3)することで生じるものと考えられてきました。しかし、主細胞が化生性細胞やがんに変化していく詳細な時間経過やメカニズムについては分かっていませんでした。今回東京大学消化器内科の畑昌宏医師、木下裕人助教(研究当時)、早河翼助教、小池和彦教授らのグループは、独自に作成した新規のマウスモデルを用い、主細胞は胃粘膜障害の過程で脱分化せずに消失し、実際には化生性細胞の起源とはなりえないことを証明しました(図 1)。これまでの報告で用いられていたマウスモデルはいくつかの致命的な欠点がありましたが、早河翼助教らの新しいマウスモデルはこうした欠点を補完し、化生性細胞の発生をより精密に再現することを可能にしました。その結果、これまで主細胞が脱分化していたために生じていると思われていた数々の現象が、実は主細胞が死んでいく様を反映していたものに過ぎず、化生性細胞の真の起源は胃に元々存在する幹細胞および前駆細胞だったことが分かりました(図 1)。
これは、これまでの定説を真っ向から覆す驚くべき知見です。さらに、この主細胞の消失が、主細胞に選択的に発現している GPR30 という受容体を介した細胞競合(注4)というメカニズムによって生じることを明らかにしました。今回の新しい発見により、胃の前がん病変の真の起源とその発生メカニズムが明らかになったことから、今後の胃がん研究のさらなる発展と新規胃がん治療の開発に結び付く可能性があります。本研究は科研費若手研究(A)、AMED の革新的先端開発支援事業(PRIME)、次世代がん医療創生研究事業(P-CREATE)などの支援を受け、岐阜大学・東京理科大学・豪州アデレード大学・米国コロンビア大学などの協力の下に行われました。
4.発表内容:
ヘリコバクター・ピロリ菌の感染などによる慢性胃炎は胃がんの高危険因子として知られています。慢性胃炎は正常の胃粘膜を障害し、長い経過の後に腸上皮化生と呼ばれる前がん病変を胃内に生み出し、これが進行すると終的に胃がんが引き起こされるものと考えられています。これまで、腸上皮化生・胃がんの発生メカニズムの研究として、マウスモデルを用いた検討が行われてきました。それによると、ピロリ菌や薬剤性の胃粘膜障害によって生じる前がん病変である化生性細胞は、正常の胃粘膜に存在し消化酵素などを分泌する主細胞と呼ばれる特定の細胞群のマーカーを発現していることから、化生性細胞が主細胞から発生している可能性が提唱されていました。さらに、主細胞をタモキシフェン依存的に標識できるマウスモデルによって行われた系譜追跡実験(注5)により、主細胞が炎症刺激によって脱分化し、新しい幹細胞のような性質を帯びた細胞へと変化して化生性細胞の起源となることを示した報告が相次いだため、主細胞が前がん病変の主たる起源であるという説が定説となっていました。しかしながら、主細胞がなぜ、どのようにして化生性細胞やがんに変化していくかについて、その詳細な時間経過やメカニズムについては不明のままでした。また、過去の系譜追跡実験で用いられたタモキシフェンという薬剤がマウスの胃粘膜に高度の障害を引き起こすことや、主細胞を選択的に標識するとされていたマウスが実際には主細胞以外の幹細胞や前駆細胞も標識していることなどが分かり、これまでのタモキシフェンを用いた実験系が本当に正確な細胞動態を反映しているのかについては疑問の余地がありました。
今回東京大学消化器内科の畑昌宏医師、木下裕人助教(研究当時)、早河翼助教、小池和彦教授らのグループは、過去の実験系の弱点を克服するため、全く新しい独自のマウスモデルを開発しました。まず、主細胞のみに発現し、他の細胞群には発現しない GPR30 という遺伝子を、網羅的遺伝子発現解析によって同定しました。次に、タモキシフェンによる胃粘膜障害というこれまでの実験系の弱点を克服するため、タモキシフェンを用いずに系譜追跡実験が可能なドキシサイクリン依存的マウスモデル(注6)を構築しました。この新しいマウスモデルを用いて化生性細胞を生じさせたところ、これまでの予想に反し、主細胞は胃粘膜障害の過程で脱分化せずに消失し、化生性細胞の起源とはならないことが分かりました。この過程において、消失した主細胞を補充しようという生体反応によって、もともとの幹細胞や前駆細胞が盛んに細胞増殖を行い、結果として化生性細胞へと変化していることが分かりました(図 1)。つまり、これまで主細胞が脱分化していたために生じていると思われていた数々の現象が、実は主細胞が死んでいく様を反映していたものに過ぎず、化生性細胞の真の起源は胃に元々存在する幹細胞および前駆細胞だったことが分かりました。これはこれまでの定説を真っ向から覆す驚くべき知見です。
興味深いことに、グループが同定した主細胞マーカーの GPR30 は、タモキシフェンの受容体でもあるのです。この GPR30 遺伝子をノックアウトしたマウスでは、タモキシフェンによる胃粘膜障害や化生性変化が抑制されたことから、GPR30 受容体が主細胞の消失を制御していることが分かりました。具体的には、まずタモキシフェンをはじめとする化生変化惹起刺激が GPR30 受容体を介し、GPR30 陽性主細胞内のピルビン酸脱水素酵素を活性化します。これにより生じた上皮細胞間の代謝状態の不均衡が、周囲の正常細胞からの細胞競合を惹起し、結果として主細胞が選択的に排出・除去されるというメカニズムが存在することがわかりました。
これまでのタモキシフェンを用いた系譜追跡実験では、タモキシフェン投与自体が GPR30 受容体を介した細胞競合と主細胞の消失を引き起こしていたため、正確な検討ができていなかったのです。今回の新しい実験モデルと多くの新しい知見により、これまでの定説をほぼ完全に覆しました。本研究成果は当該研究領域に極めて大きな影響を与え、過去の多くの研究の解釈に見直しが必要になると考えられます。しかしながら、胃の前がん病変の真の起源とその発生メカニズムが明らかになったことから、今後の胃がん研究のさらなる発展と新規胃がん治療の開発に結び付くことが期待されます。本研究は科研費若手研究(A)、AMED の革新的先端開発支援事業(PRIME)、次世代がん医療創生研究事業(P-CREATE)などの支援を受け、岐阜大学・東京理科大学・豪州アデレード大学・米国コロンビア大学などの協力の下に行われました。
5.発表雑誌:
雑誌名:「Gastroenterology」(オンライン:2 月 4 日)
論文タイトル:GPR30-expressing gastric chief cells do not dedifferentiate but are eliminated via PDK-dependent cell competition during metaplasia development
著者:Masahiro Hata, Hiroto Kinoshita, Yoku Hayakawa*, Mitsuru Konishi, Mayo Tsuboi,
Yukiko Oya, Ken Kurokawa, Yuki Hayata, Hayato Nakagawa, Keisuke Tateishi,
Hiroaki Fujiwara, Yoshihiro Hirata, Daniel L. Worthley, Yuki Muranishi, Takahisa
Furukawa, Shunsuke Kon, Hiroyuki Tomita, Timothy C. Wang, and Kazuhiko Koike DOI 番号:10.1053/j.gastro.2020.01.046
アブストラクト URL:
6.問い合わせ先:
【研究に関するお問合せ先】
東京大学医学部附属病院 消化器内科助教 早河 翼(はやかわよく)
【広報担当者連絡先】
東京大学医学部附属病院 パブリック・リレーションセンター (担当:渡部・小岩井)
7.用語解説:
(注1)腸上皮化生
正常の胃粘膜には存在しない、小腸や大腸の粘膜を模倣する細胞群が胃の中に存在するようになる状態。ピロリ菌の感染などによる慢性胃炎によって生じ、胃がんの前がん病変の一つとして考えられている。
(注2)主細胞
ペプシノーゲンなどを分泌する、胃内の成熟分化細胞の一つ。胃の腺管のも基部に存在し、特定の状況下で幹細胞化する可能性があると提唱されてきた。
(注3)脱分化
通常、分化した成熟細胞は、細胞増殖や分裂を行わず、比較的短期間に細胞死を起こして新しい細胞に入れ替わる。しかしながら、炎症の存在下など特定の環境では、成熟細胞が脱分化して幹細胞機能を持ち、細胞増殖や子孫細胞の供給などを行うことがあるとされる。
(注4)細胞競合
上皮細胞間の相互作用の一つで、特定の遺伝子変異や代謝状態の変化が生じた細胞が、周囲の正常細胞によって除去される機構のこと。免疫によらない生体防御反応とも称される。
(注5)系譜追跡実験
特定の細胞を蛍光タンパクなどで標識し、その後の細胞動態を追跡するマウスモデル実験のこと。タモキシフェン依存的 Cre 組み換え酵素を用いたマウスモデルが汎用されている。
(注 6)ドキシサイクリン依存的マウスモデル
ドキシサイクリンの投与によって遺伝子発現を制御可能な Tet-ON システムを利用したマウスモデルのこと。本研究では GPR30 陽性主細胞を選択的に標識できる GPR30-rtTA マウスと、ドキシサイクリン依存的に Kras 遺伝子を発現する tetO-Kras マウスなどを組み合わせて新規実験系を構築した。
8.添付資料:
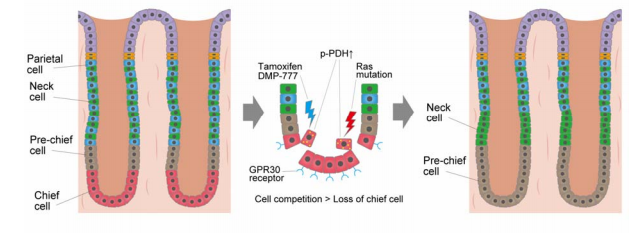
図1:前がん病変形成時に主細胞が細胞競合により胃上皮から排出される模式図胃の腺管の底部に存在する主細胞(Chief cell)は、GPR30 受容体を発現している。タモキシフェンや DMP-777 などを用いた薬剤性胃粘膜障害時や、Ras 遺伝子の変異(Ras mutation)を発生させる化生誘導モデルにおいては、GPR30 受容体を介して主細胞内のピルビン酸脱水素酵素(p-PDH)がリン酸化し、その結果細胞競合(Cell competition)メカニズムにより、主細胞は腺管から排除される。結果として、消失した主細胞を補うため上方に位置するもともとの幹細胞や頸部粘液産生細胞(Neck cell)が下部へ進展し、化生性細胞(Pre-chief cell)の起源となる。