2020-04-20 東京大学,日本医療研究開発機構
発表者
富田 泰輔(東京大学大学院薬学系研究科 機能病態学教室 教授)
堀 由起子(東京大学大学院薬学系研究科 機能病態学教室 講師)
邱 詠玟(東京大学大学院薬学系研究科 機能病態学教室 博士課程3年生)
発表のポイント
- アルツハイマー病の発症機構において、最初期病態として蓄積するアミロイドβペプチド(Aβ)の産生に関わる新規分子calcium and integrin-binding protein 1(CIB1)を同定し、その産生制御メカニズムを明らかにしました。
- ゲノム編集技術CRISPR/Cas9システムを用いて新規Aβ産生制御分子CIB1の同定に成功し、そのメカニズムを解明しました。また、CIB1の発現変動がアルツハイマー病発症に関与する可能性を明らかにしました。
- アルツハイマー病発症の最初期過程に関わる新規分子CIB1の同定に成功し、その病的分子機構の一端を明らかにした点で意義のある成果です。また、γセクレターゼの局在制御がアルツハイマー病発症に寄与することを示唆しており、新たなアルツハイマー病治療戦略の提示に繋がることが期待されます。
発表概要
高齢化社会といわれる現在、高齢者認知症の多くを占めるアルツハイマー病(AD)は大きな社会問題となっていますが、未だその発症メカニズムの全容解明には至っておらず、根本治療法も確立されていません。ADに特徴的で最初期に見られる病理学的所見として、アミロイドβペプチド(Aβ)の脳内での凝集・蓄積があげられます。これまでの多くの遺伝学的研究から、このAβの凝集・蓄積が神経細胞内にタウ(注1)の凝集・蓄積を引き起こし、神経変性に至ることが示唆されています。そのため、Aβ産生機構の詳細な理解は、AD発症の最初期過程の解明に繋がると考えられています。
そこで、東京大学大学院薬学系研究科の富田泰輔教授、堀由起子講師、邱詠玟大学院生らと、新潟大学脳研究所の池内健教授らのグループでは、革新的技術による脳機能ネットワークの全容解明プロジェクトの「アルツハイマー病におけるAβ誘導性タウ凝集病態伝播・神経回路変容機構の解明」(JP20dm0207073)の支援の基に、Aβ産生に関わる新規分子をCRISPR/Cas9システム(注2)を用いたゲノムワイドスクリーニング(注3)によって探索しました。Aβ産生を負に制御する新規分子としてcalcium and integrin-binding protein 1(CIB1)を同定し、そのAβ産生制御メカニズムを明らかにしました(図1)。また初期AD患者の死後脳において、CIB1発現量が低下していることを見出しました。
本研究成果は、新規Aβ産生制御メカニズムを明らかにした点で意義のある成果です。また新たなAD治療戦略の提示に繋がることが期待されます。
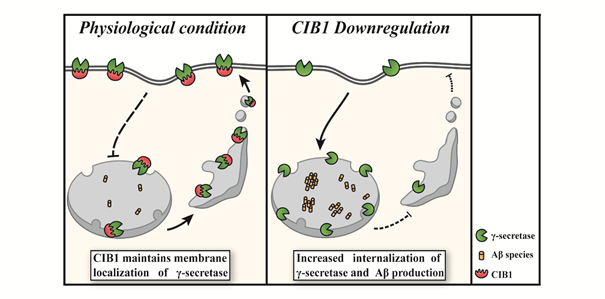
図1:想定されるCIB1によるAβ産生制御メカニズム本研究から、CIB1がγセクレターゼを細胞表面膜に留めていることがわかりました(左図)。これまでの研究から、γセクレターゼの細胞内局在がその切断活性に影響を与えることがわかっています。すなわちCIB1の発現量減少下では、細胞表面上のγセクレターゼ発現量が低下し、Aβ産生が増加します(右図)。
発表内容
高齢化社会といわれる現在、高齢者認知症の多くを占めるアルツハイマー病(AD)は大きな社会問題となっていますが、未だその発症メカニズムの全容解明には至っておらず、根本治療法も確立されていません。ADに特徴的で最初期に見られる病理学的所見として、アミロイドβペプチド(Aβ)の脳内での凝集・蓄積があげられます。これまでの多くの遺伝学的研究から、このAβの凝集・蓄積が神経細胞内にタウ(注1)の凝集・蓄積を引き起こし、神経変性に至ることが示唆されています。そのため、Aβ産生機構の詳細な理解は、AD発症の最初期過程の解明に繋がると考えられています。
Aβは、アミロイド前駆体タンパク質(APP)がβセクレターゼとγセクレターゼ(注4)によって二段階の切断を受けることで産生されます。このうちγセクレターゼによる切断は、その切断部位によってAβのC末端に多様性をもたらし、ADの発症に関わる凝集性の高いAβ分子種の産生に関与することから、γセクレターゼの活性制御はADの治療標的として重要と考えられています。しかしながら、その切断制御機構には未だ不明な点が多くありました。そこで、東京大学大学院薬学系研究科の富田泰輔教授、堀由起子講師、邱詠玟大学院生らと、新潟大学脳研究所の池内健教授らのグループでは、Aβ産生に関わる新規分子をゲノムワイドスクリーニングによって探索することで、新たなAβ産生制御分子メカニズムを同定することを目的に研究を行いました。
Aβ産生に関わる新規分子の同定のために、近年開発されたゲノム編集技術であるCRISPR/Cas9システム(注2)を用いて、ゲノムワイドスクリーニング(注3)を行いました。その結果、Aβ産生を負に制御する新規分子として、calcium and integrin-binding protein 1(CIB1)の同定に成功しました。CIB1をノックダウン(注5)やノックアウト(注6)してタンパク質量を減少させることにより、Aβ産生量は上昇しました。
そのメカニズムとして、CIB1がγセクレターゼと相互作用していることを免疫共沈降実験(注7)により明らかにしました。また、CIB1はγセクレターゼの総量には影響を与えない一方で、γセクレターゼの細胞表面膜の存在量に影響することもわかりました。このことからCIB1は、生理的条件下では、γセクレターゼと相互作用し、γセクレターゼを細胞膜に留めていることが示唆されました(図1左)。一方でCIB1発現量減少下においては、この機能が失われ、γセクレターゼの内在化が亢進することが考えられます(図1右)。これまでの研究から、γセクレターゼの細胞内局在がその切断活性に影響を与えることがわかっています。すなわちCIB1がγセクレターゼの細胞内局在を変化させることで、Aβ産生を制御していることが示唆されました。
次にAD発症プロセスにおけるCIB1の役割を検討する目的で、ヒトAD患者の死後脳サンプルにおけるシングルセルRNA-seq法(注8)によるデータを解析しました。その結果、初期ADステージの神経細胞においてCIB1の発現量が減少していることがわかりました。これらの結果は、神経細胞におけるCIB1発現量の減少によりAβ産生量が上昇し、AD発症プロセスを加速する可能性を示唆しています。
本研究成果は、Aβ産生に関わる新規分子の同定に成功し、その産生制御メカニズムの一端を明らかにした点で意義のある成果です。また、AD発症早期ステージにおいては、CIB1の発現変動によりγセクレターゼの細胞内局在が変容し、Aβ産生が上昇することで、AD発症過程を加速することが示唆されました。今後、このCIB1を標的とした新たなAD治療・予防戦略の提示、早期診断法の開発に繋がることが期待されます。
本研究は、日本医療研究開発機構(AEMD)の革新的技術による脳機能ネットワークの全容解明プロジェクトにおける研究開発課題「アルツハイマー病におけるAβ誘導性タウ凝集病態伝播・神経回路変容機構の解明」として、実施いたしました。
発表雑誌
- 雑誌名:
- 「The FASEB Journal」
- 論文タイトル:
- Identification of calcium and integrin-binding protein 1 as a novel regulator of production of Amyloid β peptide using CRISPR/Cas9-based screening system
- 著者:
- Yung Wen Chiu, Yukiko Hori, Ihori Ebinuma, Haruaki Sato, Norikazu Hara, Takeshi Ikeuchi and Taisuke Tomita*(*:Corresponding author)
- DOI番号:
- 10.1096/fj.201902966RR
用語解説
- 注1)タウ
- 微小管結合タンパク質。ADにおいては、本来の機能を失い、細胞内において凝集し蓄積している。その蓄積病理は神経原線維変化として知られている。
- 注2)CRISPR/Cas9システム
- CRISPR/Cas9は、Clustered Regularly Interspaced Short Palindromic Repeats CRISPR-Associated Proteins 9の略。近年開発されたゲノム編集技術で、DNA切断酵素Cas9と、標的配列を規定するguide-RNAによって担われる。guide-RNAによって標的とされた遺伝子配列をCas9が切断することで、その後起こる修復機構を利用して特定の遺伝子の編集を行う。本論文では、特定の分子の発現を抑制する目的で使用した。
- 注3)ゲノムワイドスクリーニング
- 全ゲノムを標的とした網羅的スクリーニングのこと。
- 注4)γセクレターゼ
- APPを段階的に切断することでAβ産生に関わる酵素。一段階目の切断をβセクレターゼが、二段階目の切断をγセクレターゼが担う。βセクレターゼの本体は、BACE1タンパク質である。γセクレターゼは、presenilin、Aph-1、Nicastrin、Pen-2の4つのタンパク質複合体である。
- 注5)ノックダウン
- タンパク質発現量を減少させること。特定のmRNAを分解させることによって、そのタンパク質発現を抑制することができる。
- 注6)ノックアウト
- タンパク質発現量を無くすこと。ゲノム編集によって作成する。
- 注7)免疫共沈降実験
- 目的タンパク質に対する抗体を用いて、そのタンパク質に対して結合しているタンパク質を集める手法。
- 注8)シングルセルRNA-seq法
- 単一細胞ごとに発現しているmRNAを検出し、その配列を同定する手法。発現の程度を比較できる。
お問い合わせ先
東京大学大学院薬学系研究科 機能病態学教室
教授 富田 泰輔(とみた たいすけ)
AMED事業について
日本医療研究開発機構 疾患基礎研究事業部・疾患基礎研究課
革新脳担当