2020-04-28 東京大学
増田 周作(生物科学専攻 博士課程大学院生(研究当時))
吉種 光(生物科学専攻 助教)
深田 吉孝(生物科学専攻 教授)
発表のポイント
- 体内時計の針の進む速さは時計タンパク質PER2のリン酸化スイッチによって決定されていることを示した。
- 体内時計は環境の温度が変化しても針の進む速さが変化しないという温度補償性を示すが、温度補償性が乱れる点変異マウスを逆遺伝学的なストラテジーによって初めて作出した。
- 時差ぼけ等に起因する体内時計の乱れはがんや精神疾患のリスクを増大させるが、PER2のリン酸化スイッチを操作することにより、これらの予防や治療につながると期待される。
発表概要
2017年のノーベル生理学・医学賞はショウジョウバエの時計遺伝子Period (Per) を発見して体内時計の分子メカニズムを明らかにした3人の米国人研究者に授与されました。哺乳類においても三つのPer 遺伝子が存在し、この遺伝子から産生されるPERタンパク質はリン酸化などの翻訳後修飾を受け、その分子機能が制御されますが、その分解の制御についての仕組みは十分に理解されていませんでした。東京大学大学院理学系研究科の増田周作大学院生、吉種光助教、深田吉孝教授らの研究グループは、三つのPERタンパク質のうちPER2タンパク質のリン酸化修飾が体内時計の針の進む速さを調節するスイッチとして機能することを明らかにしました。遺伝子改変マウスを用いてリン酸化スイッチの働きを止めるとPER2タンパク質の量が増えて時計の針が1日に1時間ずつ遅れることがわかりました。さらに、体内時計は環境の温度が変化しても針の進む速さが変化しないという温度補償性を示しますが、このリン酸化スイッチの働きを止めると温度補償性が乱れました。将来、このPER2のリン酸化スイッチを自在に制御できるようになれば、時差ぼけの症状を和らげたり、朝型・夜型を自由に切り替えたりできるようになると期待されます。
発表内容
生物は長い進化の過程で概日時計(注1)を獲得し、睡眠覚醒リズムや代謝リズムを地球の自転による24時間周期の環境変化に最適化してきましたが、時差のある地域への航空機を使った移動やシフトワークのように現代社会に特有の生活リズムの撹乱は概日時計を狂わせ、発がんやうつ病リスクの増加などさまざまな疾病をもたらします。これらの問題の解決のためにも、概日時計がどのような仕組みに基づいて振動しているのかを理解することは重要な課題です。これまでの研究から、概日時計は時計遺伝子と呼ばれる遺伝子群とそれらをもとに合成された時計タンパク質の制御ネットワークを分子基盤とすることが明らかになっています。時計タンパク質の多くはリン酸化修飾によってその機能が制御されるため、このリン酸化を個別に制御することができれば概日時計を自在に調節できると期待されます。
時計タンパク質の一つであるPER2(注2)はマウスの各臓器・細胞において夜中に蓄積し、概日時計による遺伝子の発現をリズミックに抑制する機能を持っています。PER2タンパク質はその分解速度が複数のリン酸化のバランスによって決まっています。これまでの研究から、PER2を安定化するリン酸化部位を含むFASP領域と、不安定化するリン酸化部位であるβ-TrCP領域が特に重要で、そのどちらがリン酸化されるかによってPER2タンパク質の安定化・不安定化のバランスが調節されること(通称リン酸化スイッチ)がわかっていました(図1)。しかし、PER2タンパク質の安定性が概日時計の発振速度に与える影響は十分に検証されていませんでした。
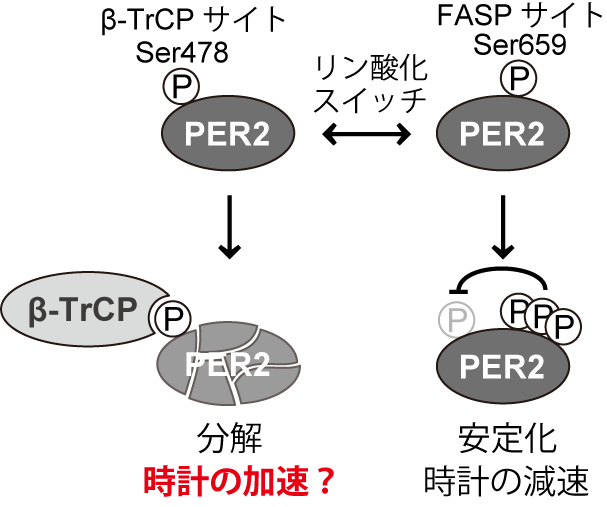
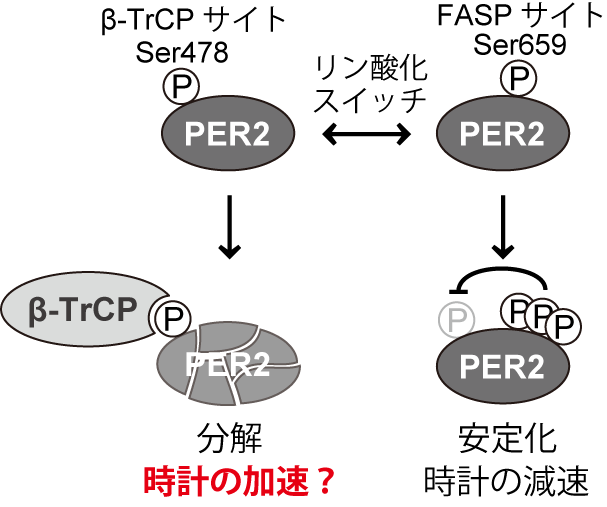
図1:PER2のリン酸化スイッチ
β-TrCP領域(478番目のセリン残基を含む)がリン酸化修飾されるとβ-TrCPタンパク質の作用によってPER2の分解は促進します。一方、FASP領域(659番目のセリン残基を含む)がリン酸化修飾されるとβ-TrCP領域のリン酸化が抑制されるため、PER2は安定化します。FASP領域のリン酸化は時計の針の進む速さを遅くすることはすでに報告されていましたが、β-TrCP領域のリン酸化が時計の針の進む速さに本当に寄与しているか否かは不明でした。
東京大学大学院理学系研究科の増田周作大学院生、吉種光助教、深田吉孝教授らのグループはPER2の不安定化に関与するリン酸化部位であるβ-TrCP領域に変異を導入したマウス(PER2-S478A変異マウス)を作製して解析を行いました。恒暗条件下における輪回し行動の計測によってこの変異マウスの概日時計の周期を調べたところ、野生型マウスに比べて周期が長いことが明らかになりました(図2)。

図2:PER2-S478A変異マウスの輪回し行動リズム
(左)輪回し行動の多さを黒い棒の高さで示しています。48時間分の行動を一日ずつずらして表示するダブルプロットと呼ばれる形式で示しています。背景が明るい部分は光がついている状態で、暗い部分は光がついていない状態を示します。
(右)光があたらない状態での行動リズムの周期を示した棒グラフ。変異マウスは周期が長い(時計の針の進む速さが遅い)ことがわかります。
また、この変異によってPER2は安定化するため、肝臓細胞の核内におけるPER2の発現量は変異マウスにおいて増加しました。興味深いことに、PER2の安定化はPER2と協同的にはたらく時計タンパク質であるCRYの核内発現量の増加も同時に引き起こすことが明らかになりました。これはPER2の量が核内へ移行するCRYの量を決定するという先行研究において提唱されていたモデルにも合致します。蓄積したPER2やCRYは通常よりも長時間にわたって遺伝子の発現を抑制することにより、次のサイクルへの移行を遅延させたため、概日時計の周期を長くしていたと考えられます。
さらに、PER2のリン酸化スイッチは概日時計の周期の温度補償性(注3)に関与することが明らかになりました。一般的な化学反応は温度が高くなると反応速度が上がるのに対し、概日時計は異なる温度においても周期をほぼ一定に保つという温度補償性があることが知られていますが、これまでそのメカニズムはほとんど明らかになっていませんでした。PER2のリン酸化反応は比較的温度の影響を受けないという報告があり、PER2のリン酸化スイッチは概日時計の周期の温度補償性において重要な制御である可能性が考えられました。そこで、PER2-S478A変異マウスから線維芽細胞を作製し、発光レポーター(注4)を用いて細胞の概日リズムを可視化しました。異なる温度条件下で細胞を培養したところ、PER2-S478A変異マウス由来の細胞は温度変化に対する周期の変化が野生型と異なることがわかりました。ただし、温度補償性は完全には失われなかったため、PER2のリン酸化スイッチ以外にも温度補償性にかかわる制御があることが示唆されました。本研究を手掛かりとして、概日時計の温度補償性のメカニズムの詳細が今後明らかになると期待されます。
本研究により、PER2のβ-TrCP領域のリン酸化修飾が概日時計の周期制御に重要であることが示されました。将来このリン酸化制御を標的とした薬剤が開発されれば、概日時計の乱れに由来するさまざまな疾患の治療に役立つことが期待されます。
本研究は、シンガポール国立大学Duke-NUSのDavid M. Virshup教授、Rajesh Narasimamurthy研究員、韓国科学技術院KAIST のJae Kyoung Kim准教授との国際共同研究の成果です。また、特別推進研究「フレキシブルな概日ロバスト振動体の分子解剖と個体制御」(研究代表者:深田吉孝、課題番号:17H06096)、AMED PRIME機能低下「時計老化に基づく個体の機能低下を分子レベルで解明する」(研究代表者:吉種光、課題番号:17937210)、基盤研究(B)「概日時計DNAシス配列のシステムバイオロジー」(研究代表者:吉種光、課題番号:25440041)、Singapore’s NMRC/CIRG/1465/2017(研究代表者:David Virshup)などの支援を受けておこなわれました。
発表雑誌
- 雑誌名
Proceedings of the National Academy of Sciences of the United States of America ( PNAS )論文タイトル
Mutation of a PER2 phosphodegron perturbs the circadian phosphoswitch著者
Shusaku Masuda, Rajesh Narasimamurthy, Hikari Yoshitane, Jae Kyoung Kim, Yoshitaka Fukada*, and David M. Virshup*
※追記:本研究成果は、4月27日の週に公開される予定です。なお、本研究成果は、bioRxivにも掲載されております。
用語解説
注1 概日時計
明暗サイクルなどの時刻情報がない環境においても約24時間周期で繰り返される現象は概日リズム(circadian rhythm)と呼ばれ、これは概日時計(circadian clock)により生み出されている。時計遺伝子の転写翻訳を介した負のフィードバック制御が分子骨格であると考えられえている。
注2 PER2
ショウジョウバエを用いた順遺伝学的な変異体スクリーニングから同定された時計遺伝子Periodのホモログである。マウスやヒトには3つのPeriod遺伝子が知られており、中でもPeriod2は中心的な機能を担うと考えられ、よく研究されている。
注3 温度補償性
多くの化学反応は温度が10度上昇するとその反応速度が2~3倍早くなる。転写・翻訳などの化学反応に基づく概日時計であるが、その周期は約24時間であり、冬でも夏でもほぼ同じ周期でリズムを刻む。この概日時計の温度補償性は変温動物や単細胞生物でも報告されているが、その分子メカニズムは未だ不明ある。
注4 発光レポーター
PER2タンパク質にホタル由来のルシフェラーゼを連結することにより、生物発光としてPER2タンパク質の量を調べることができる。これを約1週間に渡って連続モニターすることにより、生物発光リズムとして概日時計のリズムを可視化することができる。
―東京大学大学院理学系研究科・理学部 広報室―