2020-09-30 分子科学研究所
発表のポイント
- 結晶性セルロースは地球上に大量に存在し資源としての活用が期待されている
- 細菌やカビのセロビオヒドロラーゼはセルロースを温和な条件で連続的に分解する
- 1分子観察、X線結晶構造解析、分子系統解析(*1)を用い、セルロース分解に対するセロビオヒドロラーゼの構造ドメインの役割が細菌とカビで異なることを解明した
- 細菌とカビのセロビオヒドロラーゼは、結晶性セルロースの効率的分解という同じ目的を達成するために異なる手段を選択して収斂進化(*2)したことを示唆する
概要
静岡大学の中村彰彦准教授、琉球大学の金子哲教授、横浜市立大学の水谷健二助教、千葉大学の村田武士教授、東京大学の五十嵐圭日子准教授、分子科学研究所の飯野亮太教授らの研究チームは、細菌由来のセロビオヒドロラーゼが結晶性セルロースを分解する上で分子内の構造ドメインが果たす役割を解明しました。1分子蛍光観察、X線結晶構造解析、分子系統解析により、セロビオヒドロラーゼの構造ドメインが果たす役割が細菌とカビで大きく異なることを明らかにしました。これらの結果は、細菌とカビのセロビオヒドロラーゼは、結晶性セルロースの連続的分解という同じ目的を達成するために収斂進化したことを示唆します。本成果は、国際学術誌Journal of Biological Chemistryに2020年8月18日付でオンライン掲載されました。
研究の背景
セルロースはグルコースが直鎖上に繋がった高分子化合物であり、植物の細胞壁を構成する主要成分です。地球上に最も大量に存在するバイオマスであり、その活用が期待されています。しかしながら、セルロースは個々の分子鎖が束になった強固な結晶構造を形成するため、その分解には高温高圧下での処理が必須となり、効率的な活用は達成されていません。他方、生物界には、結晶性セルロースを常温常圧の穏和な条件下で分解し、生じた糖類を栄養源として生育する細菌やカビが存在します。このような生物が産生するセルロース分解酵素は、結晶性セルロースの資源活用という観点で、基礎と応用の両面から精力的に研究されています。セルロース分解酵素の中でもセロビオヒドロラーゼは、結晶性セルロースの高分子鎖から解離しない連続的な分解が可能であり、大きく注目されています。
セロビオヒドロラーゼは、結晶性セルロース表面への結合に重要な結合ドメイン(図1緑色)、セルロースの高分子鎖を二糖に連続的に分解する触媒ドメイン(図1紫色)、および結合ドメインと触媒ドメインをつなぐリンカードメイン(図1青色)で構成されています。カビ由来のセロビオヒドロラーゼのリンカードメインは、決まった立体構造を取らない天然変性タンパク質であり、糖鎖(図1上の橙色で示した部分)で修飾されているという特徴を有しています。本研究グループはこれまでに、カビTrichoderma reeseiのセロビオヒドロラーゼTrCel6Aは、結合ドメインだけでなく糖鎖で修飾されたリンカードメインが結晶性セルロースへの結合に大きく寄与することを1分子蛍光観察で明らかにしていました。これは、カビのTrCel6Aは、結合ドメイン、リンカードメイン、触媒ドメインの全てを用いて結晶性セルロースの連続的な分解を行っていることを意味しています。
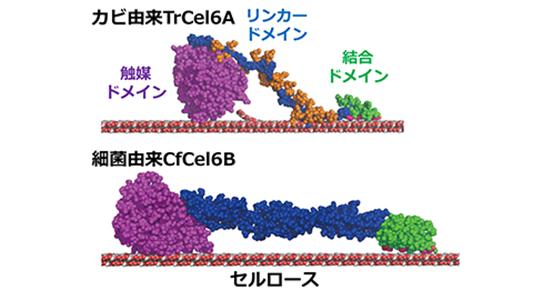
図1.カビと細菌のセロビオヒドロラーゼ(TrCel6A、CfCel6B)の構造モデル。
研究の成果
細菌由来のセロビオヒドロラーゼの結合ドメインとリンカードメインは、カビのものとは大きく異なっています(図1下)。しかしながら、細菌のセロビオヒドロラーゼの各ドメインの役割は完全には明らかになっていませんでした。本研究では、細菌Cellulomonas fimiのセロビオヒドロラーゼCfCel6Bの1分子蛍光観察を行い、結晶性セルロース分解における各ドメインの役割を詳細に調べました。その結果、カビのTrCel6Aとは異なり、細菌のCfCel6Bの結合ドメインは結晶性セルロースへの親和性がより高く、リンカードメインはセルロースへの結合に寄与しないことが明らかとなりました。また、CfCel6Bの触媒ドメインによるセルロース分解反応の連続性(セルロースから解離せずに何回連続で分解できるか)は、TrCel6Aの触媒ドメインの連続性よりも高いことが明らかとなりました。
次に、X線結晶構造解析により、CfCel6Bの触媒ドメインの構造を原子レベルで明らかにしました。その結果、セルロースの高分子鎖に結合して触媒部位に引き込むトンネル状構造が、カビのTrCel6Aの触媒ドメインよりも長いことを明らかにしました。これは、CfCel6Bの触媒ドメインがセルロース分解反応の高い連続性を示す理由と考えられます。また、CfCel6Bでは、結合ドメインに加え触媒ドメインもセルロースへの安定な結合に寄与していることを示しています。以上より、細菌のCfCel6BはカビのTrCel6Aと異なり、結合ドメインと触媒ドメインのみを用いて結晶性セルロースの連続的分解を行っていることが明らかとなりました。
さらに、触媒ドメインの構造に基づいて様々な生物種由来のセロビオヒドロラーゼの分子系統解析を行った結果、他のカビや細菌のセロビオヒドロラーゼの多くも、TrCel6AやCfCel6Bと類似のドメイン構成を持つことが明らかとなりました。これらの結果は、細菌とカビのセロビオヒドロラーゼは、結晶性セルロースの連続的分解という同じ目的を達成するために異なる戦略を用いていることを意味します。言い換えると、細菌とカビのセロビオヒドロラーゼはそれぞれ独立に、結晶性セルロースの連続的分解という同じ目的を達成するために収斂進化したと考えられます。
今後の展開・この研究の社会的意義
ある種の細菌のセロビオヒドロラーゼは、CfCel6Bや他の細菌由来のセロビオヒドロラーゼとは異なり、リンカードメインがカビのTrCel6Aの様に糖鎖で修飾されていることが最近報告されています。今後は、これらの細菌由来のセロビオヒドロラーゼを解析することで、結晶性セルロースを分解して栄養源にするために生物が取っている戦略の普遍性や多様性の理解を深めたいと考えています。さらに、セロビオヒドロラーゼを積極的に改変することで、天然に存在する分子よりもさらに分解活性が高い非天然型分子を創出し、結晶性セルロースのさらに効率的な分解や有効活用に繋げたいと考えています。
用語解説
*1)分子系統解析:
アミノ酸配列(塩基配列)を解析し、タンパク質(遺伝子)の進化の道筋を解明する方法
*2)収斂進化:
異なる系統の生物が環境要因などで同様の選択圧に曝されることで、似かよった形態へと変化する現象。ここでは、分子の進化の意味で使っている。
論文情報
掲載誌:Journal of Biological Chemistry
論文タイトル: “Domain architecture divergence leads to functional divergence in binding and catalytic domains of bacterial and fungal cellobiohydrolases”
(ドメイン構造の多様性が細菌とカビのセロビオヒドロラーゼの結合ドメインと触媒ドメインの機能の多様性に繋がる)
著者: Akihiko Nakamura, Daiki Ishiwata, Akasit Visootsat, Taku Uchiyama, Kenji Mizutani, Satoshi Kaneko, Takeshi Murata, Kiyohiko Igarashi, Ryota Iino
掲載日:2020年8月18日(オンライン公開)
DOI:https://dx.doi.org/10.1074/jbc.RA120.014792
研究グループ
中村彰彦 准教授(静岡大学)
石渡大貴 大学院生(総合研究大学院大学(当時))
Akasit Visootsat 大学院生(総合研究大学院大学)
内山拓 研究員(東京大学、当時)
水谷健二 助教(横浜市立大学)
金子哲 教授(琉球大学)
村田武士 教授(千葉大学)
五十嵐圭日子 准教授(東京大学)
飯野亮太 教授(分子科学研究所)
研究サポート
科研費・新学術「発動分子科学」 JP18H05424、JP18H05425
科研費・新学術「植物構造オプト」 18H05494
科研費・基盤研究(B)18H02418、19H03094
科研費・研究活動スタート支援15H06898
研究に関するお問い合わせ先
飯野亮太(いいの りょうた)
分子科学研究所 教授
報道担当
自然科学研究機構・分子科学研究所
研究力強化戦略室 広報担当