自閉スペクトラム症の治療戦略と創薬の発展に期待
2020-10-12 東京大学,東京医科歯科大学,日本医療研究開発機構
発表者
狩野方伸(東京大学大学院医学系研究科 機能生物学専攻 神経生理学分野 教授/国際高等研究所ニューロインテリジェンス国際研究機構(WPI-IRCN) 副機構長・主任研究者)
酒井浩旭(東京大学大学院医学系研究科 機能生物学専攻 神経生理学分野 大学院生:研究当時)
上阪直史(東京大学大学院医学系研究科 機能生物学専攻 神経生理学分野 講師:研究当時(現 東京医科歯科大学大学院医歯学総合研究科認知神経生物学分野 教授)
発表のポイント
- 社会性・コミュニケーション障害を示す自閉スペクトラム症(ASD)の原因候補遺伝子を利用し、シナプス機能異常と社会性低下の因果関係や社会性低下の原因となる脳領域をマウスでつきとめました。
- 大脳皮質前頭前野の錐体細胞におけるシナプス機能異常がASD症状を引き起こす一因である可能性を提案しました。
- ASDの病態解明に貢献するメカニズムを明らかにしたことにより、ASDの治療戦略や創薬の発展に貢献できると期待されます。
発表概要
自閉スペクトラム症状(ASD)は社会的コミュニケーション障害と常同行動・限定的興味行動(注1)の2つの中核症状を特徴とした神経発達障害です。近年のASDのゲノム解析により、100以上の関連遺伝子が同定されてきました。またASD病態の原因のひとつとして、神経細胞のシナプス機能の異常が考えられています。しかし、多くのASD関連遺伝子はシナプスにどのような機能的影響を及ぼすのか、ASDで見られる行動異常とどの程度関連しているのか、はよくわかっていません。さらにシナプス機能異常と行動異常の因果関係もほとんど明らかにされていません。
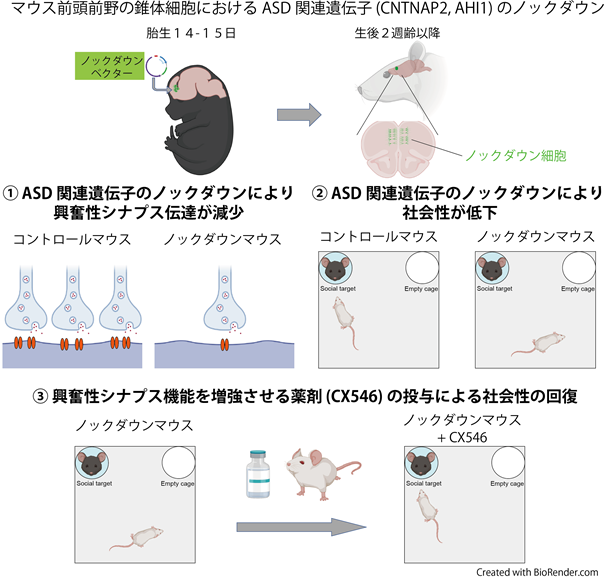
今回、東京大学大学院医学系研究科機能生物学専攻神経生理学分野の酒井浩旭大学院生(研究当時)、上阪直史講師(研究当時)と狩野方伸教授らの研究グループは、ASD関連遺伝子としてよく知られているCNTNAP2(注2)遺伝子とAHI1(注3)遺伝子に注目しました。社会性行動に関連する重要な脳領域である大脳皮質前頭前野(注4)に着目し、マウス大脳皮質前頭前野の2/3層錐体細胞(注5)特異的にCNTNAP2もしくはAHI1遺伝子の発現を抑制し、シナプス機能と行動を包括的に解析しました。その結果、CNTNAP2もしくはAHI1の発現低下は共通して興奮性シナプスの機能低下とASDによく似た行動異常を引き起こすことを発見しました。また、これらのマウスに興奮性シナプス伝達を増強させる薬剤を投与すると、ASD類似行動が抑制されました。
ASDの中核症状に対する有効な治療薬はなく、ASD患者は多種多様な臨床症状を伴い、機序も多岐に渡り薬物治療は困難と予測されます。本研究はASDの症状の中で共通してみられる社会性障害のメカニズムの一端を解明したことにより、ASDの体系的な治療法の確立や興奮性シナプス機能を標的とした治療薬の開発に貢献することが期待されます。
本研究成果は、2020年10月12日(英国時間)午前10時に「Nature Communications」のオンライン版に掲載されます。
本研究は、科学研究費補助金(課題番号:24220007、25000015、18H02539、18H04012、19H05204)の助成を受けて行われました。また、国立研究開発法人日本医療研究開発機構(AMED)の「脳科学研究戦略推進プログラム:臨床と基礎研究の連携強化による精神・神経疾患の克服(融合脳)」の一環として実施されました。
発表内容
①研究の背景・先行研究における問題点
ASDは100人に1人以上の割合で発症する頻度の高い疾患で、その中核症状は社会的コミュニケーション障害と常同行動・限定的興味行動です。小児期に疾患が明らかとなり生涯に渡って症状は続きますが、現在有効な治療薬は存在せず、社会的に大きな問題となっています。
近年の大規模な遺伝子解析によって多数のASD原因候補遺伝子が報告されています。このうちの多くがシナプスに局在するタンパクをコードしていることから、ASDの病態としてシナプスの機能異常が考えられています。しかし、それぞれのASD原因候補遺伝子と社会的コミュニケーション障害などのASD行動との関連性、さらにシナプス機能異常とASD行動との因果関係は不明な点が多く残されています。
本研究では、ASD原因候補遺伝子として良く知られているCNTNAP2およびAHI1遺伝子に着目しました。これまでの動物実験による知見からCNTNAP2遺伝子はシナプス機能、ASD類似行動について複数報告されていますが、AHI1遺伝子はASD類似行動に関連するのか、どのようにシナプス活動を制御するのかは全く不明なままでした。
②研究内容(具体的な手法など詳細)(図参照)
研究グループは、まず社会性行動に重要な脳領域を同定するため、in utero electroporation法(注6)を用いて、マウス大脳皮質前頭前野の2/3層錐体細胞特異的にCNTNAP2遺伝子の発現を抑制し、シナプス機能と行動を包括的に解析しました。前頭前野2/3層錐体細胞のCNTNAP2遺伝子の発現低下により、グルタミン酸による興奮性シナプス伝達(注7)およびγアミノ酪酸(GABA)による抑制性シナプス伝達が低下していました。抑制性シナプス伝達の強さと興奮性シナプス伝達の強さをこれらの比を計算して比較すると、抑制/興奮バランスが増加していました。また、CNTNAP2発現抑制マウスは社会性行動が低下し、マウスのコミュニケーションを反映すると考えられている超音波発声が減少しており、前頭前野2/3層錐体細胞がASD病態に重要な脳部位である可能性が明らかとなりました。次に、前頭前野2/3層錐体細胞のAHI1遺伝子の発現を低下させ、シナプス機能と行動を解析しました。その結果、抑制性シナプス伝達は正常でしたが興奮性シナプス伝達が低下し、抑制/興奮バランスが増加していました。また行動解析の結果では、CNTNAP2発現抑制マウスと同様、社会性行動の低下と超音波発声の減少が見いだされました。よって、シナプス機能およびASD類似行動におけるAHI1遺伝子の役割が明らかとなりました。最後に、両遺伝子の共通の異常である興奮性シナプス伝達の減少に注目し、興奮性シナプス伝達を増強させる薬剤を投与しました。その結果、CNTNAP2もしくはAHI1遺伝子発現低下による前頭前野2/3層錐体細胞の興奮性シナプス伝達異常が正常化し、社会性行動障害も回復しました。これらの結果から、ASDの治療戦略として大脳皮質前頭前野2/3層錐体細胞における興奮性シナプス伝達を標的とした創薬が有効である可能性を見出しました。
③社会的意義・今後の予定など
ASDは多くの原因候補遺伝子がシナプス結合や神経伝達物質の調整に関連する遺伝子であることから、その主要病態のひとつとしてシナプス異常が提唱されています。また、ASDは多様性の高い疾患で、その病態と考えられるシナプスの変化として相反する結果が報告されていることから、個々の原因候補遺伝子がシナプス機能に果たす役割とASD類似行動との関連を解明し、それぞれの異常を分類することが重要です。これらによりASDをグループ分けし、それぞれのグループに対して治療戦略や治療薬を開発することが必要になります。今回の研究により、大脳皮質前頭前野2/3層錐体細胞の興奮性シナプス伝達低下が、あるグループのASDで見られる共通のシナプス病態である可能性が考えられます。また、興奮性シナプス伝達を増強させることが特定のASD患者の治療に有効である可能性を見出しました。今後、多くのASD原因候補遺伝子に関して、遺伝子‐シナプス機能‐ASD類似行動の3つの因果関係を明らかにすることで、多様なASDの病態が解明され、シナプス機能に基づく体系的ASD治療法の開発が促進されることが期待されます。
発表雑誌
- 雑誌名
- 「Nature Communications」(2020年10月12日オンライン版)
- 論文タイトル
- Autism spectrum disorder-like behavior caused by reduced excitatory synaptic transmission in pyramidal neurons of mouse prefrontal cortex
- 著者
- Hiroaki Sacai, Kazuto Sakoori, Kohtarou Konno, Kenichiro Nagahama, Honoka Suzuki, Takaki Watanabe, Masahiko Watanabe, Naofumi Uesaka, & Masanobu Kano
- DOI番号
- 10.1038/s41467-020-18861-3
用語解説
- (注1)常同行動・限定的興味行動
- 反復的・儀式的な行動、興味を持つと過剰といえるほど熱中する行動、特定の習慣や儀式にかたくなにこだわる行動など。
- (注2)CNTNAP2
- Contactin-associated protein-like 2。ニューレキシンファミリーの遺伝子でシナプス接着分子。皮質異形成-焦点てんかん症候群で同定された遺伝子で、その疾患の臨床症状としてASDも含まれます。また、CNTNAP2はASDリスク遺伝子としても報告されています。CNTNAP2をノックダウンもしくはノックアウトした場合の細胞や動物実験では、シナプス異常やASD類似行動を示します。
- (注3)AHI1
- Abelson helper integration site-1。ジュベール症候群の原因遺伝子のひとつで、その患者の30%程度がASD症状を示すと報告されています。また、ASD患者とAHI1遺伝子の関連性についても報告されています。
- (注4)前頭前野
- 作業記憶や周囲の様々な情報などを統合して、行動を調整する脳部位で、社会的行動などの高次機能を司ることが知られています。ヒトの脳画像研究で、前頭前野はASDとの関連が指摘されています。
- (注5)錐体細胞
- 大脳皮質の主要な興奮性神経細胞で、グルタミン酸を神経伝達物質としています。前頭前野では全神経細胞の70~80%程度を占めています。
- (注6)in utero electroporation
- マウス子宮内胎仔脳へ遺伝子導入を可能とする手法。胎生14日頃のマウス胎児の脳室にRNAi配列を発現させるためのプラスミドを注入し、前頭前野を狙って電圧パルスを与えることで、その時に神経幹細胞から生み出されている神経細胞(この場合は、前頭前野2/3層の錐体細胞)にRNAi配列が発現され、目的遺伝子発現が抑制されます。
- (注7)シナプス伝達
- 神経伝達物質を介した神経細胞間での情報伝達。前頭前野(注3)をはじめとして、脳ではグルタミン酸を介する興奮性シナプス伝達とGABAを介する抑制性シナプス伝達の2種類が代表的なシナプス伝達です。
お問い合わせ先
研究内容に関するお問い合わせ
東京大学大学院医学系研究科 機能生物学専攻 神経生理学分野
教授 狩野方伸(かのうまさのぶ)
取材に関するお問い合わせ
東京大学医学部総務チーム(総務担当)
東京医科歯科大学 総務部総務秘書課広報係
AMEDについてのお問い合せ
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
脳科学研究戦略推進プログラム