2020-10-12 国立がん研究センター
研究成果のポイント
- 血液中を流れるがん由来のDNA(circulating tumor DNA, ctDNA)を用いた血液検査は、CT検査や腫瘍マーカー検査に比べ、高い精度で早期再発検出、治療効果判定、および無再発状態確定に役立つことがわかりました。
- 食道がんを対象に、低コストで短い検査時間で解析が可能なデジタルPCRを用いた超高感度ctDNA検査の実用性を世界で初めて示した研究です。
- 個々の患者のがんに生じている遺伝子変異が患者特有の腫瘍マーカーとなりうるため、本手法は食道がん以外の多くのがんにも応用可能であり、がん診療における腫瘍マーカー検査を大きく改善する可能性があります。
概要
岩手医科大学外科学講座:岩谷岳准教授、医歯薬総合研究所医療開発研究部門:西塚哲教授らの研究グループは、札幌医科大学フロンティア医学研究所ゲノム医科学部門:時野隆至教授、医療人育成センター生物学教室:佐々木泰史教授、国立がん研究センター研究所細胞情報学分野・連携研究室:増田万里主任研究員らと共同で、血液中を流れる患者特有のがん由来DNAの超高感度検査の食道がん患者診療における実用性を明らかにしました。この成果は米国消化器病学会雑誌「Gastroenterology」の電子版に公開されました。
背景
がん患者診療における治療方針の決定、治療効果判定、治療後の再発診断にはCTスキャンや血液腫瘍マーカーが用いられています。CTスキャンは進行度診断・再発診断に不可欠な検査ですが、放射線被ばくや微小病変の診断精度が問題点とされています。一方、血液を用いた腫瘍マーカー検査は簡便ですが、偽陽性・偽陰性が多く診療経過中の腫瘍量の増減を正確に反映していない症例も数多く見られます。
血液中には体内の細胞から遊離したDNA断片が存在しますが、がん患者ではがん細胞から遊離したDNAも血液中を循環しており、腫瘍細胞由来血中循環遊離DNA (circulating tumor DNA: ctDNA)と呼ばれています(図1)。ctDNAはがん細胞に由来するため個々の患者のがんに生じている特有の変異を共有しており、個別化血液バイオマーカーとして近年注目されています。さまざまながんでctDNAを用いた診断の有用性を期待する報告がされていますが、その実用性に関する検証は少なく、いまだ日常検査には至っておりません。
ctDNA検査法は次世代シークエンサー(Next generation sequencer: NGS)を用いた方法とデジタルPCRを用いた方法に大きく分けられます。前者は多数の遺伝子異常を同時に解析可能であり、薬物療法の根拠となる変異の同定などスクリーニング検査に優れています。しかし、解析費用が高額かつ検査に時間がかかるためくり返し行われる検査としては普及させにくいのが現状です。一方、デジタルPCRは少数の変異のみを解析する方法ですが、対象とする変異に対してはNGS解析に比較して10~100倍の検出感度を有するほか、検査時間が短く安価なためくり返し検査に適した手法です。本研究では、デジタルPCRによるctDNA検査が、再発リスクを有する食道がん治療後患者の検査に有効かどうかを検証しました。
内容
ステージI~IVの食道がん患者を対象とし、食道がんで高頻度に異常が見られる31遺伝子の変異スクリーニングを行いました。患者特有の変異を用いてデジタルPCRにより診療経過中のctDNAの推移を追跡し、CTスキャンや腫瘍マーカーとの比較検討を行いました。
治療によりctDNA陰性化が見られた患者では、高度進行がんであっても長期生存が得られました。また、再発が見られた患者ではCTスキャンより約5か月早くctDNAの上昇が確認されました。さらに、手術、放射線治療、化学療法の治療効果に合わせてctDNAの増減が見られ、治療終了後無再発の患者ではctDNAの陰性状態が維持されていました。ctDNAによる追跡を行った91%の症例で、「再発・増大の早期予測」、「治療効果の正確な判定」、「無再発状態の確認」、の1つ以上の項目で臨床検査としての妥当性を有することが明らかになりました。いずれの項目でもctDNA検査は既存の血液腫瘍マーカーに比べてより多くの症例で臨床所見の推移に合致していました。図2に食道がん治療経過中のctDNAの推移を示しました。既存の腫瘍マーカー検査ではおそらく困難であったような、治療が奏功した場合のctDNAの陰性化、再発に先行したctDNAの上昇、治療後の無再発状態でのctDNA陰性の維持など、ctDNAが迅速に必要な情報を反映していることが確認できます。
ctDNAと食道がん患者の予後に関する検討では、治療開始後にctDNAが陰性化する患者は治療後もctDNA陽性を維持する患者に比べ有意に予後が良いことが示されました(図3)。以上から、治療経過に合わせ複数の採血ポイントでctDNAの変動を追跡することが重要と考えられます。
超高感度デジタルPCR検査を行うことで、ctDNA検査は採血という小さな体の負担のみで、既存のCTスキャンより高い精度で治療後食道がんの診断が可能です。デジタルPCRを活用した本手法は導入しやすく、既存の検査システムを大きく改善する可能性があります。
今後の発展
ctDNA検査は再発や治療効果、無再発状態を正確に判定可能でありCTなど侵襲的検査を減少させる可能性があり、ctDNA検査ががん患者の日常的な臨床検査になる可能性があります。
現在がんゲノム検査から治療根拠となる遺伝子変異が検出される割合は10%程度と低いですが、本研究は個々の患者のがんに生じている遺伝子変異が患者特有のバイオマーカーとなりうることを示しており、がんゲノム検査結果の有効利用につながるものと考えられます。
用語解説
(注1) ctDNA
血中循環腫瘍DNA (circulating tumor DNA)は、がん細胞のDNAが細胞死などにより血液中に漏れ出したもので、短く断片化されやがて体外に排出されます。がん細胞がもつDNAの異常を血液で調べることができるため、がん診断への利用が期待されています。しかし、進行がんでも血液中の全遊離DNAに含まれるがん由来のDNAは1%以下と微量であることが多く、高感度の検出技術が必要です。
(注2) バイオマーカー
血液や尿などの体液や組織に含まれる、タンパク質や遺伝子などの生体内の物質で、病気の変化や治療に対する反応に相関し、指標となるもの。バイオマーカーの量を測定することで、病気の存在や進行度、治療の効果の指標の1つとすることができます。
(注3) デジタルPCR
デジタルPCRはサンプル中に含まれる個々の分子の数をカウントして定量を行う新しい技術で、従来のPCR法に比べ正常サンプル中に0.01%程度のレベルでわずかに含まれる希少な分子を同定・定量することが可能な手法です。
(注4) 遺伝子パネル
病気の発生に関わる遺伝子異常を調べるための複数の遺伝子のセットのこと。ヒトでは2万個以上の遺伝子が存在しますが、目的に応じたさまざまな遺伝子パネルが存在します。がんゲノム医療ではがんに関連する数百個の遺伝子のセットによるがん遺伝子パネルが用いられています。本研究では、食道がんで異常が報告されている31遺伝子のパネルを作成し解析を行いました。
原著論文
発表雑誌名:Gastroenterology
論文タイトル:
Frequent tumor burden monitoring of esophageal squamous cell carcinoma with circulating tumor DNA using individually designed digital PCR
著者:
Takeshi Iwaya(所属1,2), Fumitaka Endo(所属1), Fumiaki Takahashi(所属3), Takashi Tokino(所属4), Yasushi Sasaki(所属4,5), and Satoshi S. Nishizuka(所属6)
所属:
1)岩手医科大学外科学講座
2)岩手医科大学分子治療研究室
3)岩手医科大学教養教育センター情報科学科医用工学分野
4)札幌医科大学フロンティア医学研究所ゲノム医科学部門
5)札幌医科大学医療人育成センター生物学教室
6)岩手医科大学医歯薬総合研究所医療開発研究部門
研究協力者 (Collaborators):
Mizunori Yaegashi,1 Noriyuki Sasaki(所属1,2), Ryosuke Fujisawa,(所属1,3), Hayato Hiraki(所属2), Yuji Akiyama(所属1), Akira Sasaki(所属1), Yuji Suzuki(所属4), Mari Masuda(所属5), Tesshi Yamada(所属6)
所属:
1)岩手医科大学外科学講座
2)岩手医科大学医歯薬総合研究所医療開発研究部門
3)岩手医科大学分子治療研究室
4)岩手医科大学内科学講座消化器内科肝臓分野
5)国立がん研究センター研究所細胞情報学分野・連携研究室
6)国立がん研究センター研究所創薬臨床研究分野(当時)
Corresponding author:Takeshi Iwaya and Satoshi S. Nishizuka
研究代表者:岩谷 岳
謝辞
本研究は文部科学省日本学術振興会科学研究補助金 (JSPS JP16H01578, JP16K19951, JP16K19952, JP17K10605, 19K09224, JP16H06279)および岩手医科大学圭陵会研究助成(#131, #136)による助成をうけて行われました。また、本研究にご協力いただいた患者様のご厚意に深謝いたします。
図面
図1.血中循環遊離DNA

図1.血中循環遊離DNA
血流中には体内の細胞から血液中に遊離し、短く断片化されたDNAが循環している。がん(腫瘍)細胞に由来するものをcirculating tumor DNA (ctDNA)と呼んでいる。ctDNAはがん病巣におけるがん細胞に見られる変異と同じ変異を持つため、血液でのがん診断が可能となる。しかし、正常細胞由来のDNAも大量に循環しており、ctDNAの割合は多くの患者で1%以下と微量である。
図2. 食道がん患者におけるctDNAモニタリングの一例
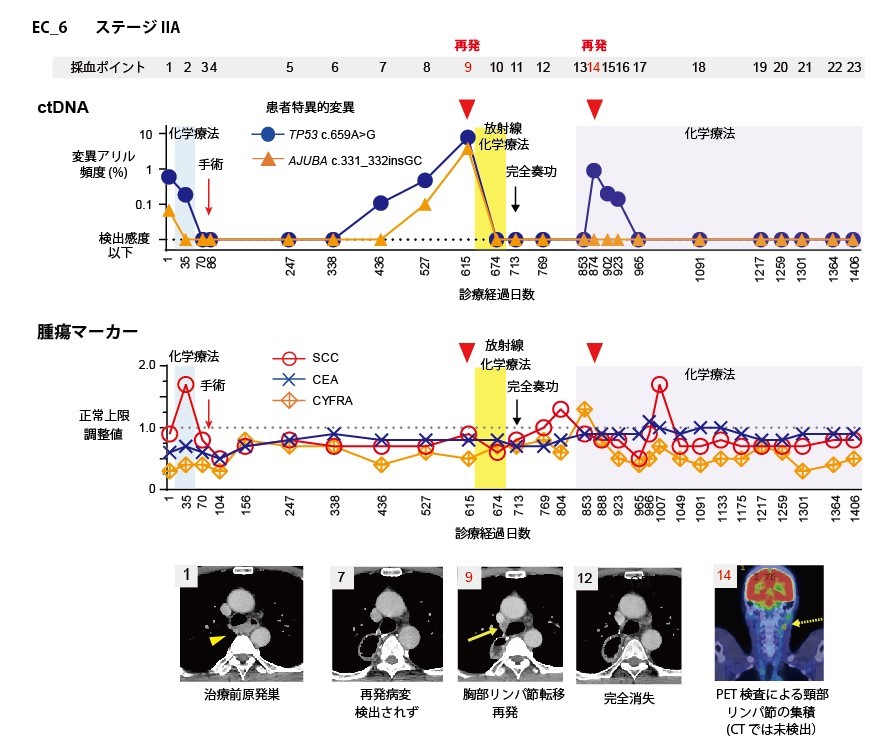
図2. 食道がん患者におけるctDNAモニタリングの一例
食道がん患者診療経過中のctDNA(上段),および既存の腫瘍マーカー(中段)の変動を示した。
原発巣の遺伝子解析でTP53とAJUBAという遺伝子に生じていた患者固有の変異を標的として診療経過中23回の採血ポイントでctDNA検査を行った。縦軸の「変異アリル頻度」は正常細胞に由来するDNAも含めた全血中遊離DNAにがん由来の変異DNAが含まれる割合を示している。615日(採血ポイント9)にCT検査で胸部のリンパ節の再発が確認されたが、約6か月前の436日の時点でctDNAの上昇がみられている。また、853日ではPET検査で頸部リンパ節に集積が認められたが、画像検査だけでは再発の確定診断には至らなかった。同時期のctDNAの上昇から食道がんの再発であることが明らかとなった。治療による病変の消失にともないctDNAも陰性化し、無再発状態ではctDNA陰性が維持されている。既存の腫瘍マーカーでは病勢を正確に反映できていないことがわかる。
図3.治療開始後ctDNA変化と生存曲線
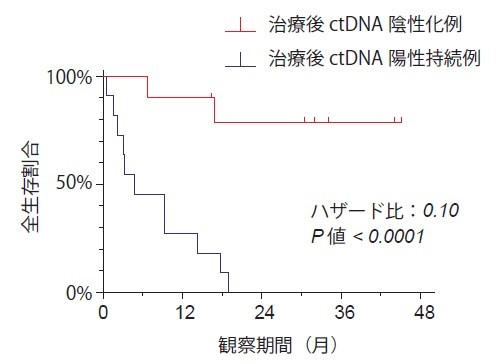
図3.治療開始後ctDNA変化と生存曲線
治療開始後3か月までにctDNAの陰性化が見られた患者(赤)は、治療後もctDNA陽性を持続した患者(青)に比べ予後がよいことが示されている。
研究全般に関する問い合わせ先
岩手医科大学外科学講座 准教授 岩谷 岳(いわや たけし)
岩手医科大学医歯薬総合研究所医療開発研究部門 教授 西塚 哲(にしづか さとし)
報道関係からのお問合せ先
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室