2020-11-06 東京大学
生田 達也(研究当時:生物科学専攻 博士課程3年/東北大学大学院薬学研究科 助手)
志甫谷 渉(生物科学専攻 特任助教)
内橋 貴之(名古屋大学大学院理学研究科 教授/自然科学研究機構 生命創成探究センター 客員教授)
神取 秀樹(名古屋工業大学大学院工学研究科 オプトバイオテクノロジー研究センター 教授)
濡木 理(生物科学専攻 教授)
発表のポイント
- 光に応答して環状ヌクレオチド(注1)を分解するRh-PDEの立体構造を解明しました。
- Rh-PDEの属すロドプシンファミリータンパク質(注2)は、これまで7本の膜貫通ヘリックス(注3)をもつと考えられてきました。それにも関わらず、Rh-PDEは8本の膜貫通ヘリックスからなることを構造的に明らかにし、1本多いヘリックスの果たす役割を解明しました。
- 本研究は、ロドプシンファミリータンパク質の多様性への理解を深めるとともに、これまで考えられてきたロドプシンの定義を広げるものです。
発表概要
ロドプシンファミリータンパク質は光に応答するために使われるタンパク質であり、ヒトから細菌まで多くの生物が持っています。細胞膜表面に発現するロドプシンは、細胞膜を7回貫通する7回膜貫通型タンパク質だと考えられてきました。2017年に発見されたロドプシンホスホジエステラーゼ(Rh-PDE)は膜貫通領域に加えて酵素部位が存在し、光依存的な酵素として働く新規ロドプシンです。Rh-PDEは、こうした既存のロドプシンファミリータンパク質とは異なり、8回膜貫通型であると推測されていました。
今回、東京大学大学院理学系研究科の濡木教授らのグループは、名古屋工業大学大学院工学研究科およびオプトバイオテクノロジー研究センターの神取教授らのグループおよび名古屋大学大学院理学研究科の内橋教授らのグループとの共同研究のもと、X線結晶構造解析(注4)によりRh-PDEの立体構造を決定しました。決定した立体構造からRh-PDEの1本多い膜貫通ヘリックスとそれ以外の7本の膜貫通ヘリックスの位置関係が明らかになり、さらにこの1本多いヘリックスがRh-PDEの安定性と発現に関わっていることが明らかになりました。この研究により、今後ロドプシンファミリータンパク質の多様性に対する研究が進展していくことが期待されます。
本研究成果は、日本時間2020年11月5日にオンライン科学雑誌Nature Communications誌に掲載されました。
発表内容
ヒトをはじめとする様々な生物はロドプシンと呼ばれるタンパク質を細胞膜に発現させ、環境からの光に応答しています。襟べん毛虫(注5)と呼ばれる微生物もこのロドプシンタンパク質を持っており、光に応答してコロニーを反転させます。この反応に関わるのは、2017年に発見されたロドプシンホスホジエステラーゼ(Rh-PDE)と呼ばれるタンパク質です。Rh-PDEは、光に応答する膜貫通部位と環状ヌクレオチドを分解する酵素部位からなります。Rh-PDEの属すロドプシンファミリーは、これまで7回膜貫通型のものしかないと考えられてきましたが、Rh-PDEのロドプシン部位は8回膜貫通であることが予測されていました。しかし、この1回余分に存在する膜貫通部位がどのような位置関係で存在するのか、またどのような役割を果たしているのかといった疑問は謎に包まれたままでした。
今回、東京大学大学院理学系研究科の濡木理教授らの研究グループはX線結晶構造解析により、Rh-PDEの膜貫通部位の立体構造を明らかにしました(図1)。
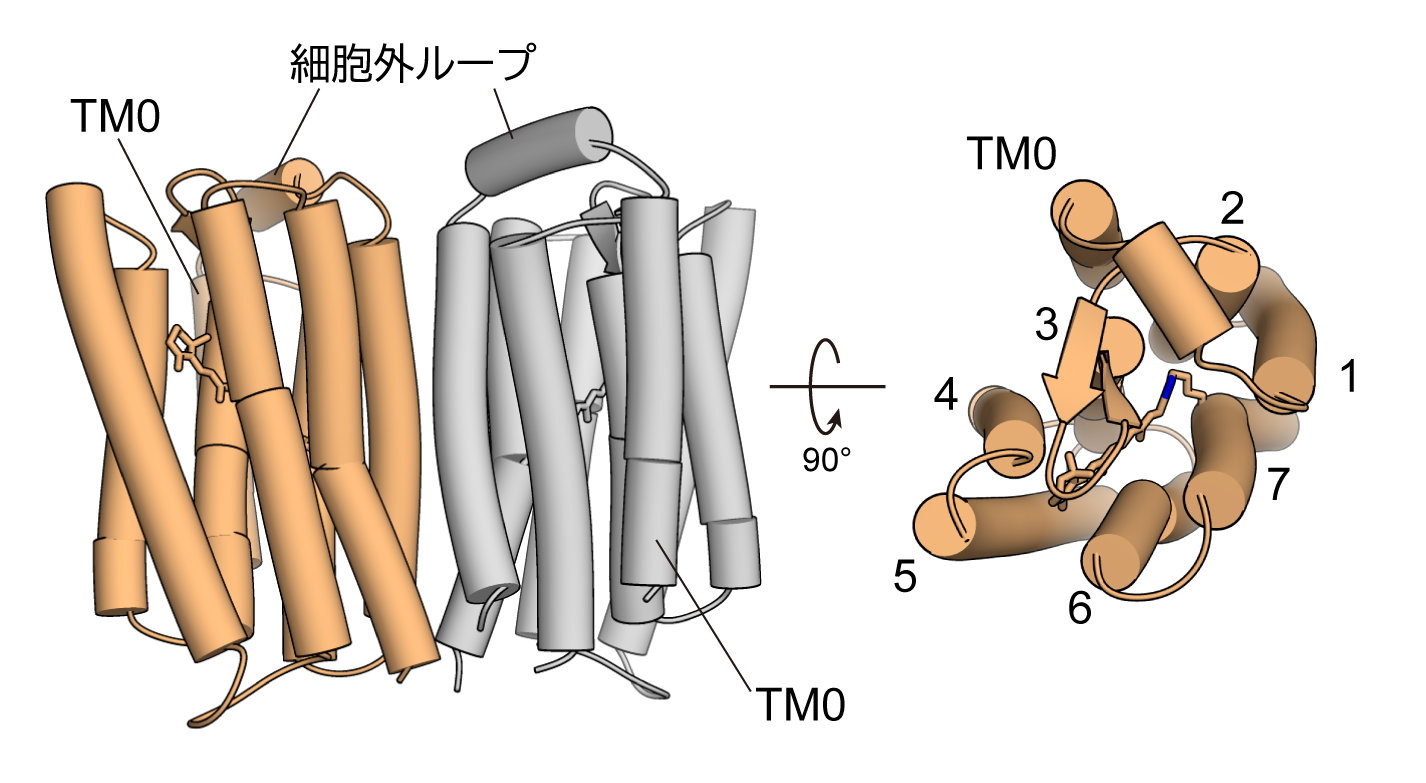
図1:決定したRh-PDEの膜貫通部位の構造
(左)細胞膜面から見た二量体および(右)細胞外側から見た単量体の図。
Rh-PDEの膜貫通部位は、予測されていたとおり8回膜貫通型であり、追加の膜貫通ヘリックス(TM0)は、通常のロドプシンで見られるような7回膜貫通部位と細胞外ループを通してつながっていました(図2)。
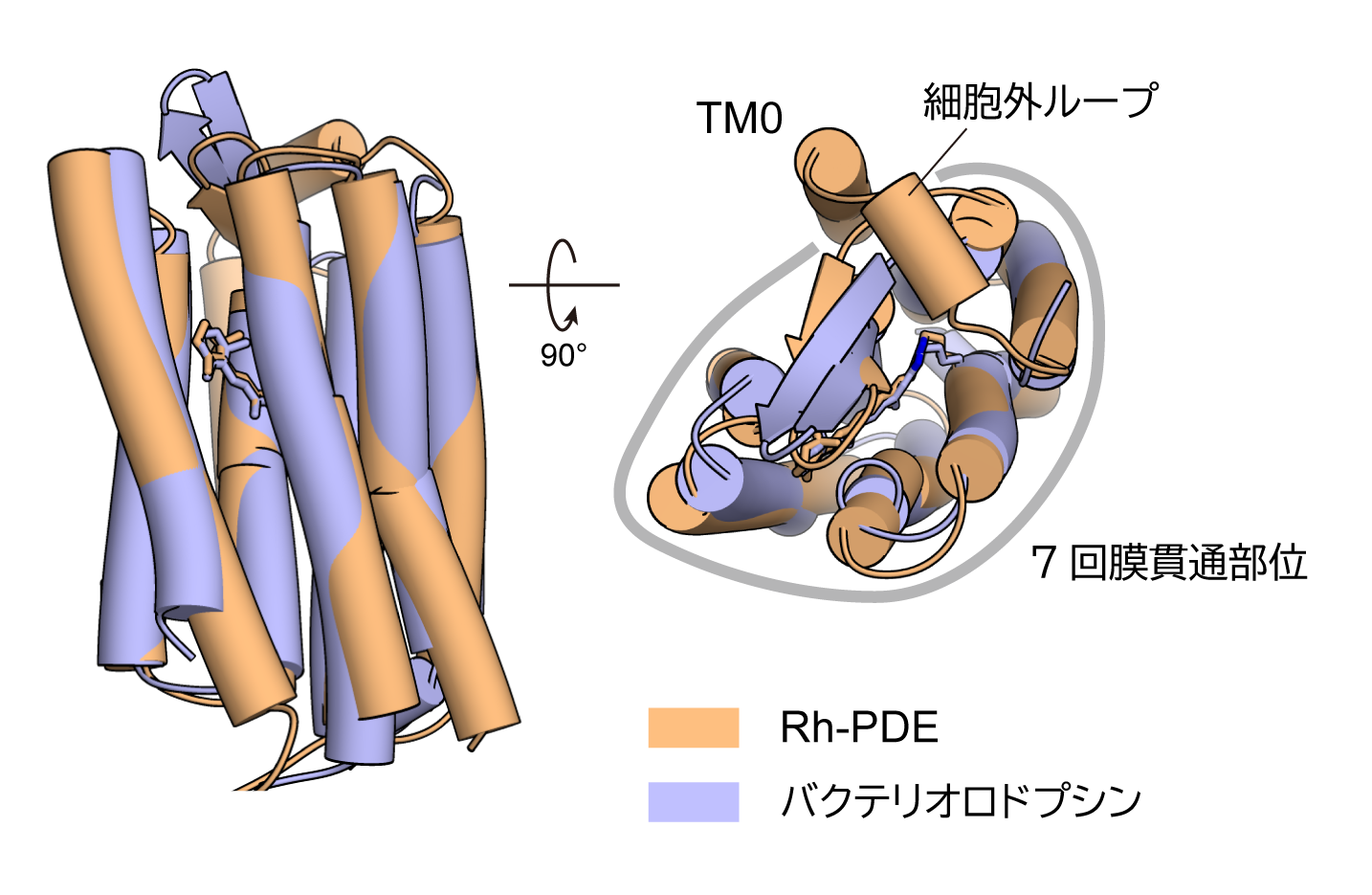
図2:決定したRh-PDEの膜貫通部位の構造とバクテリオロドプシン(注7)の構造の比較
(左)細胞膜面および(右)細胞外側からの図。
膜貫通部位は、結晶構造中では二量体を形成していましたが、このTM0は二量体界面に存在しているわけではありませんでした。このTM0についてさらに詳しく調べるために全長Rh-PDEからTM0を欠失させた変異体を作製し、名古屋工業大学・神取研究室との共同研究を行って発現量や光活性を評価しました。この変異体は野生型に比べて低い発現量や光活性を示しました。このことから、TM0は発現量や光活性に大きな役割を果たしていることが示唆されました。
Rh-PDEの膜貫通部位の立体構造はわかったものの、膜貫通部位と酵素部位がどのように相互作用しているのかは不明なままでした。そこで、膜貫通部位と酵素部位をつなぐリンカー部位を含んだような膜貫通部位、酵素部位の構造も決定しました(図3左・中央)。すると、膜貫通部位からまっすぐヘリックスが伸びてリンカーになっていること、酵素部位も二量体を形成しておりリンカーはその二量体界面からつながっていることがわかりました。さらに、リンカー部位全体を構築するために、計算機を使用して構造予測を行いました(図3右)。
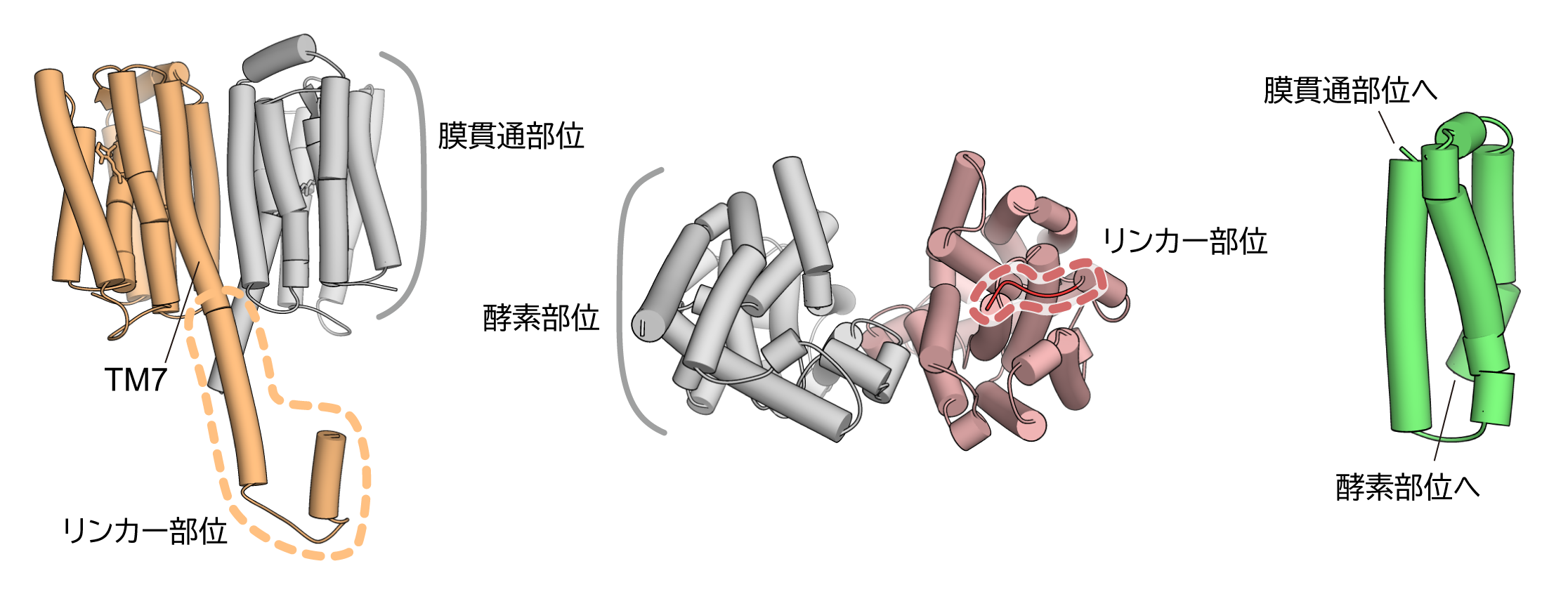
図3:Rh-PDEのリンカー構造
(左)Rh-PDEの膜貫通部位とリンカー部位の構造(中央)Rh-PDEの酵素部位とリンカー部位の構造
(右)計算機によるリンカー部位全体の構造予測モデル。
これらの構造からRh-PDEの全長構造モデルを構築するために、名古屋大学・内橋研究室との共同研究を行い、全長Rh-PDEの高速原子間力顕微鏡(AFM)観察(注6)を行いました(動画1)。

動画1:高速AFMを用いたRh-PDEの観察
この観察結果を踏まえてRh-PDEの全長構造のモデルを構築し(図4)、光活性化メカニズムの提唱を行いました。
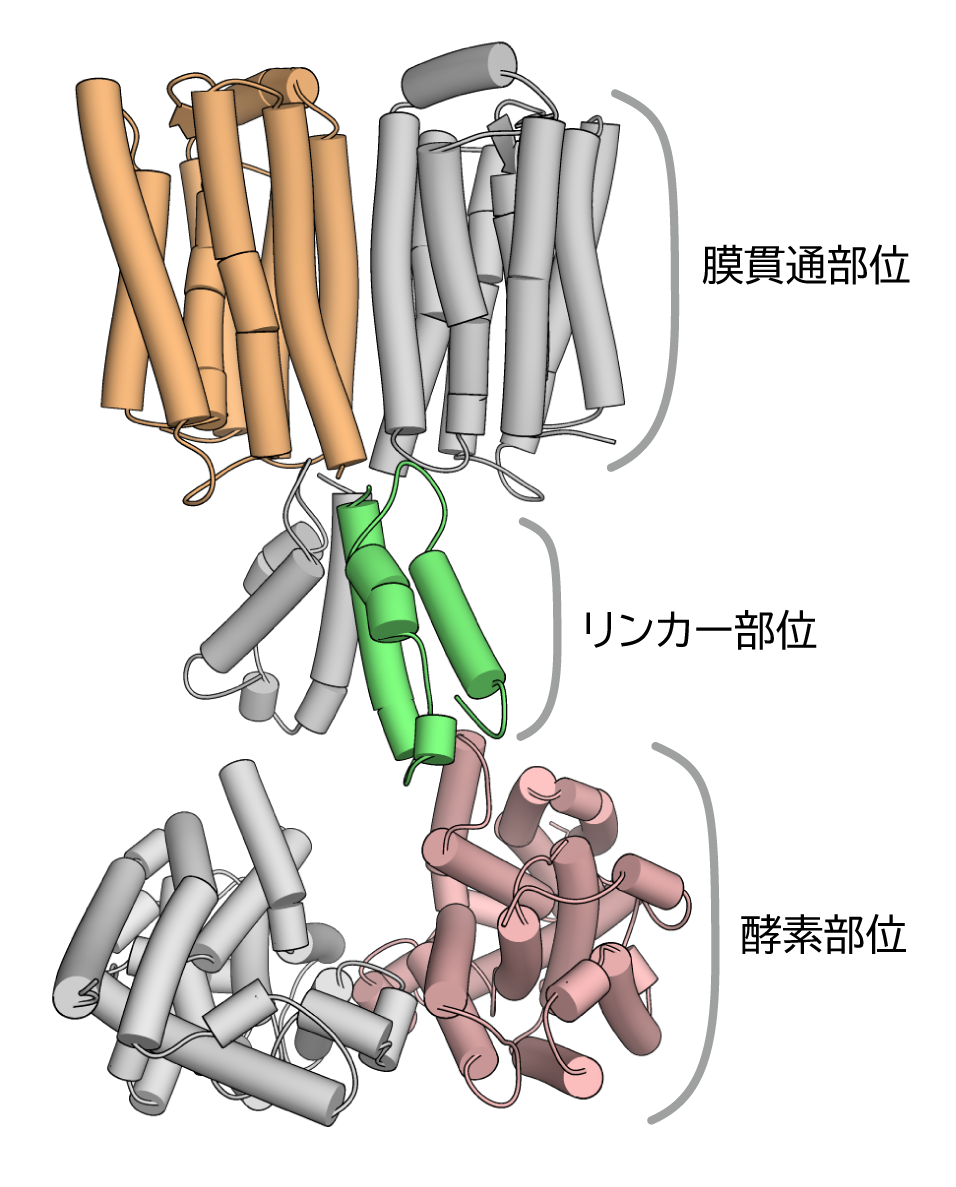
図4:Rh-PDEの全長構造モデル
本研究により8回膜貫通型のロドプシン酵素の構造とメカニズムが解明されたことで、今後、ロドプシンの多様性に関わる研究が進展していくことが期待されます。
本研究は、日本学術振興会における科学研究費助成事業の特別推進研究「物理刺激で制御される膜蛋白質の分子機構の解明」(課題番号:16H06294 研究開発代表者:濡木理)および新学術領域研究「XFELを用いた非古典的ロドプシンのダイナミクスの解明」(課題番号:20H05437 研究開発代表者:志甫谷渉)および科学技術振興機構(JST)戦略的創造研究推進事業(CREST)研究領域「光の特性を活用した生命機能の時空間制御技術の開発と応用」(研究総括:影山龍一郎)の研究課題「細胞内二次メッセンジャーの光操作開発と応用」(研究代表者:神取秀樹)の一環で行われました。また、本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。
発表雑誌
- 雑誌名
Nature Communications論文タイトル
Structural insights into the mechanism of rhodopsin phosphodiesteras著者
Tatsuya Ikuta, Wataru Shihoya*, Masahiro Sugiura, Kazuho Yoshida, Masahito Watari, Takaya Tokano, Keitaro Yamashita, Kota Katayama, Satoshi Tsunoda, Takayuki Uchihashi, Hideki Kandori*, and Osamu Nureki*.DOI番号
10.1038/s41467-020-19376-7
用語解説
注1 環状ヌクレオチド
サイクリックAMP、サイクリックGMPなどの環状結合をもつヌクレオチド。細胞内においては二次メッセンジャーとして働く。
注2 ロドプシンファミリータンパク質
補因子のレチナールと共有結合して光受容をする膜タンパク質。微生物型ロドプシンと動物型ロドプシンの大きく二つに分けられる。
注3 膜貫通ヘリックス
細胞膜中に存在している膜貫通タンパク質の多くで、細胞膜を貫通する部位はαヘリックスと呼ばれる二次構造を作っており、そのヘリックスは膜貫通ヘリックス(TM)と呼ばれる。
注4 X線結晶構造解析
分子が規則正しく並んで形成された結晶にX線を照射すると得られる回折像を解析し、分子の3次元構造を解明する実験手法。クライオ電子顕微鏡、NMRなどと並んでタンパク質の立体構造を解析するのに用いられる。
注5 襟べん毛虫
1本のべん毛をもつ単細胞の真核生物で、複数体でコロニーを形成する。進化的に動物に最も近い単細胞生物であるといわれている。
注6 高速原子間力顕微鏡(AFM)
試料表面に針で直接触れることで、光学顕微鏡に比べて高分解能で試料を観察できる顕微鏡。
注7 バクテリオロドプシン
初めて発見された微生物型ロドプシンであり、光駆動型のプロトンポンプとして働く。