2021-12-08 東京大学
発表者
本田 玄(東京大学 大学院総合文化研究科 広域科学専攻 博士課程3年(研究当時)/現・東京大学 大学院総合文化研究科 附属先進科学研究機構 特任助教)
澤井 哲(東京大学 大学院総合文化研究科広域科学専攻/生物普遍性連携研究機構 教授)
発表のポイント
- アメーバ細胞の変形を引き起こす、アクチン骨格系の進行波の生成と伝播が曲面上において特異なふるまいを示すことを観測と定量的な解析から明らかにした。
- 細胞による地形感知のメカニズムとして、曲面上を進行する波のパターンとそれに付随して生じるカップ型の膜構造を介した、新たな機構を提唱した。
- 本研究で提唱する地形感知の機構は、生体内など複雑な形状の足場における、細胞の変形や移動の仕組みの理解に資する。
発表概要
熱帯魚のオトシンクルスは、口で器用に植物の茎などをつかみながら移動したり、掴んだ状態で休むことで知られています。このような食べること以外の口の使われ方が、今回、意外なことに、動く細胞にもあることが見いだされました。
東京大学大学院総合文化研究科附属先進科学研究機構の本田玄特任助教(研究当時同大学院生)、大学院総合文化研究科広域科学専攻および同大学生物普遍性連携研究機構の澤井哲教授らの研究グループは、微細加工技術(注1)による細胞接着基板の作製と三次元的な生細胞イメージング計測により、細胞性粘菌アメーバ(注2)の「口」とも言える、飲作用(注3)のカップ形成とその背後にあるアクチン波(注4)が、マイクロメートルの出っ張った形状の物体に接すると発生、伝播しやすいこと、この特性によって細胞外形状が読み取られる結果、細胞が「口」でレール状の構造をつかみながら、それに沿って移動できることを明らかにしました。多細胞組織中には、大小さまざまな形状の構造物が存在し、細胞はそうした複雑な形状を持った空間内を読み取って配置や行き先を決定していると考えられていますが、特に、マイクロメートルスケールの比較的大きな足場の形状情報を細胞がいかに読み取り、自身の変形運動に反映させるのかはこれまでわかっていませんでした。
本研究成果は、アメーバ様の変形を示す細胞が複雑な地形を読み取る機構についての理解を深めたとともに、生体内における免疫細胞や癌細胞などの移動の仕組みの理解と予測にも資することが期待されます。
本成果は、国際科学誌『Proceedings of the National Academy of Sciences of the United States of America』(日本時間 2021年12月8日)に掲載されました。
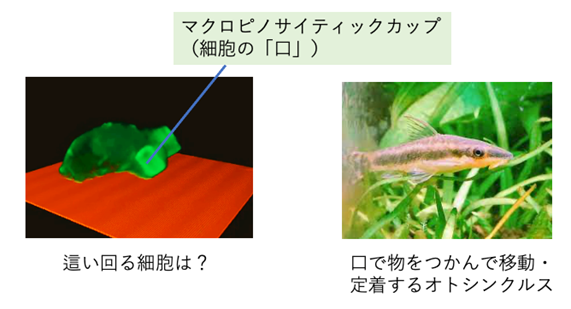
図1:「口」を使って動く生物。(左)細胞性粘菌(右)熱帯魚のオトシンクルス。
発表内容
研究の背景・先行研究における問題点
アメーバや動物細胞の細胞膜の変形は、細胞内部におけるアクチン繊維のネットワーク構造の形成に伴って発生する伸展力と、ネットワークを架橋するミオシン等を介した収縮力によって引き起こされます。細胞が接着する基質表面の微細構造や曲率は、細胞の伸展や這いまわり運動に方向性を与えることが知られています。足場への接着に関する分子クラスター(接着斑)の形成位置や成長の方向が足場の微細構造によって制約され、アクチン繊維が束ねられた太いケーブル(ストレスファイバー)の配向に異方性が生じる機構がよく知られていますが、これは主として上皮・間葉系細胞のような足場への接着が強い細胞にみられます。一方で、アメーバ細胞や免疫細胞のように、大きな接着斑を発達させず速く動く細胞ではストレスファイバーを形成せず、それでも地形に沿った変形や運動を示します。澤井哲教授らの研究グループは、こうした速い遊走性の細胞がいかにして足場の形状情報を読み取るのかを明らかにするにあたり、細胞性粘菌の底面に形成されるアクチン波に着目しました。アクチン波は、細胞底面をアクチン繊維の生成と解体が伝播する現象で、これによって膜伸張が引き起こされます。好中球やマクロファージにおいても類似の現象が観測されています。近年の遺伝学的な研究から、細胞性粘菌のアクチン波は貪食や飲作用の際に形成されるカップ型の膜構造と同一の分子構成を有することが分かっています。貪食の成功の可否は対象となる粒子のサイズや形状に依存することから、アクチン波には足場の形状に依存した生成や伝播が観測される可能性がありました。
研究内容
微細加工技術を用いたマイクロスケールの凸構造を有する基質の作製と細胞の這いまわり運動の観測により、レール状の凸構造(リッジ)に沿って細胞が移動していく様子が捉えられました(図2)。リッジに沿った細胞の移動が生じる分子機構を明らかにするため、共焦点顕微鏡によってアクチン骨格系の生細胞イメージングを行いました。細胞底面を伝播するアクチン波は、平坦な基質上ではランダムに伝播方向を変え、細胞の突出変形を引き起こすものの、正味の重心移動はほとんど生じさせません。一方、リッジ上においてアクチン波は一次元的な伝播を示し、細胞の前側に局在してリッジに沿った細胞の移動を生じさせました。リッジ上での細胞の方向転換はアクチン波の伝播方向の反転に伴って生じ、アクチン波が頻繁に伝播方向を変える場合には細胞の直進運動は起こりませんでした。PI3キナーゼ(注5)阻害剤によるアクチン波の消失に伴い、細胞のリッジに沿った移動が失われたこと等から、この直進運動にはアクチン波が必要であることが確認されました。

図2:レール状の構造上にトラップされたアクチン波と、その伝播に伴って移動する細胞性粘菌アメーバ。右端の画像上の数字は時刻(単位:分)、スケールバー:10 µm。
それでは、アクチン波の伝播方向を決定する要因は何でしょうか? この問いに答えるため、微細加工技術を駆使した様々な形状の基質-大きな段差型の構造や、頂端部が尖ったリッジ、ジグザグに曲がりくねったリッジ-を用いた観測を行いました。その結果、アクチン波には基質の凸曲面に沿って伝播する性質と、凹曲面を横ぎらない性質があることが見いだされました(図3)。アクチン波を構成するアクチン繊維の集積量には凸凹の曲率依存性があることや、アクチン波の生成がリッジ上で起こること、およびこの傾向は上流のシグナル分子(Ras GTPアーゼ、PI3キナーゼ)(注5)においても見られたことから、アクチン波の生成反応には膜曲率依存性があることが示唆されました。さらに同研究グループは三次元的なシミュレーションにより、凸曲面上で生成した反応拡散波が膜の突出を促してリッジ表面に沿ったカップ型の膜構造を形成するとき、リッジに沿った波の伝播と細胞の移動が再現されることを示しました。細胞の表面張力を表すパラメータの値を低下させた場合にはリッジに沿った運動が失われましたが、これはミオシン重鎖を欠損した変異体の表現型を再現しています。これらのことから、凹曲面における波の停止には細胞の背側の張力が関与していることが示唆されました。
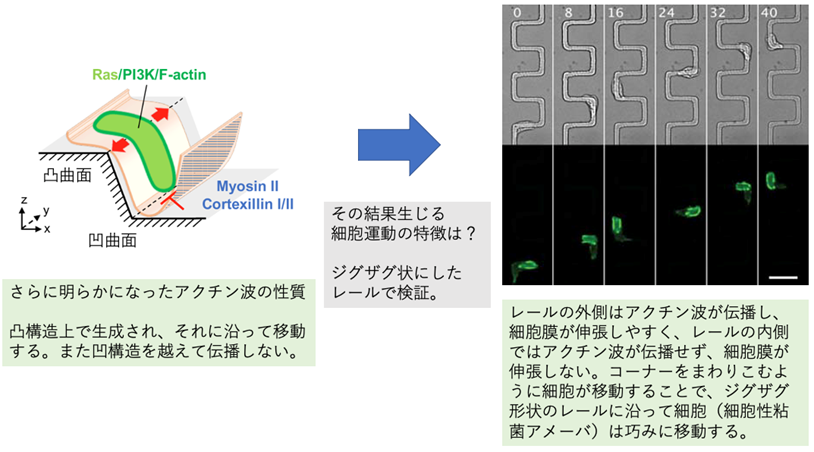
図3:足場の曲率とアクチン波の伝播方向の関係。(左)模式図(右)ジグザグ状のレールに沿ったアクチン波の伝播と細胞の移動。画像上の数字は時刻(単位:分)。スケールバー:20 µm。
社会的意義・今後の予定
本研究から、アクチン波とそれに伴う細胞の変形が細胞外地形によって制御可能であることが示されました。アクチン波は、細胞や細胞集団の極性形成との関係が深く、細胞の集団秩序を律する際の情報処理特性に関わっています。免疫細胞や癌細胞でアクチン波と類似の現象が報告されていることから、多細胞組織内におけるこれらの細胞の移動経路の理解や制御手法の開発へとつながることが期待されます。
本研究は主に、JST CREST「細胞動態スペクトラムから紐解く多細胞秩序の創発規則」ならびに新学術領域研究「情報物理学でひもとく生命の秩序と設計原理」、学術振興会特別研究員制度の支援を受けて行われました。
用語解説
(注1)微細加工技術:
基板上にナノ–マイクロメートルスケールの微細な構造を作製する技術。決められた幅や高さの凸凹構造を高い再現性で作製することができる。マイクロ流体デバイスの作製をはじめとして細胞生物学実験、細胞の地形感知の研究にもよく使用される。
(注2)細胞性粘菌 Dictyostelium discoideum:
土壌中に生息する真核細胞。培養や遺伝子改変の容易さと、細胞運動やシグナル伝達など動物細胞との共通性を有することから、分子生物学、細胞生物学などにおけるモデル生物。
(注3)マクロピノサイトーシス(飲作用):
細胞膜をカップ状に変形させ、細胞外の液体を取り込む過程。
(注4)アクチン波:
アクチンタンパク質の重合反応が細胞膜上において生起し、その一過的な反応の連鎖が膜上を空間的に伝播する現象。
(注5)Ras GTPアーゼ、PI3キナーゼ:
細胞内シグナル因子。アクチン重合の調節経路においても、細胞外の誘引因子と受容体との結合状態を反映した活性を示すことで知られる。
論文情報
本田玄、斉藤稔、藤森大平、橋村秀典、中村允、中島昭彦、澤井哲*, “Micro-topographical guidance of macropinocytic signaling patches,” Proceedings of the National Academy of Sciences of the United States of America: 2021年12月8日, doi:10.1073/pnas.2110281118.
論文へのリンク (掲載誌)