日本のバイオインダストリー推進の原動力として期待
2020-11-30 新エネルギー・産業技術総合開発機構,徳島大学
NEDOと徳島大学は、植物などの生物を用いた高機能品生産技術の開発「スマートセル」プロジェクトで、海外知財に依存しない国産の新規ゲノム編集技術の開発に取り組んでいます。このたび、世界で初めて、新しいゲノム編集ツールCRISPR-CasタイプI-D(TiD)が、植物細胞の遺伝子改変技術として有効であることを実証しました。
TiDは現在主要に用いられているCRISPR-Cas9のゲノム編集技術と比較し、狙ったDNA配列を認識する特異性が高く、より広範囲な様式の変異をゲノムに導入する技術であることが明らかになりました。さらに、TiDは海外のゲノム編集知財に抵触しない新規ゲノム編集技術として活用できる可能性があり、今後、日本でのバイオインダストリー推進の原動力としての貢献が期待されます。
1.概要
国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)では、植物や微生物の細胞が持つ物質生産能力を人工的に最大限引き出した生物合成技術「スマートセル」を構築し、生産が難しい有用化合物の創製や生産性をより向上させた合成技術の開発など、物質生産における基盤技術および実用化技術開発を目的とした研究開発プロジェクト(スマートセルプロジェクト※1)を推進しています。この取り組みの中で、遺伝子の機能を改良する技術であるゲノム編集は「スマートセル」の構築に利用できる技術の一つとして重要です。しかし現在、汎用的なゲノム編集ツールは主に海外の技術であり、利用する際の知的財産権に関わるコストの問題などがあるため、国内産業に活用しやすい国産ゲノム編集技術の開発が強く求められていました。
国立大学法人徳島大学(徳島大学)では、2016年よりスマートセルプロジェクトに参画し、海外知財に依存しない効率の良い国産ゲノム編集技術の開発を進めてきました。機能が不明であったCRISPR※2のうち、これまでにゲノム編集に使われてこなかったCRISPR-CasタイプI-D(TiD)※3を見いだし、このたび、世界で初めてTiDによる植物細胞の遺伝子改変に成功しました。TiDは、既存のゲノム編集技術であるCRISPR-Cas9※4などと比較して、導入できる変異の様式が多様で、従来のゲノム編集技術に比べ、標的とする配列以外のDNA配列上に予期せぬ変異が起こるオフターゲット変異のリスクが低いことがわかりました。TiDは、国産の新しいゲノム編集技術として、植物以外にも動物や微生物などさまざまな生物の遺伝子機能改変に活用が可能であり、従来のゲノム編集知財に依存しない技術として利用が期待できます。
本研究成果は、日本時間2020年11月6日午後7時(米国東部時間11月6日午前5時)にCommunications Biology※5オンライン版に掲載されました。
2.今回の成果
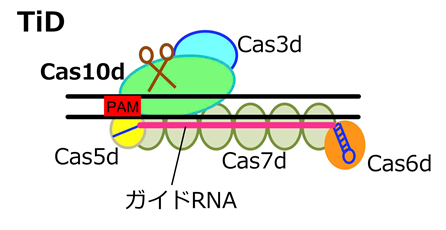
徳島大学は、多様なCRISPRの中から、これまで機能が不明だったCRISPR-CasタイプI-Dに注目し、標的の認識やDNA切断のメカニズムを明らかにすることでゲノム編集ツールとして利用できることを見いだし、このシステムをTiDと名付けました(図1)。CRISPR-Casシステムは、細菌や古細菌における獲得性免疫システムとして発見され、構成要素としてCasと呼ばれる複数タンパク質が複合体を形成してDNAを切断する活性を持つClass1と、一つのCasタンパク質のみで切断するClass2に分類されます。ゲノム編集技術として広く用いられているCRISPR-Cas9はClass2に属しています。TiDはClass1に分類され、Cas10dと呼ばれる、これまで機能が不明であったCasタンパク質を含んでいます(図1)。TiDは複数のCasタンパク質により複合体を形成することも予測されました(図1)。
CRISPR-Casを用いたゲノム編集技術では、Casタンパク質との複合体中に含まれるガイドRNAにより、ゲノム中の特異的なDNA配列が標的として認識されます。TiDが認識するDNA配列の特徴を解析したところ、ガイドRNAにより認識されるDNA配列は35~36塩基であることが判明しました。これは、既存のゲノム編集ツールであるCas9の標的配列長(20塩基)に比べ15~16塩基も長く、標的配列を認識する際に結合の特異性が強くなり、ゲノム編集の問題点の一つであるオフターゲット変異のリスク低減を期待できます。さらに、TiDによる変異導入は、既存のCRISPRとは異なる特徴を持つCasタンパク質であるCas10dによって引き起こされることが明らかとなりました。
徳島大学では、次に、TiDが植物細胞においてゲノム編集技術として利用できることを検証するため、TiDを植物細胞において発現させたところ、CRISPR-Cas9を用いたゲノム編集で見られるような数塩基程度の短い塩基配列の変異と、数kbから10数kbの広範囲のDNAが欠失する変異の、二つのタイプの変異が存在することが明らかになりました(図2)。TiDにより変異が導入された植物体では、体細胞レベルで全てのDNAに変異が導入された個体の再生に成功しました(図2)。得られた変異体※6では、オフターゲット変異が起きていないことも実験的に示されています。さらに、ヒト培養細胞を用いた実験においても同様の結果が得られており、以上の結果は、TiDが効率的に変異体を作出するために有用なゲノム編集ツールであることを示しています。
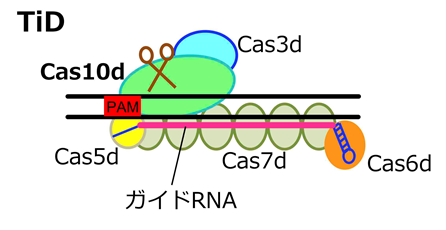
図1 新しいゲノム編集技術“TiD”の模式図
TiDは、タイプI-Dサブタイプに属するCRISPRシステムの一種です。これまで機能が分かっていませんでしたが、今回ゲノム編集技術として利用できることが初めて示されました。黒線は標的配列を含むDNA二本鎖を、赤線はガイドRNAを示します。ガイドRNA配列と標的配列が相補鎖を作ることで、TiDが標的DNAに結合します。PAMは標的となる配列の近傍に存在し、CRISPR-CasシステムがDNAに結合する際に利用される特定の配列です。図に示した5つのCasタンパク質とガイドRNAが複合体を作り、変異が導入されます。
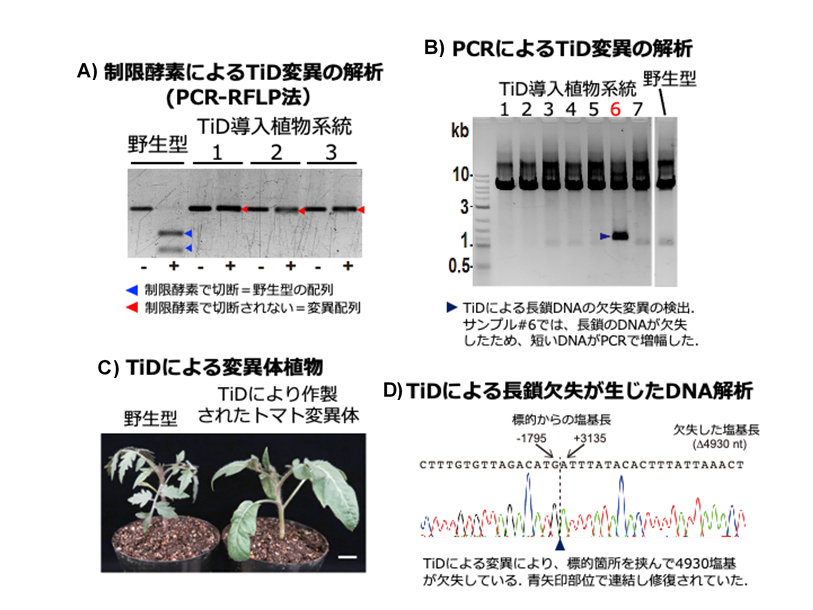
図2 TiDを用いたゲノム編集によるトマト変異体の作出
TiDを植物細胞に導入することで、標的とするDNAに変異が導入されました。 AはPCR-RFLP法※7による変異解析の結果を示しました。PCRにより増幅した短いDNA断片を制限酵素切断すると、野生型植物の場合、DNA断片が切断されます(Aの青矢印)。TiDを導入した植物では制限酵素により切断されないDNAが検出され、変異が導入されたことが示されました(Aの赤矢印)。+、-は制限酵素反応の有無を示します。BはPCRにより長いDNA領域を増幅した検出法です。CはTiDを導入後に組織培養により再生されたトマト変異個体です。DはTiDによる長鎖欠失変異が生じたDNAシーケンス解析です。
3.今後の予定
TiDは、標的配列特異性が高いことに加えて、従来のCRISPR由来ゲノム編集ツールにはない特徴をもつゲノム編集技術であり、従来の海外ゲノム編集知財に抵触しない新しい技術として有望です。今後は、TiDの変異導入効率の向上や、さまざまな機能ドメインを付与した多様なゲノム編集ツール化を進めることで、日本のバイオインダストリー産業の発展につながると期待できます。
NEDOでは、本件の後継事業として「カーボンリサイクル実現を加速するバイオ由来製品生産技術の開発」プロジェクト(バイオものづくりプロジェクト)を2020年度より立ち上げ、原料から最終製品に至るボトルネック(原料供給やスケールアップの難しさ)の解消を進めていきます。
【注釈】
- ※1 スマートセルプロジェクト
- 事 業 名:植物等の生物を用いた高機能品生産技術の開発
事業期間:2016年度から2020年度
参 考:『Natureオンライン』掲載のプロジェクト記事:Nature Focal Point on Synthetic Biology in Japan - ※2 CRISPR
- Clustered Regularly Interspaced Short Palindromic Repeatsの略称です。真正細菌や古細菌が持つファージなどに対する獲得免疫機構の一つで、標的DNAを認識するRNA分子(ガイドRNAと呼ばれる)およびガイドRNAと複合体を形成するCas(CRISPR associated)タンパク質からなります。標的の認識には現段階で30種を超える多様なCRISPRシステムが同定されています。
- ※3 CRISPR-CasタイプI-D(TiD)
- 30種を超える多様なCRISPRの中で、複数のCasタンパク質とガイドRNAから構成されるグループ(Class1)に属するCRISPRの一つ。Cas10dを含んでおり、二本鎖DNAに結合する特徴を持つ。タイプI−Dは水圏棲息バクテリアの他、一部の古細菌に見いだされています。
- ※4 CRISPR-Cas9
- 2012年に開発されて以来、ライフサイエンスやバイオテクノロジーを利用するさまざまな分野において、遺伝子改変に用いられる主要なゲノム編集技術です。本技術を開発したシャルパンティエ博士とダウドナ博士は2020年にノーベル化学賞を受賞しました。DNAを切断する酵素であるCas9と標的配列を認識するガイドRNAにより構成されています。
- ※5 Communications Biology
- Nature Researchが提供する、生物科学の全分野における高品質な論文・総説・論評を出版するオープンアクセス・ジャーナルです。
Communications Biology誌のHP
本研究の成果論文 Genome editing in plants using CRISPR type I-D nuclease - ※6 変異体
- 特定の表現型を得ることを目的として、その表現型に関わる遺伝子の機能を欠損させるなど、DNAに変異を入れた生物個体のことです。育種分野においては、従来は放射線や化学物質によるランダムな変異導入技術が主要でしたが、ゲノム編集技術が開発されたことにより、狙った遺伝子や配列への変異の導入を迅速に行うことが可能になりました。
- ※7 PCR-RFLP法
- 変異検出を行う実験方法の一つで、ゲノム編集の標的としたDNA配列中に制限酵素切断サイトが含まれる場合に用います。PCRを用いて標的箇所を増幅したDNAを制限酵素で切断すると、野生型では制限酵素によりDNA切断されますが、ゲノム編集により変異が導入されると、DNAが切断されないため、この違いにより変異を検出する方法です。
4.問い合わせ先
(本ニュースリリースの内容についての問い合わせ先)
NEDO 材料・ナノテクノロジー部 バイオエコノミー推進室 担当:土谷、林
徳島大学大学院社会産業理工学研究部 担当:刑部
(その他NEDO事業についての一般的な問い合わせ先)
NEDO 広報部 担当:坂本、鈴木(美)